Métodos de detecção de Listeria monocytogenes em carcaça bovina
índice
- 1. INTRODUÇÃO
- 2. REVISÃO BIBLIOGRÁFICA
- 2.1 Listeria monocytogenes
- 2.2 Listeriose
- 2.3 Contaminação
- 2.4 Coleta de amostras
- 2.5 Métodos de detecção
- 2.6 Controle de qualidade
- 2.6.1 Boas Práticas de Fabricação
- 2.6.2 Procedimento Padrão de Higiene Operacional
- 2.6.3 APPCC
- 2.6.4 Rastreabilidade
- 2.6.5 Rastreabilidade da Carne Bovina
- 2.7 Legislação
- 3. CONSIDERAÇÕES FINAIS
- 4. REFERÊNCIAS BIBLIOGRÁFICAS
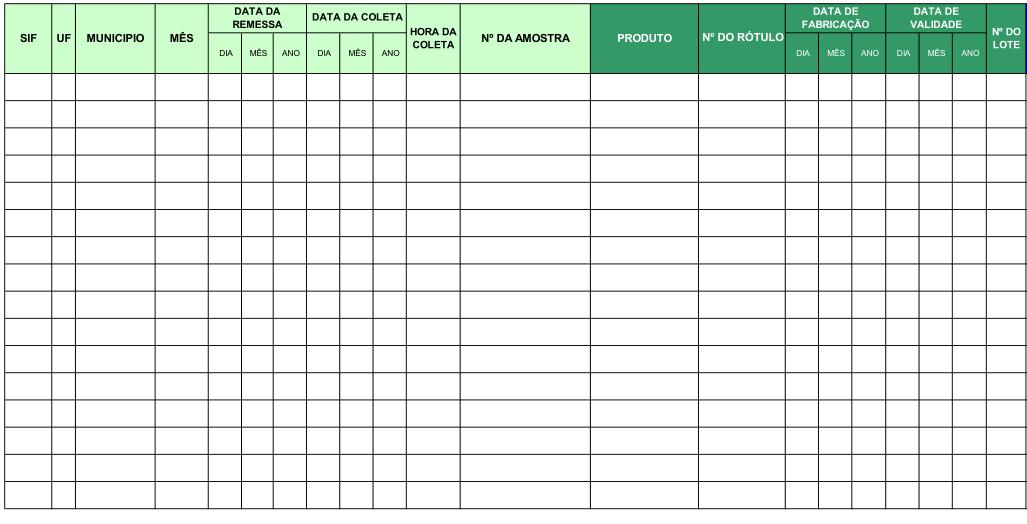
- 5. ANEXO A – SOLICITAÇÃO OFICIAL DE ANÁLISE (SOA)
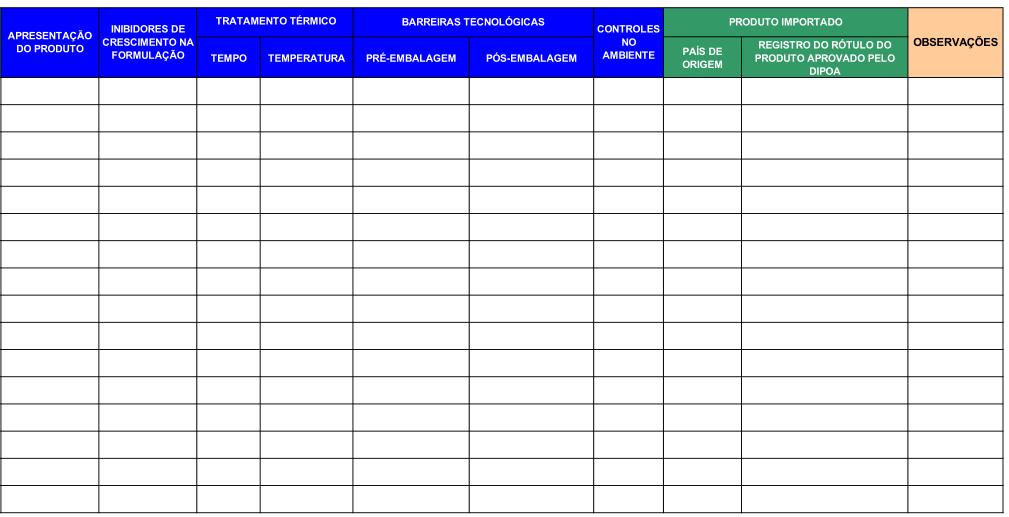
- 6. ANEXO B - PLANILHA DE INFORMAÇÕES COMPLEMENTARES PARA O PROGRAMA DE CONTROLE DE Listeria monocytogenes EM PRODUTOS PRONTOS PARA O CONSUMO – LANAGRO.
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
RESUMO
A exportação de carne bovina possui lugar de destaque na economia brasileira, sendo um dos maiores exportadores do mundo segundo a ABIEC (Associação Brasileira das Indústrias Exportadoras de Carnes), e, com o intuito de aumentar a disputa por novos mercados, tem-se buscado a produção de alimentos de qualidade e seguros. A carne e seus derivados apresentam grande valor na alimentação humana e se enquadram entre os alimentos de origem animal mais perecíveis, principalmente pela sua variedade e riqueza nutricional, principalmente como fontes de proteína, vitaminas do complexo B e de minerais essenciais como ferro e zinco. São consideradas um importante veículo de agentes zoonóticos e especial meio de cultura para o desenvolvimento e multiplicação de uma ampla gama de microrganismos. A Listeria monocytogenes é encontrada na natureza e no trato intestinal dos animais, sendo assim, é comum a contaminação da carcaça e cortes de carne durante o abate e o processamento. Este microrganismo é considerado um patógeno emergente, podendo ocasionar listeriose em humanos através da ingestão de alimentos contaminados com o mesmo. A listeriose é uma zoonose de grande importância na saúde pública, podendo ocasionar aborto, septicemias e meningites. O grupo de risco é composto por gestantes, crianças, idosos e pacientes imunodeprimidos, nos quais a doença é altamente perigosa. Sua importância em alimentos está relacionada com a sua capacidade de resistir a temperaturas de refrigeração, alta ocorrência em alimentos e diversos surtos de listeriose por todo o mundo envolvendo ingestão de alimentos manipulados inadequadamente ou malcozidos.
Palavras-chave: carne, Listeria monocytogenes, listeriose, alimentos.
ABSTRACT
The export of beef has a prominent place in the Brazilian economy, being one of the largest exporters in the world according to ABIEC (Brazilian Association of Meat Exporting Industries), and in order to increase the dispute for new markets, has been seeking the production of quality and safe food. Meat and meat products are of great value in human food and are among the most perishable animal foods, mainly for their variety and nutritional richness, especially as sources of protein, B vitamins and essential minerals such as iron and zinc. They are considered an important vehicle of zoonotic agents and a special culture medium for the development and multiplication of a wide range of microorganisms. Listeria monocytogenes is found in the wild and in the intestinal tract of animals, so carcass contamination and meat cuts are common during slaughter and processing. This microorganism is considered an emerging pathogen and can cause listeriosis in humans through ingestion of food contaminated with it. Listeriosis is a zoonosis of great importance in public health and can cause miscarriage, septicemia and meningitis. The at-risk group is pregnant women, children, the elderly, and immunocompromised patients in whom the disease is highly dangerous. Its importance in food is related to its ability to withstand refrigeration temperatures, high occurrence in food and various outbreaks of listeriosis around the world involving ingestion of improperly handled or undercooked foods.
Keywords: meat, Listeria monocytogenes, listeriosis, food.
1. INTRODUÇÃO
O papel do médico veterinário realizado na inspeção sanitária em abatedouros e frigoríficos é de extrema importância, pois contribui para a obtenção de produtos alimentares com boa qualidade higiênico-sanitária. Nos últimos anos e por imposição legal, a atividade médico-veterinária passou a ter caráter mais abrangente na inspeção de abatedouros, não se restringindo apenas a inspeção ante e post mortem, ou seja, ao estado de saúde dos animais. Segundo a Organização Mundial da Saúde Animal (OIE), o papel dos Serviços Veterinários tem se estendido da fazenda ao matadouro, onde os veterinários exercem uma dupla responsabilidade – a vigilância epidemiológica das doenças dos animais e garantia da segurança da carne.
Na área da inspeção, o médico veterinário é responsável pela verificação dos programas de controles do estabelecimento os quais apresentam foco no bem-estar animal, controle da contaminação superficial das carcaças e derivados, a higiene da execução das operações de abate, dos equipamentos, dos utencílios, das instalações, do pessoal e no controle de pragas, bem como na fiscalização do processamento, armazenamento e transporte das carnes. O resultado disso pode ser notado pelo próprio consumidor, que ao comprar um produto, pode verificar a marca do serviço de inspeção, autorizando o mesmo para a comercialização, garantindo que os produtos estejam dentro dos critérios técnicos de qualidade e aptos para evitar qualquer tipo de transmissão de doenças. Logo, o médico veterinário tem a função de garantir também a saúde dos humanos.
A carne é um dos alimentos mais importantes, tanto pelo seu valor nutricional, como pelo seu valor sensorial. É um alimento básico para suprir as necessidades de proteínas de alta qualidade. No Brasil, a carne bovina é um item importante da dieta da população e apresenta um dos maiores potenciais de crescimento. As proteínas da carne são as mais completas em termos de qualidade, apresentam um perfeito equilíbrio de aminoácidos essenciais, além de ser uma excelente fonte de lipídios essenciais, vitaminas do complexo B e de alguns minerais como ferro e zinco (FELÍCIO, 2009).
Por outro lado, a carne, assim como seus derivados, tem sido implicada como uma das principais fontes de infecção de origem alimentar e o elo mais importante entre os animais produtores de alimentos e o homem (MAYRHOFER et al., 2004). Isso porque, a carne possui uma composição química que a torna um ótimo meio de cultura, pois possui alta atividade de água, é rica em substâncias nitrogenadas, minerais e fatores de crescimento. E também, seu pH é favorável para a maioria dos microrganismos, sendo que a quantidade e os tipos que se desenvolverão na carne dependerão das condições de abate a que o animal foi submetido, das condições de estresse nesse momento, entre outros fatores (FRANCO; LANDGRAF, 2008).
Os problemas envolvendo a segurança no consumo da carne, ocorridos já há muitos anos, ainda são lembrados pelos consumidores devido a sua seriedade e gravidade, promovendo impacto sobre a sociedade, sobre o comércio mundial de alimentos e principalmente sobre a comunidade científica, impondo um novo paradigma para a oferta de alimentos. Um novo modelo foi imposto pela própria Organização das Nações Unidas (ONU) como condição necessária ao comércio internacional a partir do ano de 2000, mais abrangente e contemplando com medidas preventivas a maior parte das preocupações higiênico-sanitárias.
Adicionalmente às exigências e controles anteriormente praticados, foi eleita uma série de outras práticas e procedimentos, cada uma com suas novas tarefas, compromissos e responsabilidades, num modelo baseado na Análise de Perigos e Pontos Críticos de Controle (APPCC). Em todo o mundo, ainda constitui um modelo em desenvolvimento, cujas prática e experiência ainda estão longe de ser consideradas consolidadas. Por outro lado, a intensificação da produção de bovinos no Brasil é notória, principalmente durante a última fase do sistema – a da terminação ou engorda.
As referidas práticas, além do desacordo e falta de sintonia quanto às exigências de mercado, impõem outros problemas ao processo de obtenção de carnes com qualidade: principalmente o manejo de animais estressados e suas consequências e a condição de animais sujos no momento do abate, advinda de animais de cruzamento, com pelos mais longos e por acúmulo de sujidade e fezes aderidos à pele.
No abate de bovinos, esse novo modelo inseriu uma série de controles rotineiros objetivando respaldar as práticas executadas e corrigir em tempo hábil possíveis problemas antes mesmo que eles se efetivem. Mesmo assim, são recentes e com resultados confinados aos próprios locais de execução ou nas próprias empresas, pouco divulgados ou conhecidos enquanto experiências que necessitam ser francamente compartilhadas de acordo com os preceitos da Análise de Risco.
Cuidados especiais antes, durante e após o abate dos animais reduzem ao mínimo possível a contaminação inicial, visto que a contaminação bacteriana na superfície das carcaças bovinas é uma consequência inevitável da esfola e do próprio processamento de abate. Os cuidados devem acompanhar toda trajetória da carne, seja nas câmaras frias, na desossa, no processamento, na armazenagem, no transporte, na distribuição ou no âmbito doméstico (MINIHAN et al., 2003; PARDI et al., 2006).
Este trabalho tem o objetivo de orientar sobre a prevalência da bactéria Listeria monocytogenes em carcaça bovina, levando em consideração como o animal se contamina, como evitar essa contaminação pelos meios de profilaxia e os métodos de diagnóstico para identificá-la na carne, além de sua importância na saúde pública, visto que se trata de uma bactéria causadora da listeriose, uma importante doença zoonótica.
2. REVISÃO BIBLIOGRÁFICA
2.1. Listeria monocytogenes
O gênero Listeria possui seis espécies, são elas L. monocytogeneis, L. ivanovii, L. seeligeri, L.innocua, L.welshimeri e L. grayi, porém, somente duas espécies são consideradas patogênicas, a L. monocytogenes para o homem e animais e a L. ivanovii para os animais. Uma diferença notável entre essas duas espécies patogênicas é o seu poder de hemólise.
A L. monocytogenes é definida como bastonete regular Gram positivos, não formam esporos, nem cápsulas e são aeróbios ou anaeróbios facultativos. Possuem flagelos que permitem sua movimentação, sendo móveis a temperaturas de 20°C a 25°C, com movimentos característicos de tombamento, e imóveis a 35°C. Ao microscópio apresentam-se como pequenos bacilos medindo de 1,0 a 2,0 μm de comprimento por 0,5 μm de diâmetro. Podem aparecer isolados, em cadeias curtas ou formando agregados em forma de V, Y e K (Figura 1) ou ainda dispostos em paliçadas.
Figura 1 – Listeria monocytogenes observadas por microscopia eletrônica de varredura (MEV).
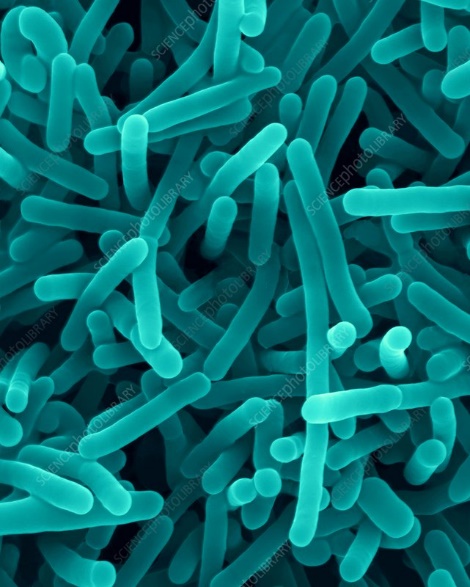
Fonte: KUNKEL, 2004.
Quanto as características químicas, são microrganismos catalase positiva e oxidase negativa, apresentando colônias arredondadas, translúcidas, convexas e de bordas regulares em ágar nutriente. Apresentam coloração cinza azulada pela iluminação normal e produzem um brilho verde azulado característico quando a luz é transmitida obliquamente, após 24h-48h de incubação (ROCOURT; BUCHIESER, 2007). São quimiorganotróficos, ou seja, usam compostos orgânicos como fonte de energia e carbono.
É um dos poucos microrganismos patogênicos que pode se multiplicar em substratos com atividade de água tão baixa quanto 0,93 e em meio de cultura com 10% de NaCl (FARBER et al., 1991; ROCOURT, 1999). Possuem ampla distribuição ambiental, com caráter ubiquitário, tendo sido isolado de águas superficiais, de esgotos domésticos, águas residuárias de indústrias de laticínios e de abatedouros, de solos, de insetos, de adubo orgânico e em fezes de animais e inclusive de humanos. Pode também ser isolada em diversos produtos alimentícios como carne bovina, queijos, leite cru e pasteurizado, queijos, carne moída de diferentes animais, produtos cárneos crus e de equipamentos e utensílios em plantas de processamento de carne bovina (BARROS et al., 2004; LANDGRAF, 2007; KOVACEVIC et al., 2012; MANTILLA et al., 2007; SORIANO et al., 2001; YÜCEL et al., 2005).
A ampla distribuição ambiental da L. monocytogenes, assim como as outras espécies, é favorecida pela sua capacidade de se desenvolver em temperaturas entre 0°C e 45°C e, embora sua faixa ótima seja entre 30°C e 37°C, pode sobreviver em alimentos congelados. O pH de multiplicação varia entre 4,4 e 9,6, mas se multiplica melhor entre 6 e 8, sendo 7,0 o pH ótimo (ROCOURT, 1999). Por ser ácido tolerante, pode sobreviver em alimentos de baixa acidez por dias ou semanas.
Os parâmetros de multiplicação desse microrganismo podem ser melhor visualizados na Tabela 1.
Tabela 1 - Parâmetros de multiplicação de L. monocytogenes.
|
Parâmetros |
Mínimo |
Ótimo |
Máximo |
|
Temperatura (°C) |
-0,4 |
37 |
45 |
|
pH |
4,4 |
7,0 |
9,6 |
|
Tolerância a sal |
- |
10% |
25% a 4ºC |
|
Atividade de água |
0,92 |
0,97 |
0,97 |
Fonte: adaptada de Wan Norhana et al., 2010.
Este conjunto de características faz com que a L. monocytogenes seja um patógeno emergente de grande interesse na área de alimentos e explica o destaque que estes microrganismos vêm ocupando nos últimos anos no controle de qualidade na indústria de alimentos, visto as dificuldades de sua eliminação, assim como, a possibilidade de causar uma doença grave no consumidor pela ingestão de alimentos contaminados, principalmente os que não foram submetidos ao tratamento térmico antes do consumo, onde os sintomas incluem septicemia, meningite, encefalite e infecção cervical ou intrauterina em gestantes, podendo causar abortamento. Além disso, outros sintomas podem ocorrer, como endocardite, abscessos, lesões cutâneas, além de sintomas gastrointestinais e outros semelhantes aos da gripe (SILVA et al., 2010).
A transmissão pode se dar por contato direto ou indireto com fontes contaminadas, por via oral, ocular, cutânea, respiratória e urogenital (HOLT et al., 1994), porém a transmissão através da ingestão de alimentos contaminados é a forma mais comum e mais importante. Um grande número de surtos de origem alimentar ocorreu no mundo tendo essas bactérias envolvidas; e os principais alimentos são aqueles prontos para consumo, que são armazenados por longos períodos em refrigeração, principalmente os produtos cárneos (INGHAM et al., 2004).
2.2. Listeriose
Listeriose é a denominação de um grupo geral de desordens causadas pela Listeria monocytogenes. Ficou conhecida como uma importante zoonose transmitida por alimentos após surtos de Listeriose que ocorreram na América do Norte e na Europa em 1980. É considerada um sério problema na saúde pública, sendo uma das mais severas infecções de origem alimentar apresentando severidade dos sintomas e alta mortalidade que pode chegar até 50% (ROCOURT; JACQUET; REILLY, 2000). Pode afetar diversas espécies, mas principalmente ovinos, caprinos, bovinos e humanos.
A principal via de transmissão da listeriose é pela ingestão de alimentos contaminados, seja em casos esporádicos ou em surtos (WHO, 1988). No entanto, foram reportados casos da doença em pessoas que contactaram diretamente os animais infectados, manifestando-se como infecção cutânea (OWEN et al., 1960; MCLAUCHLIN; LOW, 1994). E também foi demonstrada a via de transmissão nosocomial através da contaminação cruzada no período neonatal. Durante o parto, seja de humanos ou de outros animais, o elevado número de microrganismos presentes no aparelho genital materno ou nos instrumentos (contaminados durante o parto), leva à transmissão ao recém-nascido (MCLAUCHLIN, 1996).
Ao contrário da maioria dos patógenos, que geralmente provocam apenas gastrointestinais, a listeriose se caracteriza também por sintomas no sistema nervoso central como, meningite, encefalite ou meningoencefalite e outros sinais como septicemia, infecção cervical ou intrauterina em gestantes, que podem provocar aborto espontâneo (2º ou 3º trimestre) ou natimortos. O início dessas desordens é comumente precedido por sintomas semelhantes ao da gripe, com febre persistente. Sintomas gastrintestinais, como náusea, vômito e diarreia podem preceder ou acompanhar as formais mais graves da Listeriose. Outros sintomas como endocardite, miocardite, pneumonia, hepatite, artrite, osteomielite, otite e abscessos localizados são formas atípicas, mas que podem estar presentes em 5 a 10% dos casos (VÁZQUEZ-BOLAND et al., 2001).
O período de incubação é variável, acredita-se que os sintomas podem ocorrer de 3 a 70 dias após a exposição, mas a média é estimada em 3 semanas. A dose infectante da L. monocytogenes é desconhecida, pode variar conforme a cepa e a susceptibilidade da vítima. A gravidade da doença depende do tipo de infecção e das condições imunológicas do hospedeiro, sendo mais grave em pacientes que fazem parte dos grupos de risco: gestantes, neonatos, idosos, indivíduos com imunidade adquirida ou induzida como aqueles portadores do vírus da imunodeficiência (HIV), transplantados, diabéticos e portadores de neoplasias fazendo uso de quimioterápicos (FARBEN; PETERKIN, 1991; RAMASWAMY et al., 2007; SWAMINATHAN; GERNER-SMIDT, 2007).
O diagnóstico de listeriose é baseado no isolamento e identificação da bactéria a partir de uma amostra de sangue, do líquido cefalorraquidiano (LCR), do líquido amniótico, da placenta e/ou do feto (GERMANO; GERMANO, 2008). Porém, para a detecção da mesma, os métodos convencionais utilizados são laboriosos, requerendo vários dias para sua identificação final, além se ser um diagnóstico relativamente caro.
O tratamento consiste na administração de altas doses de penicilina ou ampicilina normalmente associada a um aminoglicosídeo geralmente gentamicina (HOF, 2004) por 2 a 3 semanas para neonatos e 2 a 4 semanas para adultos imunodeprimidos com meningite e bacteremia e ainda superior para casos complicados, tais como endocardite (PAINTER; SLUTSKER, 2007). Apesar de quase todas as cepas de Listeria serem susceptíveis à maioria dos antibióticos, a taxa de cura é apenas de 70%. As cepas de L. monocytogenes são resistentes às cefalosporinas, e por esse motivo não devem ser utilizadas no tratamento da listeriose (SCHLECH, 2000; SWAMINATHAN; GERNER-SMIDT, 2007).
Medidas de controle e prevenção estão baseadas em programas de análise de risco e de pontos críticos de controle e recomendações específicas para grupos de alto risco. Como a listeriose humana é uma zoonose em que a principal fonte de transmissão são os alimentos contaminados, há a necessidade de implantação de um rigoroso controle de qualidade nas áreas de manipulação de alimentos a fim de reduzir e eliminar a Listeria dos mesmos, aumentando a sua segurança, principalmente em produtos com alta umidade, tais como presuntos, queijos, carnes, frangos, vegetais, leite cru e pasteurizado.
A ampla distribuição de Listeria no ambiente facilita a sua entrada em fábricas e matadouros e as suas características (multiplicação a temperaturas de refrigeração, produção de biofilmes) ajudam a que esta consiga sobreviver nas instalações por longos períodos de tempo. Assim, a sua introdução é inevitável, mas a contaminação dos alimentos pode ser reduzida através de uma higiene meticulosa (SCHLECH, 2000). Para eliminar os agentes bacterianos da cadeia é fundamental a introdução de passos fundamentados nas unidades fabris, assim como a respectiva monitorização. Deve ser dada maior atenção à formação dos trabalhadores, pois além de serem potenciais fontes de entrada de microrganismos para as instalações, podem igualmente ser responsáveis pela contaminação cruzada, quando são negligenciadas as regras básicas de manipulação dos alimentos.
A educação dos consumidores também é de extrema importância para a prevenção da listeriose, principalmente dos grupos de risco. Um adequado processamento térmico dos alimentos, uma correta armazenagem de produtos refrigerados (< 4°C), uma limpeza regular dos frigoríficos e o consumo de alimentos “pronto para consumo” o mais rápido possível são algumas recomendações que devem ser fornecidas. A comunidade médica tem aqui um papel de relevância (LIU, 2008).
2.3. Contaminação
O animal vivo em si é considerado uma das principais fontes de contaminação da carcaça na indústria da carne, particularmente nos meses de inverno quando os animais são estabulados (GRACEY; COLLINS, 1992). Peles e pelos que contenham sujidades e fezes podem carregar milhões de bactérias aeróbias e anaeróbias para o interior dos ambientes de abate e processamento. Essa contaminação pode ser causada pelo tipo de solo das pastagens, pelas condições de higiene e limpeza corporal dos animais, da qualidade do ar e da água utilizada na lavagem da carcaça, das condições dos equipamentos e utensílios utilizados, do controle de ambiente nos quais os processos são realizados e do próprio pessoal no trabalho; além da própria contaminação pelo conteúdo gastrintestinal devido a microbiota específica presente (PARDI et al., 2006).
Sob condições normais, o sistema digestório possui potencialmente a maior e mais perigosa carga bacteriana encontrada no animal. No sistema de engorda, é produzido de 41kg a 45kg de esterco diariamente, estimando-se que 1g de fezes frescas de bovinos contenha mais de um milhão de bactérias (GRACEY; COLLINS, 1992).
Levando em consideração a taxa elevada de germes existentes no conteúdo intestinal, compreende-se que mínimas contaminações com fezes já constituam alterações potenciais nos produtos. As matérias fecais se concentram também em determinados pontos da superfície corporal dos animais de abate, constituindo causa principal da contaminação da carne. Tais regiões corporais são áreas da pele suja por fezes, como extremidades posteriores e especialmente cascos e unhas, e a taxa de germes contida nessa sujidade é de magnitude parecida a do conteúdo intestinal (SINELL, 1994).
As fontes de infecção de origem alimentar em bovinos de corte não são bem conhecidas. Vários estudos ao redor do mundo atribuíram à infecção, em bovinos, para o sistema de manejo, incluindo as práticas nutricionais (MOHAMMED et al., 2010). O alimento fornecido aos animais foi reconhecido como uma fonte de L. monocytogenes em infecções entre animais de fazenda, especialmente ruminantes. Embora a silagem tenha sido identificada como uma importante fonte deste microrganismo, parece provável que a infecção pode também ser adquirida durante o pastejo, especialmente quando é permitido que os animais se alimentem na vegetação natural (VARNAM, 1991).
2.4. Coleta de amostras
O Ministério da Agricultura, Pecuária e Abastecimento divulgou no Diário Oficial da União, no dia 9 de abril, a Instrução Normativa (IN) nº 9, de 8 de abril de 2009, pela qual o MAPA institui os Procedimentos de Controle da Listeria monocytogenes em produtos de origem animal prontos para o consumo, com o objetivo de monitorar e assegurar a inocuidade destes produtos em relação a este patógeno, os estabelecimentos que fabricam produtos de origem animal prontos para o consumo, devem estabelecer procedimentos de autocontrole, o que envolve Boas Práticas de Fabricação (BPF), Procedimentos Padrão de Higiene Operacional (PPHO) e o Programa de Análise de Perigos e Pontos Críticos de Controle (APPCC).
Os procedimentos de controles oficiais consistem na colheita oficial de amostras e na inspeção do processo de produção dos produtos de origem animal prontos para o consumo e dos registros gerados.
As amostras desses produtos devem ser coletadas nos estabelecimentos fabricantes, pelo Serviço de Inspeção de Federal (SIF), e encaminhadas aos laboratórios pertencentes à Rede Nacional de Laboratórios Agropecuários do SUASA, para a pesquisa de Listeria monocytogenes.
O SIF deverá coletar duas amostras, sendo uma para as análises microbiológicas e outra para as análises físico-químicas como pH, atividade de água, umidade, concentração de NaCl e agentes antimicrobianos (nitritos e nitratos), cada uma deverá ser acompanhada de uma Solicitação Oficial de Análise (SOA).
A amostras podem ser de três tipos: amostras de produtos em sua embalagem original, devendo apresentar peso mínimo de 450g de amostra para análise microbiológica e mínimo 500g para análise físico-química; amostras de produtos fracionados, sendo aqueles que devido ao seu tamanho ou peso não possam ser encaminhados na embalagem original devendo ser fracionados em condições higiênicas para evitar a contaminação da amostra e enviados com o rótulo e as demais informações necessárias ao laboratório ou amostras de produtos com peso inferior a 450g para produtos cuja apresentação seja inferior ao peso mínimo para envio aos laboratórios, deverão ser coletadas unidades necessárias para se obter o peso mínimo de 450g (microbiologia) e 500g (físico-químico), sendo as unidades do mesmo lote, partida, data de fabricação e linha de produção.
Para a realização da coleta, o SIF deverá seguir instruções específicas para cada tipo de amostra, destacando que em todas é extremamente importante a lavagem e sanitização das mãos antes de iniciar a coleta, o acondicionamento correto das amostras e a colocação de um lacre numerado para garantir a inviolabilidade e identificação das amostras, que deverá ser constatado na SOA.
O acondicionamento das amostras deve ser realizado em recipientes isotérmicos como caixas de isopor ou plástico, que garantam sua integridade e conservação na temperatura adequada durante o transporte até a chegada ao laboratório. Para produtos resfriados ou congelados, também deverão ser acondicionados em recipientes isotérmicos, porém acompanhados de gelo em gel, conforme a temperatura recomendada em seus rótulos. Para garantir a manutenção da temperatura de conservação é colocado essa caixa isotérmica dentro de uma caixa isotérmica maior, completando os espaços com gelo. As amostras que chegarem aos laboratórios em temperaturas inadequadas serão descartadas.
Deverão ser preenchidas, carimbadas e assinadas duas vias da SOA, sendo uma via colocada em um saco plástico junto da amostra dentro do recipiente de expedição e a outra via dentro de um envelope fixado na tampa do recipiente que deverá ser lacrado com fita adesiva e enfim enviadas aos laboratórios de destino.
O prazo entre a coleta e a recepção das amostras pelos laboratórios oficiais é de no máximo 30 horas, desde que mantidas as temperaturas de conservação (máximo de 8ºC para produtos resfriados e -18ºC para produtos congelados). Portanto, é importante observar o período de recebimento de amostras em cada LANAGRO, pois aquelas que não respeitarem o prazo estabelecido serão descartadas.
2.5. Métodos de detecção
Os métodos mais comuns utilizados para a detecção de L. monocytogenes são o método USDA–FSIS (United States Department of Agriculture – Food Safety and Inspection Service) para a detecção em carne, o protocolo FDA (Food and Drug Administration) para a detecção em lacticínios, fruta e frutos do mar, o método NGFIS (Netherlands Government Food Inspection Service) e o ISO (International Organization Standardization) 11290 para todo o tipo de amostras (CHURCHILL; LEE; HALL, 2006; ZUNABOVIC; DOMIG; KNEIFEL, 2010). Entretanto, são métodos que requerem vários dias para serem concluídos, pois exigem enriquecimento seletivo, plaqueamento em meios seletivos e caracterização bioquímica dos isolados e necessitam de um grande número de provas bioquímicas para a identificação e diferenciação das espécies (HOCHBERG et al., 2001).
O método USDA-FSIS utiliza o meio modificado de OXFORD (MOX - Modified OXFORD), o método FDA utiliza tanto o meio de OXFORD como o de PALCAM (Polymyxin-Acriflavine-Lithium-Chloride-Ceftazidime-Aesculin-Mannitol) ou LPM (Lithium-Chloride-Phenylethanol-Moxalactam) e o método NGFIS utiliza o meio PALCAM. Nos meios seletivos de OXFORD e PALCAM as colônias de Listeria são pequenas, pretas e rodeadas por um halo preto (proveniente da hidrólise da esculina) (Figura 2) e não se distinguem colônias de Listeria spp. patogênicas ou não (ZUNABOVIC; DOMIG; KNEIFEL, 2010).
O método ISO 11290 é o recomendado pelo Regulamento (CE) 2073/2005, sendo por isso um dos mais utilizados. Neste existem dois passos de enriquecimento e, posteriormente, são utilizados dois meios seletivos, o meio cromogênico ALOA (Agar Listeria according to Ottaviani and Agosti) e outro, segundo a escolha do laboratório, como o OXFORD ou PALCAM. No meio ALOA as colônias de L. monocytogenes tem 1 mm de diâmetro e são normalmente verde-azuladas rodeadas com um halo opaco (Figura 2).
Figura 2 - Meios seletivos utilizados para identificar Listeria monocytogenes.
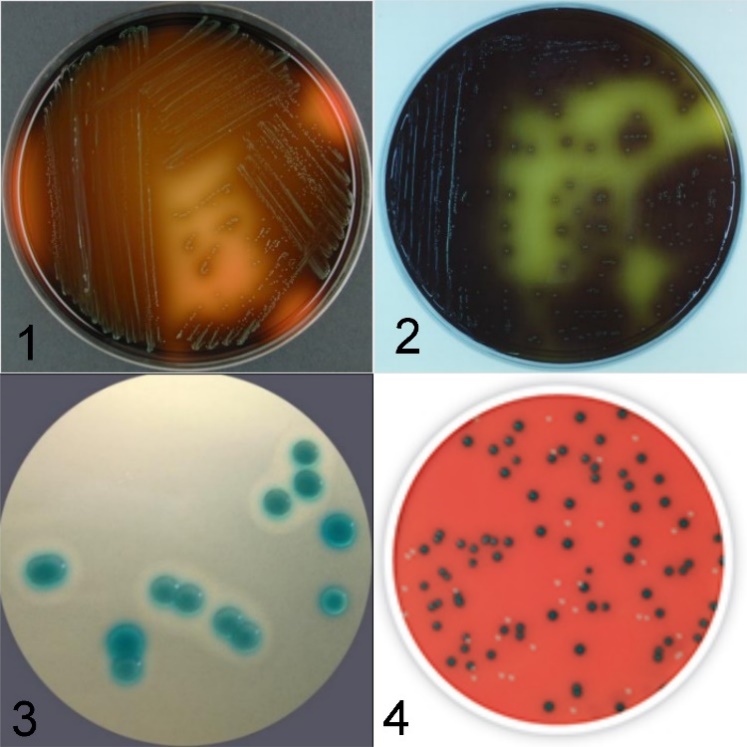
1 - PALCAM; 2 - OXFORD; 3 - ALOA; 4 - Rapid L’mono.
Fonte: Compilação da autora[1].
A enumeração de Listeria é tão importante quanto a detecção, que pode ser feita através dos protocolos mencionados anteriormente. A quantidade de Unidades Formadoras de Colônias (UFC) por grama de amostra de Listeria é determinada através da sementeira, após as diluições necessárias nos meios seletivos como o Oxford. Para a contagem de L. monocytogenes, especificamente, existem meios cromogênicos como ALOA e Rapid L’mono que a distinguem das outras espécies.
Após o isolamento nos meios seletivos, devem ser realizados testes de confirmação e, de acordo com o método ISO 11290, as colônias devem ser semeadas no meio Agar Triptona de Soja (TSA) com extrato de levedura e incubadas a 37°C durante 18-24 horas. Se as colônias suspeitas forem semelhantes às de Listeria (opacas, incolores e de bordos definidos) deve ser realizado o teste de coloração de Gram (Figura 3).
Figura 3 - Listeria monocytogenes coradas pelo Gram.
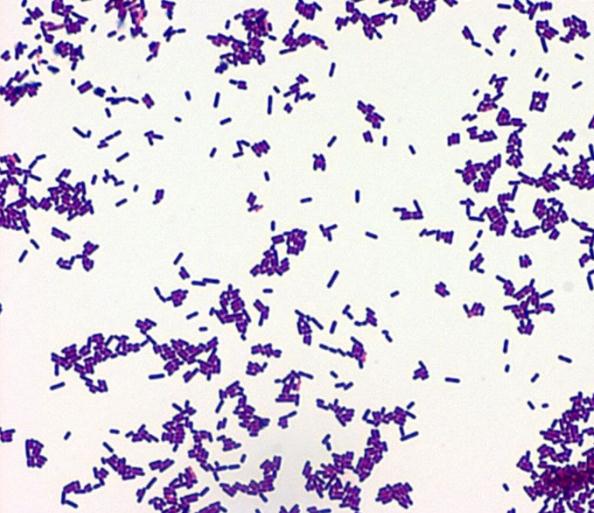
Fonte: (Microbe Canvas – Listeria monocytogenes)
Também é realizado o teste de motilidade que deve ser positivo na presença de colônias de Listeria apresentando a motilidade em forma de “guarda-chuva” (Figura 4) e, se o teste de catalase for igualmente positivo, deve-se então confirmar a espécie.
Figura 4 - Teste de motilidade positivo para Listeria sp.

Fonte: SOUZA, 2016.
A Listeria monocytogenes é produtora de β-hemolisina, utiliza a ramnose como fonte de açúcares e se mostra positiva no teste CAMP (Christie, Atkins e Munch-Peterson), em meio com sangue de ovelha, com Staphylococcus aureus, mas negatividade com Rhodococcus equi (LUDWIG; SCHLEIFER; WHITMAN, 2009) como é observado na Figura 5.
Figura 5 - Teste de CAMP.
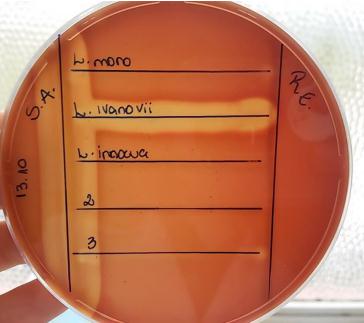
Fonte: SOUZA, 2016.
A pesquisa de L. monocytogenes em alimentos também pode ser realizada através de métodos alternativos como a Reação em Cadeia de Polimerase (PCR), ribotipagem, nested PCR, a técnica do DNA polimórfico amplificado aleatoriamente (RAPD), entre outros.
Segundo Mendonça et al. (2007), imunoensaios para detecção rápida de L. monocytogenes que utilizem anticorpos monoclonais (MAbs) tem como vantagem a alta especificidade, quando os MAbs são dirigidos contra fatores de virulência conservados nas cepas patogênicas.
Entretanto, deve-se destacar que a detecção de L. monocytogenes pelos métodos convencionais pode subestimar sua presença, caso se encontre injuriada, dificultando assim o seu isolamento, o que implicaria em resultados falso-negativos. Por isso, a PCR acaba se tornando uma importante técnica para detectar o microrganismo e estabelecer um limite critico de contaminação a ser verificado e controlado.
A pesquisa microbiológica tradicional de L. monocytogenes demanda tempo, podendo levar 15 dias ou mais para o isolamento e caracterização bioquímica da bactéria, enquanto que a PCR pode ser realizada num período de 24 horas.
Destacando-se que diante de um surto de infecção alimentar em que há características de listeriose, a pesquisa convencional torna-se menos oportuna que a PCR. E ainda, é possível monitorar, através da PCR, um lote de carcaças antes de sua distribuição ao comercio, enquanto as carcaças que se encontram em processo de refrigeração no matadouro-frigorífico.
2.6. Controle de qualidade
A preocupação com a higiene e segurança dos alimentos aumenta cada vez mais, com isso órgãos reguladores estão fiscalizando rigorosamente indústrias e locais onde há processamento de alimentos para consumo de terceiros. Porém, apesar de as indústrias e órgãos reguladores trabalharem pela produção e sistemas de processamento que garantam que os alimentos sejam seguros e saudáveis, a isenção completa do risco é um objetivo que está longe de ser alcançado. A segurança e a saúde estão relacionadas a níveis de risco que a sociedade considera razoáveis em comparação com outros riscos da vida cotidiana.
Os alimentos podem ser assegurados por fatores como controle do fornecedor, desenvolvimento e controle do processo, aplicação de Boas Práticas de Fabricação (BPF) e Boas Práticas de Higiene (BPH) durante a produção, processamento, manuseio, distribuição, estocagem, venda, preparação e uso, todos estes itens somados à aplicação do sistema de Análise e Perigos e Pontos Críticos de Controle (APPCC).
Esses fatores de segurança alimentar devem ser aplicados em toda a cadeia alimentícia, desde a produção do alimento na fazenda ou equivalente, até chegar ao consumidor. O Controle de Qualidade surgiu nos Estados Unidos na década de 30, juntamente com o início da Era Industrial, com o objetivo de aplicar diretrizes e limites que garantiam essa segurança, onde foram criadas as linhas de produção que necessitavam de produtos com as mesmas características, ou seja, um produto padrão (TERRA; BRUM, 1988).
Dentro do Controle da Qualidade existem as ferramentas de qualidade: Boas Práticas de Fabricação (BPF), Boas Práticas de Higiene (BPH), APPCC, Avaliação do Risco Microbiológico (ARM), Gerenciamento da Qualidade (Série ISO) e o Gerenciamento da Qualidade Total (TQM). Estas ferramentas contêm pontos e outras ferramentas que regem a produção, como exemplo podemos citar uma ferramenta chamada de PPHO (Procedimentos Padrão de Higiene e Operacional), que se encontra dentro das BPH´s.
2.6.1. Boas Práticas de Fabricação
As Boas Práticas de Fabricação (BPF) abrangem um conjunto de medidas, normas e atitudes empregadas em produtos, processos, serviços e edificações que devem ser adotadas pelas indústrias de alimentos e pelos serviços de alimentação, a fim de garantir a qualidade sanitária, conformidade e segurança dos produtos alimentícios com os regulamentos técnicos (BRASIL, 1997), assegurando que estes cheguem até o consumidor em condições higiênico-sanitárias adequadas e suficientes, atendendo à legislação em vigor. Além da redução de riscos, as BPF também possibilitam um ambiente de trabalho mais eficiente e satisfatório, otimizando todo o processo produtivo. São necessárias para controlar possíveis fontes de contaminação cruzada e para garantir que o produto atenda às especificações de identidade e de qualidade. O efeito geral da sua adoção, como a de qualquer outra ferramenta de qualidade, é a redução de custos de um processo em sua concepção mais ampla.
As boas práticas abordam os procedimentos realizados pela indústria, quanto à higienização das instalações, equipamentos e utensílios; controle de pragas e vetores; segurança e qualidade da água; saúde e hábitos higiênicos dos colaboradores; descrição das tecnologias empregadas na fabricação dos produtos; prevenção da contaminação cruzada; análises e padrões utilizados na seleção e no controle de qualidade de matérias-primas, ingredientes e produtos acabados; controle dos perigos físicos, químicos e biológicos; procedimentos de recall e de atendimento ao consumidor; registros e documentação e rastreabilidade, dentre outros (TEODORO; SILVA; PINTO, 2007).
A implementação de ações para asseguramento da qualidade exige largas doses de comprometimento de todo o pessoal envolvido no processo produtivo, incluindo setores de apoio técnico, em absolutamente todos os escalões dos organismos fomentadores da atividade agroindustrial, quer sejam públicos ou privados. Compete aos Serviços de Vigilância Sanitária Estaduais e Municipais o estabelecimento de normas complementares, de forma a abranger aspectos sanitários mais específicos à sua localidade, não podendo contrariar as normas federais.
A avaliação dessas BPF em estabelecimentos de produção ou de comercialização de alimentos, por meio de utilização de questionários apropriados, é citada como subsídio para qualificação e triagem de fornecedores, como base para vistoria fiscal sanitária, para a verificação, pelo próprio estabelecimento, do cumprimento das BPF ou como base para a implantação do sistema Análise de Perigos e Pontos Críticos de Controle (APPCC).
2.6.2. Procedimento Padrão de Higiene Operacional
O Departamento de Inspeção de Produtos de Origem Animal (DIPOA), através da DCI (Circular nº272/97 DIPOA), resolveu que até 31 de dezembro de 1998, as indústrias de produto de origem animal, habilitadas ao comércio internacional, devem desenvolver e implantar o programa de Procedimento Padrão de Higiene Operacional (PPHO) que descreve todos os procedimentos de limpeza e sanitização executados diariamente pelos estabelecimentos para prevenir a contaminação dos produtos. Estes procedimentos representam um programa escrito, a ser desenvolvido, implantado e monitorado pelos estabelecimentos e envolvem procedimentos pré-operacionais e operacionais específicos para cada linha de produção (TERRA; BRUM, 1988).
O pré-operacional abrange os procedimentos descritos de higienização executados antes do início das atividades dos estabelecimentos, fazendo referência aos procedimentos de limpeza e sanitização das instalações, equipamentos e instrumentos industriais; frequência com que estes procedimentos serão executados (no mínimo diariamente); as substâncias detergentes e sanificantes utilizadas, com as respectivas concentrações; as formas de monitoramento e as respectivas frequências; os modelos dos formulários de registros do monitoramento e as medidas corretivas a serem aplicadas no caso da constatação de desvios dos procedimentos.
O operacional inclui a limpeza e sanitização dos equipamentos e utensílios durante a produção e intervalos entre turnos, inclusive nas paradas para descanso do almoço e jantar. Este deve contemplar a descrição de todas as etapas dos processos de obtenção, transformação e estocagem dos produtos de origem animal executados pelas indústrias; a identificação de possíveis perigos biológicos, químicos ou físicos, decorrentes destas operações; os limites para cada perigo identificado; as medidas de controle que previam a materialização destes perigos; as medidas corretivas no caso de identificação de desvios; o estabelecimento da forma e a frequência do monitoramento; os formulários de registro das atividades de monitoramento e todas as medidas educativas e eventos adotados pelos estabelecimentos, visando àqueles pontos que não devem deixar de ser inseridos no programa.
O controle é exercido por planilhas que contém os parâmetros característicos de cada setor das indústrias. Depois de preenchidas, as planilhas são revisadas e assinadas pelo supervisor do controle de qualidade.
O manual de PPHO contém instruções técnicas com relação aos procedimentos de higienização de ambientes e utensílios nas indústrias e ainda, recomendações dos fabricantes dos produtos utilizados em tais procedimentos, bem como suas Autorizações de Uso de Produtos (AUPs), e respectivos rótulos. Só podem ser utilizados em estabelecimentos sob Inspeção Federal do Ministério da Agricultura, Pecuária e Abastecimento produtos que disponham de Autorização de Uso emitida pelo DIPOA, da Secretaria de Defesa Agropecuária (SDA), independentemente de que tenham sido previamente protocolados, registrados ou dispensados de registro no órgão competente, de acordo com a legislação em vigor (BRASIL, 2002).
2.6.3. APPCC
Para controlar perigos, entre os quais, os microbiológicos, principalmente os microrganismos patogênicos ao ser humano, o Programa de Análise de Perigos e Pontos Críticos de Controle (APPCC) foi eleito e incorporado como principal ferramenta de controle (HOGUE et al., 1998). Desde a sua concepção nos anos 30, o programa cresceu tornando-se um método universalmente reconhecido e aceito na garantia da segurança alimentar passando, a partir de 2000, a fazer parte das obrigações para o comércio mundial de alimentos seguros. A crescente e recente preocupação com a segurança alimentar das autoridades de saúde pública, indústrias de alimentos e consumidores em todo o mundo tem sido o grande impulso na aplicação do sistema APPCC. Esta preocupação foi confirmada por um aumento significativo na incidência de doenças transmitidas por alimentos em muitos países nos últimos anos (WHO, 2007).
O sistema APPCC é um sistema de análise que identifica perigos específicos e medidas preventivas para seu controle, objetivando a segurança do alimento e contempla para a aplicação, nas industrias sob SIF, também os aspectos de garantia da qualidade e integridade econômica. Baseia-se na prevenção, eliminação ou redução dos perigos em todas as etapas da cadeia produtiva.
O sistema pode ser aplicado em toda a cadeia alimentar, desde a produção primária até o consumo final e sua implementação deve ser guiada por evidências científicas quanto aos riscos à saúde humana. Além de promover a segurança alimentar, a implementação do sistema APPCC pode auxiliar na inspeção por parte das autoridades reguladoras, estimulando o comércio internacional (CAC/RCP, 2003).
Recentemente tem se considerado que as práticas de controle decorrentes do sistema APPCC têm sido compreendidas como o meio mais eficaz na prevenção da contaminação microbiana de carcaças durante o abate (BOLTON et al., 2002). Essas práticas intervêm nos estágios do processamento que representam risco plausível de contaminação da carcaça, reduzindo assim o risco de doenças de origem alimentar.
Entretanto, para sua monitoração rotineira a utilização de organismos patogênicos é onerosa, demorada e difícil, tornando-se mais conveniente e prática a pesquisa de organismos indicadores, seja de cuidados ou de contaminação microbiológica. A utilização de bons indicadores, universalmente aceitos para finalidades específicas, permite avaliar corretamente o programa APPCC como ferramenta na garantia da segurança sanitária do processo de abate. Todavia, não dispensam a necessidade ou exigência da monitoração, contínua ou periódica, dos principais patógenos envolvidos com problemas alimentares, possibilitando dados microbiológicos adequados para permitir conclusões confiáveis quanto à eficácia desses programas no controle e na redução desses patógenos de origem alimentar (ICMSF, 1997; ELDER et al., 2000).
No Brasil, o Programa de Procedimentos Padrão de Higiene Operacional (PPHO) e o APPCC foram implementados em estabelecimentos envolvidos com o comércio internacional de carnes e produtos cárneos, em razão da maioria dos casos de enfermidades transmitidas por alimentos estarem relacionados com práticas operacionais inadequadas do ponto de vista higiênico-sanitário. Neste contexto, representa um valioso mecanismo auxiliar do sistema clássico de inspeção industrial e sanitária de produtos de origem animal, particularmente no que se refere ao controle dos perigos relacionados com as chamadas bactérias emergentes (BRASIL, 1997).
2.6.4. Rastreabilidade
A rastreabilidade dos produtos permite assegurar um nível elevado da saúde humana e de proteção dos consumidores. É definida como capacidade de identificar a origem e acompanhar o trajeto de um gênero alimentício, ao longo de todas as fases de produção, desde a origem das matérias-primas, o histórico do processamento do produto, até a distribuição e localização do produto após a expedição.
Segundo o Regulamento (CE) n°178/2002, a rastreabilidade é obrigatória para todos os operadores das empresas do setor alimentar, desta forma, os matadouros-frigoríficos devem implementar um sistema de registros que permita saber a qualquer momento qual a proveniência dos animais pelo acompanhamento do rebanho desde o nascimento até o abate e o destino do respectivo lote de carcaças, detendo-se ao conhecimento de todos os eventos ocorridos durante a sua vida, os ingredientes e demais matérias-primas que compõem o produto final. Através da rastreabilidade é possível conhecer e voltar à origem de qualquer corte a venda em supermercados ou na cadeia alimentar.
A rastreabilidade atua como um complemento no gerenciamento da qualidade dos alimentos. Deve ser agregado a outros sistemas de controle de qualidade como o APPCC e as Boas Práticas de Fabricação, pois se aplicado isoladamente, não traduz segurança ao produto e nem ao processo.
Basicamente, suas finalidades são fornecer informações aos consumidores; assegurar que apenas produtos de qualidade e permitidos entrem no sistema; identificar clara e explicitamente produtos que são diferentes, mas que se parecem a ponto de serem confundidos entre si; controlar o deslocamento de animais e seus produtos com objetivo de sanidade; permitir o retorno de produto suspeito numa base precisa; localizar falhas e tomar medidas corretivas e acima de tudo, controlar a segurança e qualidade dos alimentos.
2.6.5. Rastreabilidade da Carne Bovina
No Brasil, a rastreabilidade surgiu através da Instrução Normativa n°1, estabelecida pelo MAPA em janeiro de 2002, que instituiu o Sistema Brasileiro de Identificação e Certificação de Origem Bovina e Bubalina (SISBOV) que determina a Secretaria de Defesa Agropecuária (SDA/MAPA) como responsável pela normalização, regulamentação, implementação e supervisão das etapas de identificação e registro individual do rebanho brasileiro e credenciamento de entidades certificadoras, cujos dados são inseridos no Cadastro Nacional do SISBOV.
O SISBOV trata-se de um conjunto de ações, medidas e procedimentos adotados para caracterizar a origem, o estado sanitário, a produção e a produtividade da pecuária nacional e a segurança dos alimentos provenientes dessa exploração econômica. Seu objetivo é identificar, registrar e monitorar, individualmente, todos os bovinos e bubalinos nascidos no Brasil ou importados.
É aplicado em todo o território nacional, às propriedades rurais de criação de bovinos e bubalinos, às industriais frigoríficas que processam esses animais, gerando outros produtos e subprodutos de origem animal e resíduos de valor econômico, e às entidades credenciadas pelo MAPA como certificadoras. De acordo com o MAPA, os animais devem ser inclusos no SISBOV com 90 dias de antecedência ao abate.
O controle da identificação e movimentação dos animais registrados deve ser realizado pelas entidades certificadoras credenciadas (organizações governamentais ou privadas), que também são responsáveis por emitir o documento de identificação dos animais registrados, denominado Documento de Identificação Animal (DIA), devendo constar informações como número do animal do SISBOV e na certificadora, identificação da propriedade de origem, mês do nascimento ou data de ingresso na propriedade, raça, sexo, aptidão, sistema de criação e alimentação, dados sanitários (vacinação, tratamento, programa sanitário) e registro de movimentações (BRASIL, 2002; CÓCARO; JESUS, 2007).
No caso de animais importados deverão ser identificados o país de origem e a propriedade de origem, datas da autorização de importação e de entrada no país, número de guia e licença de Importação e propriedade destino.
Se ocorrer morte natural, acidental ou sacrifício do animal, o respectivo documento de identificação deverá ser devolvido à entidade certificadora. Na ocasião do abate, compete aos frigoríficos devolver os documentos ao Serviço de Inspeção Federal do MAPA.
A rastreabilidade de carnes requer um método para identificação de animais individuais ou grupos de animais. Existem dois caminhos para aplicar os conceitos de rastreabilidade em rebanhos: manual e eletrônico. A rastreabilidade manual está relacionada ao registro manual dos dados e eventos ocorridos ao longo da vida do animal e pode estar vinculada à data do abate e eventualmente alcançar a distribuição da cadeia alimentar. Este tipo de registro de dados pode gerar erros ou mesmo fraudes. A rastreabilidade eletrônica utiliza dispositivos eletrônicos, tais como transponders externos como brincos ou colares e internos como microchips.
Figura 6 - Brinco de identificação no padrão do SISBOV.


Fonte: Polite Polímeros e Tecnologia, [s/d].
2.7. Legislação
Cada vez mais o mercado internacional tem se tornado exigente no que se refere aos padrões microbiológicos dos alimentos. Os acordos estabelecidos no comércio internacional induzem o estabelecimento de rígidas normas e padrões para a produção e comércio de alimentos inócuos e de qualidade. E o Brasil deve se adaptar a essas normas, em consequência da importância da carne e seus derivados para a economia brasileira e devido a Listeria monocytogenes ser facilmente encontrada em produtos de origem animal.
O Departamento de Agricultura dos Estados Unidos (USDA) adotou a política de tolerância zero para L. monocytogenes em alimentos prontos para o consumo, incluindo os produtos lácteos, com base na possibilidade de que a dose mínima infectante de L. monocytogenes possa ser baixa. Esta atitude foi motivada pelo grande número de recolhidos de produtos desde 1998, ano em que houve aumento no aparecimento de surtos. Desde aquela data até dezembro de 2006 foram realizados cerca de duzentos recolhimentos, totalizando aproximadamente 65 mil toneladas de alimentos retirados do comércio.
No Canadá, os alimentos são classificados em categorias, de acordo com as condições que oferecem para a multiplicação da bactéria, tempo de vida de prateleira e temperatura de armazenamento. De acordo com a categoria, os critérios microbiológicos para L. monocytogenes variam de ausência em 50g de alimento, e até menos de 100 UFC/g de alimento, sendo que para cada tipo de situação, são recomendadas diferentes ações.
A conduta com relação aos limites toleráveis de L. monocytogenes em alimentos difere entre países. Nos Estados Unidos, Rússia e Dinamarca estabeleceram-se a chamada “Tolerância Zero”, onde não é permitida a presença do patógeno em 25g de alimento. Entretanto na maioria dos países europeus, o limite permitido é de até 100 UFC/g no alimento no momento do consumo (LIANOU; SOFOS, 2007).
Referente a legislação brasileira, a Resolução n° 12, de 02 de janeiro de 2001, do Ministério da Saúde, determina a ausência de L. monocytogenes em 25g somente em alguns tipos de queijo. Para outros alimentos, como produtos cárneos, não existem limites regulatórios (ANVISA, 2001).
Em função dos riscos inerentes a presença de L. monocytogenes em alimentos de origem animal prontos para o consumo, o MAPA instituiu a instrução normativa n° 09, em 08 de abril de 2009, que estabelece procedimentos de controle para L. monocytogenes em produtos de origem animal prontos para o consumo (BRASIL, 2009). Mas apesar da instrução determinar a ausência de L. monocytogenes apenas aos produtos de origem animal prontos para consumo, é importante que os ambientes de processamento, utensílios e equipamentos que entram em contato com o alimento estejam livres deste patógeno, para que não ocorra contaminação do produto final.
De acordo com a instrução normativa n° 09, em 08 de abril de 2009, os resultados positivos para Listeria monocytogenes levarão aos procedimentos de inspeção do processo de produção e a revisão dos registros dos produtos de origem animal prontos para o consumo (BRASIL, 2009).
Na inspeção do processo de produção, é realizada a avaliação das instalações e equipamentos utilizados para evitar contaminação cruzada, assim como a limpeza dos mesmos, avaliação dos hábitos higiênico-sanitários e de higiene pessoal dos funcionários, avaliação das condições da matéria-prima e dos procedimentos tecnológicos de elaboração dos produtos, avaliação dos métodos utilizados pelo estabelecimento para reduzir a contaminação biológica dos produtos embalados e avaliação dos métodos utilizados pelo estabelecimento, para suprimir a multiplicação do microrganismo.
Na revisão dos registros do processo de produção é feita a avaliação da conformidade dos resultados dos procedimentos de autocontrole, com ênfase no monitoramento dos controles aplicados, incluindo medidas preventivas, medidas corretivas e testes microbiológicos e a avaliação da autenticidade dos registros.
Os produtos positivos para Listeria monocytogenes podem ser reprocessados, desde que o procedimento aplicado assegure a destruição do microrganismo. Após a etapa de reprocessamento, os estabelecimentos devem realizar análise microbiológica do produto, assegurando que o mesmo tenha ausência da bactéria. Não havendo possibilidade de reprocesso ou caso o reprocessamento realizado pelo estabelecimento não tenha garantido a eliminação do microrganismo, os produtos devem ser inutilizados (BRASIL, 2009).
Quando houver detecção de Listeria monocytogenes nos produtos de origem animal, os estabelecimentos fiscalizados devem rever os seus procedimentos de autocontrole, que baseia-se no controle da matéria-prima, ingredientes e embalagem primária; no processo de produção visando à redução dos níveis de contaminação dos produtos; no programa de higienização e sanitização com objetivo de reduzir a contaminação biológica dos produtos durante o processo de produção; no controle do ambiente e equipamentos para prevenir a recontaminação dos produtos, após a sua fabricação; nos métodos adequados para reduzir a contaminação biológica dos produtos embalados e para suprimir a sua multiplicação nos mesmos.
Os estabelecimentos fiscalizados devem determinar registros que demonstrem a eficiência dos programas de autocontrole e instituir o monitoramento do ambiente de processamento de produtos de origem animal para Listeria monocytogenes ou Listeria spp.
Se durante a inspeção oficial for constatado que o estabelecimento, onde foi detectada a presença de Listeria monocytogenes em seus produtos, não implantou as ações previstas, devem ser tomadas medidas como apreensão do produto e realização de testes microbiológicos para pesquisa da bactéria, antes da liberação do produto para o consumo (BRASIL, 2009).
3. CONSIDERAÇÕES FINAIS
A Listeria monocytogenes é um patógeno largamente encontrado no ambiente e no intestino de homens e animais, facilitando a contaminação de água e alimentos. É capaz de ocasionar uma enfermidade transmitida por alimentos conhecida como listeriose, que possui um curso diferente das outras doenças de origem alimentar, pois, ao causar septicemia, o microrganismo pode atingir diversos órgãos como o sistema nervoso central e a placenta ocasionando meningites e abortos. Sendo assim, a presença de L. monocytogenes em alimentos, representa grande importância para a saúde pública, devendo-se intensificar a fiscalização de produtos de origem animal, necessitando uma melhor adequação das boas práticas de fabricação e da análise dos perigos e pontos críticos de controle, visando a produção de alimentos seguros. É importante a preparação de todo o pessoal envolvido no preparo de alimentos, inclusive os consumidores, o que pode ser a forma mais efetiva de prevenir doenças alimentares.
No Brasil, assim como em outros países em desenvolvimento, há carência de informações sobre esse importante patógeno. Assim, deve ser estudada a necessidade de intensificar e aprofundar a pesquisa de L. monocytogenes em amostras clínicas, para que se possa dimensionar a real incidência deste microrganismo em nosso meio.
Portanto, através da utilização de novas técnicas de diagnóstico e identificação de L. monocytogenes, novas pesquisas devem ser realizadas para que seja descoberta a verdadeira frequência de casos e surtos de listeriose no Brasil. Assim como, para que se estabeleça uma relação entre a presença de L. monocytogenes nos alimentos e a ocorrência de listeriose no homem que possam vir a ocorrer, devido a ampla variedade de problemas clínicos ocasionados por esse patógeno, os quais têm sido relatados na literatura.
4. REFERÊNCIAS BIBLIOGRÁFICAS
ACHA, P. N.; SZYFRES, B. Zoonosis y enfermedades transmisibles comunes al hombre ya los animales: Volumen I Bacteriosis y micosis. 3. ed. Washington, Organización Panamericana de la Salud, 2003.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Resolução RDC nº 12, de 2 de janeiro de 2001. Legislação, regulamento técnico sobre os padrões microbiológicos para alimentos, 2001.
AKUTSU, R. C. C. et al. Adequação das boas práticas de fabricação em serviços de alimentação. Revista de Nutrição, Campinas, v. 18, n. 3, p. 419-427, 2005.
ANDARAE TARTUFI. Listeria monocytogenes in Aloa. 2018. 1 fotografia, color. Disponível em: <https://www.andareatartufi.com/wordpress/le-contaminazioni-microbiche-dei-tartufi/listeria-monocytogenes-in-aloa-4/>. Acesso em: 13 jul. 2019.
BARROS, M. A. F. et al. Listeria spp.: ocorrência em equipamentos e ambientes de processamento de carne bovina. Semina: Ciências Agrárias, Londrina, v. 25, n. 4, p. 341-348, 2004.
BENETTI, T. M. Métodos de detecção e incidência de Listeria Sp e Salmonella Sp em linguiças resfriadas comercializadas no Estado do Paraná. 2009. Dissertação (Pós-graduação em Microbiologia, Parasitologia e Patologia do Departamento de Patologia Básica - Setor de Ciências Biológicas) – Universidade Federal do Paraná, Paraná, 2009.
BIO-RAD. RAPID’L.mono Medium. 1 fotografia, color. Disponível em: <http://www.bio-rad.com/pt-br/product/rapidl-mono-medium?ID=35bad7d6-36ac-4044-b859 d5febbda101a>. Acesso em: 13 jul. 2019.
BRASIL. Portaria n. 368, de 04 de setembro de 1997. Aprova o regulamento técnico sobre as condições higiênico-sanitárias e de boas práticas de fabricação para estabelecimentos elaboradores/industrializadores de alimentos. Diário Oficial da República Federativa do Brasil, Brasília, 1997.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n° 1, de 10 de janeiro de 2002. Institui o Sistema Brasileiro de Identificação e Certificação de Origem Bovina e Bubalina – SISBOV. Diário Oficial da União, Brasília, 2002.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n° 9, de 8 de abril de 2009. Procedimentos de controle da Listeria monocytogenes em produtos de origem animal prontos para o consumo. Diário Oficial da República Federativa do Brasil, Brasília, 2009
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Anuário dos Programas de Controle de Alimentos de Origem Animal do DIPOA. v. 4, 2018.
BRIDI, A. M.; Padronização, Rastreabilidade e Certificação de Animais e seus Produtos. Londrina, 2006.
CARDOSO, J. C. Ocorrência de Listeria monocytogenes em instalações, utensílios e carcaças em matadouro-frigorífico de bovinos localizado no Rio Grande do Sul. 2012. Monografia (Graduação em Medicina Veterinária) – Universidade Federal do Rio Grande do Sul, Porto Alegre, 2012.
CATÃO, R. M. R.; CEBALLOS, B. S. O. Listeria spp., coliformes totais e fecais e E. coli no leite cru e pasteurizado de uma indústria de laticínios, no Estado da Paraíba (Brasil). Ciência e Tecnologia de alimentos, Campinas, v. 21, n. 3, p. 281-287, 2001.
CHURCHILL, R. L. T.; LEE, H.; HALL, J. C. Detection of Listeria monocytogenes and the toxin listeriolysin O in food. Journal of microbiological methods, v. 64, n. 2, p. 141-170, 2006.
CÓCARO, H.; JESUS, J. C. S. Impactos da implantação da rastreabilidade bovina em empresas rurais informatizadas: estudos de caso. Revista de Gestão da Tecnologia e Sistemas de Informação, v. 4, n. 3, p. 353-374, 2007.
CORADINI, M. G. L. Ocorrência de Listeria monocytogenes em linha de processamento de Beef Jerky. 2015. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) - Universidade Federal de Pelotas, Pelotas, 2015.
CUNHA, H. V. F. O papel dos serviços veterinários na segurança dos alimentos segundo a OIE. Food Safety Brazil. Disponível em: <https://foodsafetybrazil.org/o-papel-dos-servicos-veterinarios-na-seguranca-dos-alimentos-segundo-oie/>. Acesso em 18 mar. 2019
DE LARA, J. A. F. et al. Rastreabilidade da carne bovina: uma exigência para a segurança alimentar. Semina: Ciências Agrárias, Londrina, v. 24, n. 1, p. 143-148, 2003.
DE NOVAES, S. F. et al. Listeria spp. em carpaccio de carne bovina e perfil de resistência aos agentes antimicrobianos. Arquivos do Instituto Biológico, São Paulo, v. 81, n. 4, p. 309-314, 2014.
DOS SANTOS, J. A. et al. Listeriose encefálica em bezerros. Pesquisa Agropecuária Brasileira, Brasília, v. 19, n. 1, p. 95-100, 1984.
ELIAS, A. H.; MADRONA, G. S. Avaliação de uma indústria produtora de embutidos cárneos quanto à higiene e legislação vigente no Brasil. Revista Brasileira de Tecnologia Agroindustrial, Ponta Grossa - Paraná, v. 2, n. 2, p. 71-81, 2008.
FARBER, J. M.; PETERKIN, P. I. Listeria monocytogenes, a food-borne pathogen. Microbiology and Molecular Biology Reviews, v. 55, n. 3, p. 476-511, 1991.
FRANCO, B. D. G. M.; LANDGRAF, M. Microrganismos patogênicos de importância em alimentos. In:______. Microbiologia dos alimentos. São Paulo: Atheneu, 2008. cap. 4, p. 33-82.
FREITAS, G. S. R. Avaliação do sistema de análise de perigos e pontos críticos de controle em um matadouro-frigorifico de aves. 2012. Dissertação (Graduação Medicina Veterinária) – Universidade Federal do Rio Grande do Sul, Porto Alegre, 2011.
GERMANO, P. M. L.; GERMANO, M. I. S. Agentes bacterianos de toxinfecções. Higiene e Vigilância Sanitária de Alimentos. São Paulo: Livraria Varela, p. 199-258, 2001.
GRACEY, J. F.; COLLINS, D. S. Meat hygiene. 9. ed. Londres, Baillière Tindall, 1992.
HOCHBERG, A. M. et al. Sensitivity and Specificity of the BAX® for Screening/Listeria monocytogenes Assay: Internal Validation and Independent Laboratory Study. Journal of AOAC International, Gaithersburg, v. 84, n. 4, p. 1087-1097, 2001.
KUNKEL, D. Listeria monocytogenes, bacterium, SEM. 2004. 1 fotografia, color. Disponível em: . Acesso em: 05 mar. 2019.
LIANOU, A.; SOFOS, J. N. A review of the incidence and transmission of Listeria monocytogenes in ready-to-eat products in retail and food service environments. Journal of Food Protection, v. 70, n. 9, p. 2172-2198, 2007.
LIMA, V. M. B. et al. SISBOV: entendendo o passado, planejando o futuro. In: XIV Congresso da SOBER. Londrina, 2007.
LIU, D. Handbook of Listeria monocytogenes. 1. ed. Boca Raton: CRC press, 2008.
LUDWIG, W.; SCHLEIFER, K.; WHITMAN, W. B. Family III. Listeriaceae. In: VOS, P. et al. Bergey's Manual of Systematic Bacteriology: Volume 3: The Firmicutes. 2. ed. Georgia: Springer, 2009.
MATIAS, R. S. O controle de pragas urbanas na qualidade do alimento sob a visão da legislação federal. Ciência e Tecnologia de Alimentos, Campinas, v. 27, n. 1, p. 93-98, 2007.
MAYRHOFER, S. et al. Antimicrobial resistance profile of five major food-borne pathogens isolated from beef, pork and poultry. International Journal of Food Microbiology, Amsterdam, v. 97, n. 1, p. 23-29, 2004.
MCLAUCHLIN, J. The relationship between Listeria and listeriosis. Food control, v. 7, n. 4-5, p. 187-193, 1996.
MCLAUCHLIN, J.; LOW, J. C. Primary cutaneous listeriosis in adults: an occupational disease of veterinarians and farmers. The Veterinary Record, v. 135, n. 26, p. 615-617, 1994.
MICROBE CANVAS. Microbiology on the go. Dept. Medical Microbiology and Infectious diseases. Disponível em: . Acesso em: 08 ago. 2019.
MOHAMMED, H. O. et al. The risk of Listeria monocytogenes infection in beef cattle operations. Journal of Applied Microbiology, Oxford, v. 108, n. 1, p. 349-356, 2010.
NASCIMENTO F. N. Recomendações básicas para a aplicação das boas práticas agropecuárias e de fabricação na agricultura familiar. 1. ed. Brasília, DF: Embrapa Informação Tecnológica, 2006.
ONLINE PHOTO ATLAS. Microbiology. Listeria monocytogenes on Palcam agar. 2011. 1 fotografia, color. Disponível em: . Acesso em: 13 jul. 2019.
ONLINE PHOTO ATLAS. Microbiology. Listeria monocytogenes on Oxford agar. 2011. 1 fotografia, color. Disponível em: . Acesso em: 13 jul. 2019.
OWEN, C. R. et al. A case of primary cutaneous listeriosis. New England Journal of Medicine, v. 262, n. 20, p. 1026-1028, 1960.
PAINTER, J.; SLUTSKER, L. Listeriosis in humans. FOOD SCIENCE AND TECHNOLOGY-NEW YORK-MARCEL DEKKER-, v. 161, p. 85, 2007.
PARDI, M. C. et al. Aspectos higiênico-sanitários da carne. In:______. Ciência, higiene e tecnologia da carne – Volume 1 (Ciência e higiene da carne: tecnologia da sua obtenção e transformação). 2. ed. Goiânia, UFG, 2006. p. 271-490.
PINTO, M. S. et al. Segurança alimentar do queijo minas artesanal do Serro, Minas Gerais, em função da adoção de boas práticas de fabricação. Pesquisa Agropecuária Tropical, Goiânia, v. 39, n. 4, p. 342-347, 2009.
PITA, J. S. M. et al. Surto de listeriose entre 2009 e 2011 em Lisboa e Vale do Tejo: investigação e medidas implementadas pela ASAE. 2012. Dissertação (Mestrado em Medicina Veterinária) - Universidade Técnica de Lisboa, Lisboa, 2012.
RAMASWAMY, V. et al. Listeria-review of epidemiology and pathogenesis. Journal of Microbiology Immunology and Infection, v. 40, n. 1, p. 4-13, 2007.
Regulamento (CE) n°178/2002 de 28 de Janeiro de 2002. Jornal Oficial da União Europeia. Parlamento Europeu e Conselho da União Europeia.
RISSI, D. R. et al. Forma nervosa de listeriose em caprinos. Pesquisa Veterinária Brasileira, v. 26, n. 1, p. 14-20, 2006.
ROCOURT, J. The genus Listeria and Listeria monocytogenes: phylogenetic position, taxonomy, and identification. In: RYSER, E. T.; MARTH, E. H. Listeria, Listeriosis, and Food Safety. 2. ed. New York: Marcel Dekker, 1999. p.1-20.
ROCOURT, J.; BUCHRIESER, C. The genus Listeria and Listeria monocytogenes: phylogenetic position, taxonomy, and identification. In: RYSER, E. T.; MARTH E. H. Listeria, Listeriose, and Food Safety. 3. ed. Boca Raton: CRC Press, 2007. p. 1-20.
ROCOURT, J.; JACQUET, Ch; REILLY, A. Epidemiology of human listeriosis and seafoods. International Journal of Food Microbiology, v. 62, n. 3, p. 197-209, 2000.
SCHLECH, W. F. Foodborne Listeriosis. Clinical Infectious Diseases, v. 31, n. 3, p.770-775, 2000.
SILVA Jr. E. A. Manual de controle higiênico sanitário em serviços de alimentação. 7. ed. São Paulo: Varela, 2014.
SILVA, H. R. et al. Listeriose: uma doença de origem alimentar pouco conhecida no Brasil. Higiene alimentar, v. 30, n. 262/263, p. 17-20, 2016.
SINELL, H. J. Microbiología de la carne. In:______. Tecnología e higiene de la carne. Zaragoza: Acribia, 1994. p. 170-197.
SOUZA, L. N. Detecção de Listeria monocytogenes em queijos coloniais comercializados no município de Porto Alegre. 2016. Monografia (Graduação em Ciências Biológicas) – Universidade Federal do Rio Grande do Sul, Porto Alegre, 2016.
SWAMINATHAN, B.; GERNER-SMIDT, P. The epidemiology of human listeriosis. Microbes and infection, v. 9, n. 10, p. 1236-1243, 2007.
TEODORO, V. A. M.; SILVA, J. F.; PINTO, M. S. A. Evolução da legislação no setor de lácteos no Brasil. Informe Agropecuário, Belo Horizonte, v. 28, n. 238, p. 14-21, 2007.
TERRA, N. N.; BRUM, M. A. R. Carne e seus derivados: Técnicas de Controle de Qualidade. 1. ed. São Paulo: Nobel, 1988.
TOMICH, R. G. P. et al. Metodologia para avaliação das boas práticas de fabricação em indústrias de pão de queijo. Ciência e Tecnologia de Alimentos, Campinas, v. 25, n.1, p. 115-120, 2005.
VARNAM, A. H.; EVANS, M. G. Foodborne pathogens: An Illustrated Text. 1. ed. St. Louis: Mosby Year Book, 1991.
VÁZQUEZ-BOLAND, J. A. et al. Pathogenicity islands and virulence evolution in Listeria. Microbes and infection, v. 3, n. 7, p. 571-584, 2001.
WAN NORHANA, M. N., et al. Prevalence, persistence and control of Salmonella and Listeria in shrimp and shrimp products: A review. Food control, v. 21, n. 4, p. 343-361, 2010.
WHO WORKING GROUP et al. Foodborne listeriosis. Bulletin of the World Health Organization, v. 66, n. 4, p. 421, 1988.
ZUNABOVIC, M.; DOMIG, K. J.; KNEIFEL, W. Practical relevance of methodologies for detecting and tracing of Listeria monocytogenes in ready-to-eat foods and manufacture environments – A review. LWT - Food Science and Technology, v. 44, n. 2, p. 351-362, 2011.
5. ANEXO A – SOLICITAÇÃO OFICIAL DE ANÁLISE (SOA)


6. ANEXO B - PLANILHA DE INFORMAÇÕES COMPLEMENTARES PARA O PROGRAMA DE CONTROLE DE Listeria monocytogenes EM PRODUTOS PRONTOS PARA O CONSUMO – LANAGRO.
[1] Montagem a partir de imagens retiradas nos sites University of Copenhagem – Department of Veterinary Disease Biology; Andare a tartufi; Bio-Rad.
Publicado por: Thalissa Oliveira Nascimento
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.