DOENÇAS RARAS: POLITICAS PÚBLICAS NACIONAIS E INTERNACIONAIS.
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. O QUE SÃO DOENÇAS RARAS?
- 3.1 O conceito
- 3.2 Conceito de raridade
- 3.3 Contradição de raridade
- 3.4 Disparidade e heterogeneidade das doenças raras
- 3.5 Características Comuns das Doenças Raras
- 4. REGULAMENTAÇÃO
- 4.1 Cenário Internacional – Regulamentação nos Estados Unidos e na Europa
- 4.2 Cenário Internacional – Regulação e Incentivos Econômicos
- 5. VIABILIDADE PARA AS “BIG PHARMAS”
- 5.1 Case para investimento
- 5.2 Total de designações e aprovações órfãos
- 5.3 O novo modelo das Big Pharma em medicamentos órfãos e doenças raras nos Estados Unidos.
- 6. METODOLOGIA
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
Este artigo científico pesquisa o que são doenças raras e quais as políticas públicas existentes no cenário nacional e internacional. Focalizando as ações instituídas pelo Estados Unidos que representa à América do Norte, Brasil que representa a América do Sul e pôr fim à União Europeia que representa um bloco de 27 países. No decorrer da pesquisa, vimos que os Estados Unidos, foi pioneiro em políticas públicas voltadas à Doenças Raras, isto impulsionou outros países a criarem regulamentações voltadas para este setor. A abordagem de pesquisa desse artigo científico é considerada qualitativa uma vez que busca entender o conceito de Doenças Raras. O tipo de pesquisa é a descritiva e a mesma se guia a partir de duas frentes: a pesquisa bibliográfica e o estudo de caso. Para podermos entender o que são as políticas públicas adotadas no cenário nacional e internacional, essa pesquisa apresentará uma análise dos regulamentos para Estados Unidos, Brasil e União Europeia. Além de citações de autores e estudiosos voltados à Doenças Raras. Pode-se concluir desse trabalho que os países optaram por criar políticas públicas para as Doenças Raras, principalmente com intuito de atender às necessidades de tratamento, qualidade de vida e atendimento às famílias destes pacientes, assim como, incentivar as pesquisas para desenvolvimento de novos medicamentos para este setor e controlar a comercialização dos mesmos. Conclui-se também que estas políticas necessitam de atenções continuas, assim como atualizações para que nenhum paciente seja prejudicado ou desatendido.
Palavras-chave: Doenças raras. Regulamentação. Políticas Públicas.
ABSTRACT
This scientific article researches rare diseases and existing public policies at the national and international scenarios. Focusing on the actions imposed by the United States that represents the North America, Brazil that represents the South America and put an end to the European Union, which represents a block of 27 countries. In the course of the research, we saw that the United States has pioneered in public policies for rare diseases that boasted countries to create regulations facing this sector. The research approach of this scientific article is considered qualitative since it seeks to understand the concept of rare diseases. The research type is the descriptive and the same is guide from two fronts: the bibliographic research and the case study. In order to understand what are the public policies adopted in the national and international scenarios this survey shall explore an analysis of the regulations for the United States, Brazil and the European Union. In addition to the citations of authors and scholars focused on rare diseases. It can be concluded from this work that countries chose to create public policies for rare diseases, mainly with the aim of meeting the needs of treatment, quality of life and care to families of these patients, as well as encourage research for development of new medicinal products for this sector and control the marketing of same. It can also be concluded that these policies require continuous attention, as well as updates to that no patient is harmed or rejected.
Keywords: Rare diseases. Regulation. Public Policy.
2. INTRODUÇÃO
O objetivo deste trabalho é realizar uma pesquisa e uma análise simples no que se diz respeito à Doenças Raras e Drogas Órfãs, buscando analisar questões econômicas e práticas. Com esta análise, temos o intuito de entender os principais problemas que afetam este setor. Além disto, é necessário saber como o tema Doenças Raras vem sendo absorvido junto aos Estados e se estão sendo realizadas políticas para melhorar a vida destes pacientes com incentivo e desenvolvimento de medicamentos.
Doenças Raras é um problema de saúde que atinge aproximadamente de 6% a 8% da população mundial. O grande número de diferentes doenças caracterizadas como raras faz com que haja um elevado montante de pessoas portadoras de alguma dessas patologias. Devido à raridade, e o reduzido mercado consumidor, se torna difícil, caro e arriscado o desenvolvimento de pesquisas que viabilizem a produção de medicamentos para o seu tratamento. Fazendo com que esta questão passe a ser não apenas um problema de saúde pública, mas também um problema econômico e social. (HEEMSTRA, 2008b, p. 545).
Este tema é de extrema relevância tanto em âmbito nacional como internacional, uma vez que cada país possui seu tipo de política para este setor que merece uma atenção diferenciada, pois são doenças extremamente especificas e de difícil diagnostico. O intuito maior de todos os países deve ser a criação de meios que permitam o desenvolvimento de medicamentos órfãos, com o simples e puro objetivo de atender a cura e prolongar os dias destes pacientes. Proporcionando, a redução de dores e sintomas de acordo com cada de doença, atrelado à métodos mais saudáveis e avançados.
Podemos justificar a escolha deste tema como, algo de extrema relevância para sociedade e para os Estados. O principal objetivo é pesquisar e contextualizar este assunto de forma simples e clara, para que qualquer indivíduo possa saber o que são Doenças Raras.
Segundo a Organização Mundial da Saúde (OMS), saúde é definida como “um estado de completo bem-estar físico, mental e social e não constituído somente da ausência de uma doença ou enfermidade” (WHO, 2003).
Em alguns Estados democráticos, o direito à saúde é constitucional, ou seja, o direito a saúde é considerado uma responsabilidade do governo e é um dos princípios fundamentais dos Estados modernos, para exemplificar, podemos citar como exemplo o Brasil.
Dando continuidade, vemos que no Brasil o artigo 196 da Constituição Federal afirma que “a saúde é direito de todos e dever do Estado, garantido mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal igualitário às ações e serviços para sua promoção, proteção e recuperação” (BRASIL, 2010b).
Considerando todas as informações acerca do que são Doenças Raras, e suas principais dificuldades. Este trabalho pretende responder ao seguinte problema de pesquisa: Analisando o cenário internacional e nacional, quais as principais dificuldades para implementação de políticas públicas mais eficazes voltados ao público de Doenças Raras?
3. O QUE SÃO DOENÇAS RARAS?
Neste primeiro capitulo, vamos entender o conceito de Doenças Raras e quais os significados. Além de sabermos questões relacionadas à raridade, disparidade e heterogeneidade.
3.1. O conceito
Não existe uma definição única para termo Doenças Raras. Contudo, é considerado rara toda condição anormal, que tenha dano ou alterações no estado de saúde do indivíduo. Desta forma, entendemos que são situações que não acontecem com extrema frequência.
Segundo, os relatórios da EURORDIS1 a definição que eles utilizam para doenças raras é a disfunção da saúde, ou seja, uma condição de funcionamento anormal dentro do organismo humano.
É um estado patológico de uma parte de um órgão ou de um sistema do organismo que são resultantes de várias causas, tais como infecções, disfunção genéticas, ou não genéticas, ou até mesmo doenças que não possuem nenhuma informação para caracteriza-la como “rara” ainda.
Segundo outros autores como, Castelló et al. (2000, p.141) nos é apresentado uma definição bastante evidente. “(...) a rare disease is a rare medical condition that affects fewer than one in a thousand people; diagnosis is difficult and no methods of prevention or treatment exist.”2
Doenças Raras, podem ser reconhecidas também como Doença Órfã, este termo identifica uma doença que ocorre com baixa frequência em uma determinada população.
Considerando a definição de outro autor, segundo Lavandeira (2002, p. 195) ele define que uma doença rara pode sim constituir um problema de saúde, e sendo assim sua origem pode ser a mais diferente possível, é importante ressaltar que isto é independente dos sintomas causados, pois podem ser confundidos com outras doenças.
3.2. Conceito de raridade
Em todo o mundo é entendido como Doenças Raras aquelas que afetam um reduzido número de indivíduos quando se é comparado com a população em geral. No decorrer destas analises, que são através de dados quantitativos, são consideradas questões especificas relacionadas à raridade dentro do organismo e de acordo com cada Doença.
Cada país possui uma forma de analisar estatisticamente seus dados, e assim mensurar a quantidade proporcional que a sua população é atingida. Para melhor exemplificar sobre esta questão levantada, podemos citar dados de países e continentes.
Os Estados Unidos da América entendem que 1 em cada 1.500 pessoas possui uma doença considerada rara, já o Japão considera que 1 em cada 2.500 pessoas é afetada.
Já o continente Europeu tem sua análise dividida entre os Estados Unidos e o Japão, pois eles consideram que 1 em cada 2.000 pessoas possui alguma doença rara. Eles acreditam e mensuram ainda que na União Europeia há cerca de 30 milhões de cidadãos com alguma doença rara.
Tabela 1 – Definição de doença rara segundo o critério de prevalência.
|
|
||
|
Países |
Prevalência em 100.000 |
Origem da Designação |
|
Estados Unidos |
66 |
Orphan Drug Act 1983 |
|
União Europeia |
50 |
Regulation EC nº 141/2000 |
|
Japão |
40 |
Orphan Drug Act 1993 |
|
Austrália |
11 |
Orphan Drug Program 1997 |
|
Suécia |
10 |
Swedish National Board of Halth and Welfare |
|
França |
50 |
Regulation EC nº 141/2000 |
|
Holanda |
50 |
Regulation EC nº 141/2000 |
|
OMS |
50 |
Organização Mundial da Saúde |
|
Fonte: Policies for Orphan Diseases and Orphan Drugs, Denis (2009, p.10) |
||
Considerando os dados da Organização Mundial de Saúde, estima-se que haja no mundo 400 milhões de pessoas com algum tipo de Doença Rara em cada 7 bilhões de pessoas. Sendo assim, entende-se que cerca de 6% a 8% da população mundial possui algum tipo de Doença Rara.
Infelizmente, existem outras doenças que por sua vez são consideradas ultra-raras, ou seja, aquelas que não são genéticas, e não possuem nenhum tipo de informação conclusiva. Isto afeta somente alguns milhares, centenas ou até mesmo um par de dezenas de pessoas mundialmente.
É importante saber que essas doenças tornam o paciente, e seus familiares particularmente isolados e vulneráveis. O que nos remete à um pensamento, que dentro deste mundo que pode ser explorado e estudado, o indivíduo paciente não é considerado somente ele “o paciente”, mas sim toda a sua família passa a se tornar um “paciente”.
Todas estas informações, são consideradas como alertas, pois o impacto que as doenças raras podem trazer na vida dos pacientes e seus familiares é extremamente considerável, se comparada à muitas mudanças que ocorrem mediante às descobertas acerca de suas patologias3. O relatório da EURORDIS (2005, p. 4) destaca um aspecto chamado “paradox of rarity”4 segundo o qual “(...) even though the diseases are rare, rare diseases patientes are many. ”5
Citando o documento de trabalho sobre doenças raras para o "Relatório da OMS6 sobre Medicamentos Prioritários para a Europa e para o mundo" - 7 de outubro de 2004: “Infelizmente, os dados epidemiológicos7 disponíveis não são suficientes para a maioria das Doenças Raras para dar detalhes concretos sobre o número de pacientes com uma doença rara específica. Em geral as pessoas com algum tipo de Doença Rara não estão registradas nas bases de dados. Muitas destas doenças são somados como "outras desordens metabólicas e endócrinas" e, como consequência, com poucas exceções, é extremamente difícil registrar as pessoas com uma Doença Rara, a nível nacional ou internacional, e de maneira harmonizada”.
Vale a pena notar que, estatisticamente todos e cada um de nós é portador de 6 a 8 anormalidades genéticas, mas geralmente nem sempre são recessivos na sua transmissão. Essas anormalidades geralmente não têm consequências, mas se dois dos indivíduos com a mesma anormalidade genética tiverem filhos, a probabilidade deste indivíduo ser afetado é considerável. Por isto, ressaltamos que é importante que o paciente não seja apenas o paciente e sim toda sua família adote o papel de “paciente”.
3.3. Contradição de raridade
Os números citados acima, comprova pontos contraditórios, pois significa que mesmo que as doenças sejam raras os pacientes com estas doenças são muitos. Portanto, não é incomum se ter uma doença rara. Além de não ser incomum ser afetado por uma Doença Rara, as famílias destes pacientes são em todos os pontos afetados diretamente ou indiretamente. Partindo deste ponto, é também “raro” encontrar qualquer família, ou até mesmo algum conhecido que não tenha sido afetado por uma Doença Rara.
Uma mãe europeia disse:
“At the age of 6, Samuel was diagnosed with a rare metabolic disease. Almost three years after Samuel’s death, we are still a family with a rare disease: I have discovered that I have symptoms linked to the fact that I am a carrier, my marriage broke down due to the stress of losing a child and my daughter was unable to sit her A level exams due to the grief of losing her little brother and her father leaving” 8
3.4. Disparidade e heterogeneidade das doenças raras
A partir da visão médica, Doenças raras são caracterizadas pela grande heterogeneidade de patologias e sintomas que podem variar não somente de doença para doença, mas também dentro da mesma doença. Desta forma, entendemos que haverá e existem diversas manifestações clinicas em uma pessoa diferentemente de outra pessoa, mesmo que seja a mesma doença.
Várias organizações entendem que existem muitas Doenças Raras no mundo inteiro, segundo a EURORDIS, eles acreditam que pode chegar à 8.000 Doenças Raras diferentes, que afetam os pacientes em suas faculdades mentais, comportamentais e sensoriais. Dentro destas doenças existem subtipos de Doenças Raras, o que aumenta ainda mais a diversidade dessas doenças.
Segundo à ORPHANET9, há registros que existam cerca de 6.000 a 7.000 Doenças Raras, ambas são causadas por distúrbios genéticos, ressaltamos, que podem ser de origens infecciosa ou de contato com materiais tóxicos.
Com base nos dados da National Organization For Rare Disorders (NORD, 2015),10 eles consideram a existência de ao menos 6.000 doenças raras nos EUA.
Uma pessoa que seja afetada por uma Doença Rara tem a sua expectativa de vida reduzida frente à um ser humano saudável. Quando usamos o termo expectativa de vida, pode causar tensão, pois a expectativa de vida de um paciente diagnosticado com “Porfiria”11 é diferente de um paciente que tenha Síndrome Hemolítico Urético12. Existem Doenças Raras que os pacientes morrem no nascimento, são degenerativas ou fatais.
De acordo com os dados da EURORDIS, 80% das doenças raras são de origens genéticas, ou seja, envolvem um ou mais genes, que pode ser novo ou uma mutação genética ou ainda a partir de cromossomos anormais. Existem outras Doenças Raras que são causadas por infecções (virais ou bacterianas), alergias, degenerativas, proliferativas ou teratogênicos (produtos químicos, radiações, etc.). Algumas doenças raras, são também causadas por combinações genéticas e por fatores ambientais.
Contudo, os agentes etiológicos da maioria das Doenças Raras ainda são desconhecidos devido à falta de pesquisa para encontrar a fisiopatologia destas doenças.
Discorremos sobre as principais disparidade e heterogeneidade no mundo das Doenças Raras, mas é importante lembrar também que existem grandes diversidades em relação à idade em que os primeiros sintomas podem ocorrer.
Algumas doenças podem ser identificadas antes de apresentarem sintomas, neste caso no nascimento. Porém, os sintomas para outras Doenças Raras podem ocorrer no decorrer da primeira infância, adolescência ou na fase adulta. Embora muitas doenças tenham sintomas na fase da infância, estes sintomas podem não se traduzir em um diagnóstico raro e especifico por anos.
Entendemos que as doenças raras são de difícil diagnostico, desta maneira, os sintomas são relativamente comuns para outras doenças e assim escondem Doenças Raras subjacentes. Por existir tantas diversidades no mundo das Doenças Raras, elas podem ser mascaradas por uma série de outras condições de saúde, e infelizmente podem levar à muitos erros de diagnósticos.
3.5. Características Comuns das Doenças Raras
Mesmo com tantas disparidades, as doenças raras têm alguns dos principais traços. Conforme informação da EURORDIS, segue uma lista das principais características:
-
As Doenças Raras são frequentemente crónicas, progressivas, degenerativas, e muitas vezes com risco de vida;
-
São incapacitantes: a qualidade de vida dos pacientes e muitas vezes comprometida pela falta ou perda de autonomia;
-
Alto nível de dor e sofrimento para o paciente e seus familiares;
-
Doenças incuráveis, e em sua maioria sem tratamento eficaz. Em alguns casos, os sintomas podem ser tratados para melhorar a qualidade de vida e como consequência a expectativa de vida;
-
As Doenças Raras são muito difíceis de serem geridas, pois as famílias possuem dificuldades em encontrar tratamentos desenvolvidos e eficazes. (EURORDIS, 2010)
4. REGULAMENTAÇÃO
Neste, capitulo iremos tratar sobre as regulamentações acerca de Doenças Raras instituídas em âmbito nacional e internacional, para isto falaremos do Brasil e dos Estados Unidos, União Europeia, citaremos também o Japão.
Abordaremos questões relacionadas às regulamentações práticas e econômicas.
4.0.1. Cenário Nacional - Regulamentação e Atuação no Brasil
O fato do Brasil até 2014 não possuir uma política oficial específica para doenças raras, não significa que os pacientes não recebam cuidados e tratamento. Os medicamentos acabam chegando até eles, na maioria por via judicial. E o SUS, de uma maneira ou de outra, atende essas pessoas. Porém, de forma fragmentada, sem planejamento, com grande desperdício de recursos públicos e prejuízo para os pacientes.
Segundo Souza et al. (2007, p. 5-6) a ANVISA definiu as drogas órfãs como “medicamentos utilizados em doenças raras, cuja dispensação atende a casos específicos”.
Já Dantas e Silva (2006, p. 19-22) afirmaram que, “no Brasil, os medicamentos efetivos são aqueles medicamentos comuns e com baixo custo unitário que compõe uma farmácia básica”. Entretanto embate, entre medicamentos comuns e os medicamentos excepcionais seriam aqueles de alto custo unitário, cuja a distribuição ocorre em caráter excepcional, estes que são considerados excepcionais atingem um número reduzido de indivíduos que necessitam de tratamento à longo prazo. Tais medicamentos apesar de denominados excepcionais “(...) não deixam de ser essenciais, na medida em que, dentro de sua excepcionalidade, asseguram a vida e o bem-estar do usuário” (DANTAS e SILVA, 2006, p. 20).
Tantos os pacientes como os especialistas acreditam que a política que deveria ser adotada aos pacientes com Doenças Raras, deve abranger três frentes extremamente importantes para o desenvolvimento eficaz e sadio desta nova regulamentação. Sendo:
-
Organização da assistência, garantindo-se assim o acesso ao tratamento;
-
Adoção de mecanismos, que acelerem a entrada e comercialização de medicamentos para este fim;
-
E por fim, a incorporação das drogas no Sistema Único de Saúde (SUS).
Mesmo com tantas dificuldades neste setor, vemos que os pacientes em parcerias com grandes organizações e associações tem buscado grandes auxílios no que se diz respeito, às doenças raras. É impressionante o conteúdo que estes civis possuem.
Mediante à muitas solicitações, pesquisas e apelo público, em 2014 foi instituída uma portaria de política Nacional à Atenção Integral à Pessoas com Doenças Raras.
O Ministério da Saúde publicou a Portaria 199, de 30 de janeiro de 2014, e por meio deste instrumento normativo instituiu a Política Nacional de Atenção Integral às Pessoas com Doenças Raras. A norma ainda definiu as Diretrizes para Atenção Integral às Pessoas com Doenças Raras no âmbito do Sistema Único de Saúde (SUS) e instituiu incentivos financeiros de custeio para os serviços especializados destinados ao tratamento de pessoas com doenças raras.
Em seu Art. 4º ficou definido que a Política Nacional de Atenção Integral às Pessoas com Doenças Raras tem como objetivo reduzir a mortalidade, contribuir para a redução da morbimortalidade e das manifestações secundárias e a melhoria da qualidade de vida das pessoas, por meio de ações de promoção, prevenção, detecção precoce, tratamento oportuno e redução de incapacidade e cuidados paliativos. Curiosamente, não estão entre os objetivos da Portaria a eventual cura destas doenças, nas hipóteses em que tal prenúncio mostrar-se possível. Trata-se de uma excessiva timidez dos objetivos previstos na Política, que poderá ser aperfeiçoada futuramente.
A fim de detalhar melhor os seus objetivos, o Art. 5o da Portaria elenca alguns objetivos específicos, tais como:
-
Garantir a universalidade, a integralidade e a equidade das ações e serviços de saúde em relação às pessoas com doenças raras, com consequente redução da morbidade e mortalidade;
-
Estabelecer as diretrizes de cuidado às pessoas com doenças raras em todos os níveis de atenção do SUS;
-
Proporcionar a atenção integral à saúde das pessoas com doença rara na Rede de Atenção à Saúde (RAS);
-
Ampliar o acesso universal e regulado das pessoas com doenças raras na RAS;
-
Garantir às pessoas com doenças raras, em tempo oportuno, acesso aos meios diagnósticos e terapêuticos disponíveis conforme suas necessidades;
-
Qualificar a atenção às pessoas com doenças raras.
Percebe-se, portanto, que os princípios da universalidade e da integralidade se encontram elencados como objetivos a serem perseguidos pela Política Nacional de Atenção aos Portadores de Doenças Raras. O Estado brasileiro deixa claro assim que a atenção especial à saúde destas pessoas é obrigatória, sem discriminação de qualquer tipo e de maneira a se utilizar dos melhores conhecimentos científicos comprovados por evidências para atingir os relevantes objetivos elencados na norma.
Foram ainda definidos os princípios norteadores da Política Nacional de Atenção Integral às Pessoas com Doenças Raras. Destacam-se, dentre os princípios elencados pela Portaria, os seguintes:
-
Atenção humanizada e centrada nas necessidades das pessoas;
-
Reconhecimento da doença rara e da necessidade de oferta de cuidado integral, considerando-se as diretrizes da RAS no âmbito do SUS;
-
Promoção do respeito às diferenças e aceitação de pessoas com doenças raras, com enfrentamento de estigmas e preconceitos;
-
Garantia de acesso e de qualidade dos serviços, ofertando cuidado integral e atenção multiprofissional;
-
Articulação Inter setorial e garantia de ampla participação e controle social;
-
incorporação e uso de tecnologias voltadas para a promoção, prevenção e cuidado integral na RAS, incluindo tratamento medicamentoso e fórmulas nutricionais quando indicados no âmbito do SUS, que devem ser resultados das recomendações formuladas por órgãos governamentais a partir do processo de avaliação e aprovação pela Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC) e Protocolos Clínicos e Diretrizes Terapêuticas (PCDT); e promoção da acessibilidade das pessoas com doenças raras a edificações, mobiliário, espaços e equipamentos urbanos.
Vale destacar, porque é de altíssima relevância para o cumprimento dos princípios da universalidade e integralidade no SUS, a maneira extremamente cautelosa e vinculante com que a Portaria define o acesso ao tratamento medicamentoso. É sabido que, por serem doenças raras, dificilmente tais doenças terão o seu eventual medicamento ou tratamento definido pela CONITEC. Nesses casos, mesmo existindo uma opção medicamentosa no mercado privado, mas que ainda não foi incorporada ao SUS por meio da CONITEC, qual será o atendimento oferecido? O não oferecimento de um medicamento existente no mercado e com evidências científicas de eficácia, mas que ainda não foi incorporado ao sistema, caracterizaria violação aos princípios da integralidade e da universalidade preconizados.
Os artigos 8º ao 11 estabelecem as competências federativas na organização do SUS para o oferecimento de serviços adequados, eficientes e humanizados no âmbito da rede de serviços públicos de saúde.
Ao Ministério da Saúde ficaram as competências mais relacionadas com a regulação geral do sistema e seu macro organização, tais como a definição dos Protocolos Clínicos e Diretrizes Terapêuticas – PCDT, a habilitação dos serviços especializados organizados pelos Estados e Municípios e a organização das informações sobre a atenção aos portadores de doenças raras no país (Art. 8o). Aos Estados e Municípios competirá a organização dos serviços propriamente dita, com habilitação junto ao Ministério da Saúde, sendo que, em harmonia com a lógica de descentralização do sistema, competirá ao Município a organização de grande parte dos serviços especializados em atenção aos portadores de doenças raras.
A portaria oferece ainda, em seu Art. 12, uma lógica de organização do cuidado das pessoas com doenças raras, que passa a ser estruturada nos seguintes eixos: (a) Eixo I: composto pelas doenças raras de origem genética, envolvendo anomalias congênitas ou de manifestação tardia; deficiência intelectual; e erros inatos de metabolismo; (b) Eixo II: composto por doenças raras de origem não genética envolvendo doenças infecciosas, inflamatórias e autoimunes.
Os Arts. 13 a 21 da Portaria definem a forma como se dará a linha de cuidado da atenção aos usuários. A atenção será organizada em atenção básica, especializada e domiciliar, com o desenvolvimento e identificação de serviços de referência distribuídos na lógica da regionalização e descentralização.
Finalmente, o Art. 22 da Portaria 199/2014 define um incentivo financeiro de custeio mensal para as equipes profissionais dos estabelecimentos de saúde habilitados como Serviços de Atenção Especializada em Doenças Raras. A Portaria chega ao detalhe dos valores a serem oferecidos. Resta saber se, pela quantidade de exigências feitas pela Portaria para a habilitação destes serviços e constituição das equipes, Estados e Municípios irão aderir de forma abrangente ao modelo por ela idealizado. (J Bras Econ Saúde; 2014 Supl.(1) p. 9 -10)
4.1. Cenário Internacional – Regulamentação nos Estados Unidos e na Europa
Começando pelo Estados Unidos, vemos que entre a década de 50 e 80, foi percebido vários grupos em defesa de pessoas com doenças raras. Este tipo de ação chamou a atenção da opinião pública, mesmo porque, trata-se de um assunto extremamente delicado. Neste momento eles se preocupavam com os financiamentos e desenvolvimentos de tratamentos que até então, não eram realizados.
Mesmo com todo conhecimento dos estudiosos, no caso cientistas. Estes grupos, detinham informações bastante pertinentes para o desenvolvimento das pesquisas. Pois eles conviviam com as situações diariamente, e percebiam muitas diferenças nas ações de seus filhos, ou entes queridos. Sendo assim, pacientes e cientistas passaram à serem aliados, de forma colaborativa, ou seja, buscaram estabelecer uma colaboração formal entre as mais diversas entidades, criando um elo entre cientistas e pacientes.
Com tantas colaborações mutuas, este processo culminou com a instituição do ODA em 4 de janeiro de 1983, que consistia numa legislação específica que regulava o desenvolvimento e o acesso ao mercado de drogas destinadas ao tratamento de doenças de baixa prevalência, ou seja, doenças raras ou órfãs. Os Estados Unidos foram pioneiros, para estabelecer a primeira lei no mundo a regular o mercado de medicamentos órfãos, de forma que, daí, surge a importância de realização de seu estudo e análise. A partir da implementação do ODA nos Estados Unidos, estabeleceu-se em legislação que seria classificada como rara aquela doença que atingisse menos de 200.000 pacientes em todo o território norte-americano, critério que naquela época correspondia a uma prevalência de 7,5 casos a cada 10.000 habitantes. Este conceito contemplou cerca de 8.000 diferentes patologias, o que corresponde a um total de cerca de 25 milhões de pessoas, ou seja, cerca de 6% a 8% da população total daquele país (LESLIE, 2006, p.443-444).
Nos Estados Unidos, tinha-se um problema bastante delicado, relacionado às políticas de saúde pública e distribuição dos recursos para o desenvolvimento de pesquisas para obtenção das drogas para tratamento. A balança fica totalmente desigual, visto que do um lado existe uma obrigação moral para aqueles que precisam de tratamento, e do outro lado da balança existe um baixo números de voluntários ou até mesmo pacientes para participarem de testes clínicos e ainda mais não se tinha tecnologias disponíveis o que dificultava ainda mais as pesquisas para as doenças raras. Como resposta a este problema o ODA instituiu diferentes formas de incentivos para que a indústria farmacêutica possa desenvolver pesquisas e promover novos medicamentos para o tratamento das doenças raras (GITES, 2010, p. 1).
O que é fantástico, é que a partir da visibilidade gerada pela iniciativa norte-americana, o que eu acredito que senão fosse as grandes massas de pacientes e familiares não se teria chegado à lugar algum. Mas o Estado norte-americano entendeu a gravidade e carência de atenção que estas pessoas passavam e infelizmente passam até hoje. Outros países passaram a adotar um posicionamento semelhante e desenvolveram uma legislação específica para o tema.
Os autores Minghetti; Giudici e Montanari (2000, p. 33-36) apresentaram os casos de regulamentação dos Estados Unidos, União Europeia e Japão, mostrando-se favoráveis a iniciativa destes países em gerar incentivos regulatórios e econômicos para o desenvolvimento de drogas órfãs, eles declararam também que todas estas ações seriam ainda insuficientes para resolver propriamente o problema. Segundo os autores, uma alterativa para esta questão seria uma comissão internacional que avaliasse a possibilidade de comercialização em diferentes países após a autorização por um deles, facilitando a aquisição por parte do país que não produz determinada droga. Desta forma, não se faria necessário realizar estudos clínicos repetitivos, e até mesmo desnecessários.
Em abril de 2000 entrou em vigor na União Europeia o EC Regulation on Orphan Medical Products, que tinha por sua vez a finalidade de regulamentar a produção e o mercado de medicamentos utilizados no tratamento de doenças raras. Os pontos da regulamentação europeia eram bastante semelhantes à norte-americana, porém, existem algumas diferenças básicas que vão além do critério de prevalência. Na regulação Europeia é necessário que o órgão que desenvolve o medicamento, comprove que o produto é destinado para diagnóstico, prevenção ou tratamento de uma condição rara, sendo necessário, inclusive, comprovar que não existe um medicamento para este fim e, caso exista, que esta nova droga é superior a droga vigente (HEEMSTRA et al., 2008a, p.2).
A União Europeia ajuda a concentrar os escassos recursos atualmente dispersos pelos vários países. Uma ação conjunta permite a doentes e profissionais partilharem competências e informações além das fronteiras. Mais concretamente pretende-se:
- Melhorar o reconhecimento e a visibilidade das doenças raras
- Assegurar que as doenças raras são adequadamente codificadas e detectáveis em todos os sistemas de informação sobre saúde
- Apoiar os planos nacionais de luta contra as doenças raras nos países da UE
- Reforçar a cooperação e a coordenação a nível europeu
- Criar redes europeias de referência que liguem centros de competência e profissionais de diversos países para partilhar conhecimentos e determinar onde se devem dirigir os doentes quando as competências necessárias não estão disponíveis nos respetivos países
- Incentivar a investigação sobre doenças raras
- Avaliar as atuais práticas de rastreio da população
- Apoiar registos de doenças raras e constituir uma Plataforma Europeia para o registo de doenças raras
- As organizações de doentes são especialmente importantes na medida em que proporcionam incentivos adicionais ao desenvolvimento de medicamentos órfãos para lutar contra as doenças raras (COMISSÃO EUROPEIRA, SND).
Infelizmente, mesmo com regulamentações tanto na Europa quando nos Estados Unidos vários autores apontaram que os desafios para os tratamentos de doenças raras ainda eram muito maiores. Pois uma vez que se é desenvolvido um medicamento e o mesmo esteja disponível no mercado é necessário desenvolver alternativas de custo-efetividade a fim de viabilizar o pagamento pelo sistema único de saúde. Além de se saber quem será o responsável por esta conta, se faz necessário também que os profissionais de saúde estejam devidamente preparados para estas situações de diagnósticos e tratamento para estas doenças com baixa prevalência na população.
4.2. Cenário Internacional – Regulação e Incentivos Econômicos
A indústria farmacêutica está entre os setores que mais sofrem com a regulação por parte dos governos, isto independente do Estado. Sendo que isso ocorre das mais diversas formas em diferentes países. Diante desta afirmativa, podemos destacar o Estados Unidos como pioneiros neste processo, visto que desde 1906 foi instituído no país o Food and Drug Act, regulou a utilização e comercialização de medicamentos no país. Partindo deste ponto, pode-se evidenciar que existe a necessidade de oferta versus controle, ou seja, para que estes medicamentos sejam comercializados com eficácia e segurança comprovada através de ensaios clínicos conclusivos.
Figura 1 : Linha do tempo para legislações de incentivo

Fonte: Adaptação de Rinaldi (2005, p. 508); Minghetti; Giudici e Montanari (2000, p. 34)
Sempre com intuito de estimular a produção de determinadas drogas, alguns países adotam algum tipo de legislação para munir a indústria farmacêutica com impulsos capazes de gerar a pesquisa e para o seu desenvolvimento continuo e eficaz. Este tipo de conduta, iniciou a partir da década de 80.
Houve e há uma evolução das leis de maior destaque no mundo, que regulam a pesquisa e desenvolvimento de drogas órfãs. Conforme citado nos capítulos anteriores, a iniciativa norte-americana de regular este mercado, iniciou-se em 1983. Cabe também dar destaque ao Medicines Exeption Orphan Drug Order, instituído em Singapura no ano de 1991, que foi a primeira regulação com estas características no continente asiático, sendo anterior até mesmo ao Orphan Drug Development Program instituído no Japão em 1993. A Regulation EC n° 141/2000 que regula os medicamentos órfãos na União Europeia passou a vigorar apenas a partir do ano 2000.
A seguir, serão apresentados os principais mecanismos da política de regulação instituídos pelo ODA e pela EC Regulation n° 141/2000 no âmbito dos Estados Unidos e da União Europeia.
É necessário sempre pontuar que o processo de desenvolvimento e pesquisa de um medicamento é longo e extremamente trabalhoso, assim como custoso e arriscado. Pois desde o início, deste artigo vimos que estes medicamentos atendem à uma pequena parcela da população. Sendo assim, incentivos econômicos são instituídos através de leis para representar uma estratégia no contexto atual.
Sendo assim, todo o medicamento, independente de já ter sido desenvolvido ou estar em fase de desenvolvimento, que atende as características correspondentes a uma droga órfã recebe designação de órfão. A partir deste ponto o mesmo poderá desfrutar das vantagens previstas em lei, que são lidas como incentivos para a sua produção. Tanto o Estados Unidos quanto a regulação da União Europeia promovem basicamente os cinco tipos de incentivos que são apresentados na Figura 2.
Figura 2 : Mecanismos de Incentivos previstos no ODA e na Regulation EC n° 141/2000

Fonte: Adaptação de Wästfels et al. (2006, p. 2).
O primeiro incentivo analisado será o procedimento centralizado de análise. Esse mecanismo serve de apoio à pesquisa, trazendo maior celeridade na aprovação, canal direto com a agência de regulação e é extremamente importante para instituições de pequeno e médio porte.
A seguir, será apresentada a assistência a protocolos. Este ponto é importante pois para que o medicamento seja autorizado são necessários vários tipos de testes capazes de demonstrar e garantir a qualidade, segurança e eficácia dos produtos. Sendo assim, as empresas ou instituições podem solicitar orientações das agências reguladoras, receber auxilio no desenvolvimento de processos padronizados para conduzir os testes além de acordos de cooperação internacional.
O acesso a fundos para financiamento de pesquisa é o terceiro incentivo a ser analisado. Tanto nos Estados Unidos quanto na União Europeia foram desenvolvidos fundos administrados pelos governos e por instituições não governamentais com o objetivo específico de gerar recursos para o financiamento do desenvolvimento destes medicamentos.
Com base em toda literatura fica claro, que este tipo de conduta é mais usual nos Estados Unidos em comparação com a União Europeia. Geralmente essas transações não são estritamente realizadas por instituições públicas, estes produtos podem ser, muitas vezes, financiados por instituições privadas, não governamentais ou até mesmo por iniciativa conjunta de vários países – mais comum na União Europeia. Segundo ROGOYSKI (2006, p. 56;) o ODA estabeleceu o Orphan Grand Program, que entre 2004 e 2006 proporcionou às instituições que desenvolvem drogas órfãs um montante de US$ 25 milhões por ano.
A análise dos incentivos de isenção tributária e redução de taxas deve e deverão ser realizadas separadamente por região. Mesmo porque, na União Europeia, esta questão tributária é tratada individualmente por cada país membro. Já nos Estados Unidos a renúncia em taxas é aplicada a todos os casos que esteja envolvido drogas órfãs, sem restrição, enquanto que a isenção tributária é aplicada como crédito de tributos na ordem de 50% para os custos de desenvolver uma droga órfã no país (ROGOYSKI, 2006, p. 5; DEAR et al., 2006, p. 268).
E por fim o a exclusividade de mercado, que é considerado um aspecto muito importante para o desenvolvimento eficaz dos medicamentos órfãs. Para as drogas produzidas que receberam a designação de órfãs é dado um período de exclusividade de mercado, que pode variar de 5 a até 12 anos, de acordo com o país em questão (DEAR et al., 2006, p. 266-268; DENIS, 2009, p. 32-33).
Neste período de exclusividade fica proibido que seja colocado no mercado, medicamentos similares. Porém segundo Ekdom (2006, p. 41-43) na União Europeia existe uma exceção para esta regra de proibição. Que é caracterizado, quando a empresa detentora desta exclusividade não possui capacidade de fornecer o medicamento em quantidade suficiente para o mercado, ou quando surge outro medicamento superioridade clinica comprovada.
Nos Estados Unidos, este incentivo é considerado o mais importante, porque acontece de forma consciente o controle e a limitação de concorrência, uma vez que a FDA proíbe a aprovação de novos medicamentos destinado a uma mesma doença a não ser que seja clinicamente superior, assim como ocorre na União Europeia.
No quadro abaixo, apresenta a comparação entre as políticas dos Estados Unidos, União Europeia e Japão, conforme descrito nos trabalhos de Rinaldi (2005, p. 508), Denis (2009, p. 32-33), Haffner et al. (2008, p. 2042) e Villa (2008, p. 5).
Analisando este quadro podemos perceber que, muitos pontos são comuns em alguns países. Mas um aspecto que podemos considerar como relevante são a redução de impostos e taxas na União Europeia, tendo em vista que se trata de 27 países que possuem este incentivo de forma descentralizada.
Figura 3: Comparação entre as políticas para drogas órfãs.
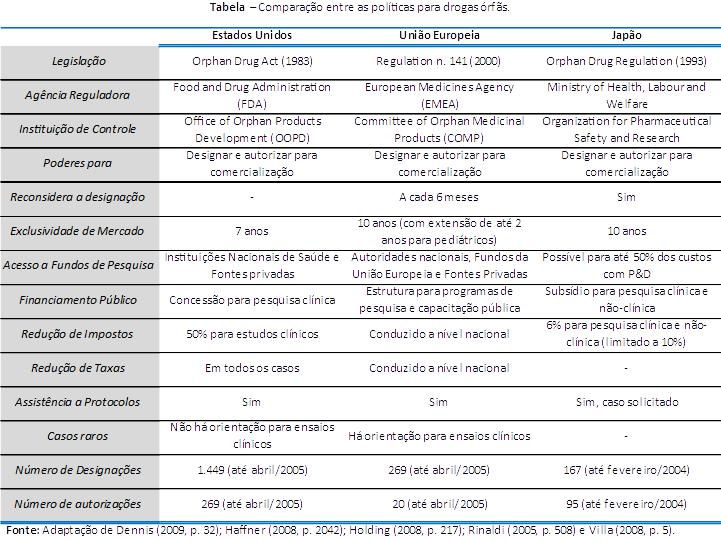
Fonte: Adaptação de Denis (2009, p. 32); Haffner (2008, p. 2042); Holding (2008, p. 217); Rinaldi (2005, p. 508) e Villa (2008, p. 5).
5. VIABILIDADE PARA AS “BIG PHARMAS”
Após vários pontos tratados, até que patamar pode ser viável para as “Big Pharma” estes medicamentos? Sim, estes pacientes representam um enorme potencial inexplorado para as empresas farmacêuticas, uma oportunidade de crescimento, e um caminho para um modelo de negócio sólido e sustentável.
A atual estagnação nos mercados farmacêuticos tradicionais, as empresas estão sentindo as pressões de olhar além de suas ofertas atuais e buscar novas populações de pacientes dentro de uma área nicho de mercado. Movendo-se para as doenças raras será uma oportunidade para a “Big Pharma” para diversificar e começar a se mover longe das drogas em desenvolvimento para as indicações do mercado de massa, ou seja, estas áreas de nicho são muito procuradas devido ao potencial para as empresas. Desta forma, eles ganham vantagens de antecipação e capacidade para estabelecer-se como líderes de mercado.
5.1. Case para investimento
Com apenas um número limitado da população afetada por uma doença rara, a justificativa para a aplicação de recursos substanciais para estudos clínicos pela indústria farmacêutica tem sido sempre um desafio e uma verdadeira barreira à inovação. Com a introdução do Orphan Drug Act (ODA) para os EUA em 1983, o que permitiu um nível de exclusividade nos termos de mais de 200 novos produtos - um aumento de 20 vezes em relação ao período anterior à introdução desta regulamentação.
5.2. Total de designações e aprovações órfãos
Como já mencionando antes a União Europeia também aprovou uma legislação semelhante ao Estados Unidos, o Regulamento (CE) n.º 141/2000, em que os produtos farmacêuticos desenvolvidos para tratar doenças raras são referidos como "medicamentos órfãos".
A pesquisa de mercado com muitos dos líderes da indústria envolvidos com o desenvolvimento de medicamentos órfãos, indicou os principais fatores influentes para prosseguir com uma aprovação de medicamentos órfãos. Conforme os incentivos econômicos dos Estados Unidos e União Europeia.
Vale lembrar que de todos os pontos mencionados, a exclusividade de mercado, limitando a concorrência e a aprovação de uma outra versão do mesmo medicamento órfão, é o mais poderoso e instigador para as “Big Pharma”.
5.3. O novo modelo das Big Pharma em medicamentos órfãos e doenças raras nos Estados Unidos.
Claramente, um novo modelo foi emergindo. Medicamentos órfãos estavam se tornando uma resposta ao declínio na aprovação de medicamentos. Com à ajuda pública (nacionalmente e internacionalmente) ao desenvolvimento, terapias para doenças raras têm vários drivers de desenvolvimento governamental e créditos fiscais, isenção de taxas FDA, financiamento de bolsas de estudos clínicos e sete anos de exclusividade para o produto comercializável. A indústria descobriu que os ensaios clínicos são menores e alguns podem ser rapidamente controlados, embora que as normas da FDA para a aprovação de um novo medicamento no mercado, ainda são os mesmos para não-órfãos e drogas órfãos. No período de 2000 a 2009 mostrou 1138 designações de medicamentos órfãos e 148 aprovações de mercado com uma proporção crescente (31%) significativamente que beneficiam as crianças com doenças raras.
Os incentivos neste ramo de negócios, têm incluído preços superiores, redução dos custos de comercialização, maiores possibilidades de reembolso para necessidades médicas não atendidas e maior tempo de exclusividade. De acordo com todo o desenvolvimento, na última fase para lançamento de medicamento, estima-se que para lançar os medicamentos órfãos foi de 3,9 anos, em comparação com 5,42 anos para medicamentos não órfãos. Além disso, eles estimam que os medicamentos órfãos têm maior probabilidade (93%) de sucesso regulamentar em comparação com 88% para medicamentos não órfãos, uma diferença significativa ( MEEKINGS, 2012).
Uma designação de medicamento órfão é ponto inicial, que é a aprovação do FDA para uma nova droga potencialmente viável. Ela fornece à uma empresa de um medicamento a designação para levantar capital para o desenvolvimento, assim como a exclusividade para comercialização. Lhes dando tempo para construir redes de pacientes, cuidadores, defensores dos pacientes e profissionais de saúde na comunidade. Medicamentos órfãos têm um grande potencial comercial, apesar de pequenos mercados, porque eles podem ditar os preços altos onde eles são a único tratamento disponível para determinada Doença Rara.
Dos 10 principais medicamentos órfãos, 60% foram indicados para mais de uma doença rara, levando a um aumento de quatro vezes no valor de pico do potencial de vendas (US $ 34 bilhões contra $ 8 mil milhões). Contra isso, é preciso reconhecer o risco financeiro elevado e o tempo de desenvolvimento de um novo medicamento que gira em torno de 10 a 15 anos. Muitos medicamentos órfãos são extremamente específicos, ou seja, são desenvolvidos para doenças ultra-raras com apenas uma indicação.
A ODA13 passou a oferecer incentivos econômicos para promover a investigação e desenvolvimento de medicamentos órfãos. De 1983 a 2010, um total de 3.393 pedidos de designação de medicamentos órfãos foram recebidos, com 2.308 pedidos que recebem o status de medicamento órfão designado. Destes, 334 tornaram-se medicamentos aprovados para comercialização.
O número medicamentos órfãos designados pela FDA aumentou, contudo, o número de aprovações permanece pequena quando comparado. Se consistentemente o elevado número de denominações conduzirá a um maior número de aprovações, isto não se sabe. Os dados históricos do FDA de OOPD14 não revelaram a existência de um padrão, o que indica que há muitas dificuldades e motivos para não se conseguir aprovação.
O pequeno número de pacientes qualificados que podem participar é um fator importante. Pode levar anos para atingir o tamanho da amostra adequado para os requisitos estatísticos. A comparação de aprovação de medicamentos órfãos contra aprovação de medicamentos não órfãos mostra que os medicamentos órfãos foram testados em número significativamente menor de participantes de ensaios clínicos. O número de participantes na maioria, dos ensaios clínicos foram significativamente menores para os medicamentos órfãos, com uma diferença de 6,6 vezes.
Uma vez aprovado e comercializado, várias empresas têm mostrado que os lucros podem ser obtidos sobre medicamentos órfãos e os pacientes podem ser atendido com grande eficácia, apesar de um pequeno número de pacientes potencialmente tratáveis. As margens de lucro bruto são de 80% na indústria de Doença Rara, enquanto que a média da indústria farmacêutica é de 16%.
A taxa composta de crescimento anual do mercado de medicamentos órfãos são de 5,7% e, atualmente estimado em cerca de $ 100 bilhões. 43 marcas de medicamentos órfãos têm vendas anuais de mais de US$ 1 bilhão (por exemplo Gleevec, Epogen, Herceptin, Neupogen e Cerezyme). Estes sucessos, 18 foram aprovadas unicamente como medicamentos órfãos nos EUA.
Dentro desses 18 medicamentos aprovados e comercializados, 11 alcançou o status de sucesso dentro do período de exclusividade de mercado dos medicamentos órfãos, que são de 7 anos.
O preço dos medicamentos órfãos é uma crítica constante no setor. Genzyme foi o líder no modelo fiscal para lucros elevados. Eles foram os primeiros a desenvolver uma droga para o mercado de ultra-rara (£ 10.000 pacientes) e o primeiro a cobrar um preço rentável. Eles desenvolveram Cerezyme, um medicamento de substituição enzimática induzível para a doença de Gaucher, a um custo de aproximadamente $ 300.000 por paciente por ano. Outros medicamentos para doenças ultra-raras têm seguido uma cobrança elevada de valores, em alguns casos podem chegar à cerca de $ 400.000 por paciente por ano.
Exemplo disto é o medicamento Soliris, da Alexion Europe é um produto para hemoglobinúria paroxística noturna, com um custo de $440.000 por paciente por ano. O resultado é que partes da Alexion nos últimos 2,5 anos ultrapassaram até mesmo o preço de partes da Apple. Outras sociedades como Sigma Tau e BioMarin têm sido bem-sucedidas com preços mais modestos. A Shire, outrora uma empresa especializada em outros medicamentos, tem se expandido desde 2005 para os medicamentos órfãos, com uma divisão dedicada à terapia para genética humana.
Figura 4: Uma biotecnologia em expansão
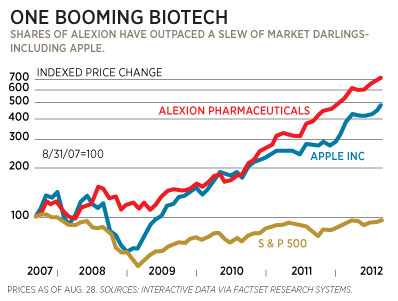
Fonte: FORBES, 2012
O medicamento Elaprase da Shire, para a síndrome de Hunter, uma doença que desfigura o paciente, em 2000 pacientes em todo o mundo, custa $ 375.000 por paciente por ano. Como é que os pacientes pagam por esses medicamentos? Assim, as companhias de seguros agora, e organizações de assistência ao paciente sem fins lucrativos e algumas empresas têm ajudado a fornecer a droga gratuitamente através de um programa de assistência ao paciente.
Enfim, considerando todos os pontos citados acima conseguimos visualizar que a rentabilidade é satisfatória para os medicamentos designados à Doenças Raras. É um setor, com grande espaço para desenvolvimento e que tenha como o objetivo à qualidade de vida e o controle dos sintomas destas Doenças Raras atrelados sim ao lucro. Pois todo desenvolvimento requer um investimento inicial, investimento este que as “Big Pharma” são responsáveis.
6. METODOLOGIA
De acordo com Lakatos (2015) “ métodos se situam em níveis claramente distintos, que se referem à sua inspiração filosófica, ao seu grau de abstração e à sua finalidade mais ou menos explicativa”. Sendo assim, tomei como metodologia a que mais se encaixa com o tema e com as origens das informações.
A metodologia utilizada foi exploratória e histórica, e o delineamento da pesquisa foi bibliográfica através de informações publicadas em sua grande maioria eletronicamente ou impressas (livros, revistas e jornais).
Este artigo foi desenvolvido com base em um estudo descritivo e tem como objetivo “ registrar, analisar e correlacionar fatos ou fenômenos, sem manipulá-los” (CERVO; BERVIAN; DA SILVA, p. 79, 2007).
Segundo Barros e Lehfeld (2002) através de “pesquisas descritivas, procura-se descobrir com que frequência um fenômeno ocorre, sua natureza, suas características, causas, relações e conexões com outros fenômenos”, ou seja, no caso deste artigo cientifico estudar, ler e analisar as políticas públicas instituídas no cenário nacional e internacional, voltados especialmente ao setor de Doenças Raras.
A técnica de coleta de dados se deu através de dados secundários, os dados foram coletados preferencialmente nos contextos em que os fenômenos são construídos e a análise dos dados foi desenvolvida, no decorrer do processo de levantamento destes (DALFOVO; LANA; SILVEIRA, 2008, p. 01-13).
REFERENCIAS
AITH, F. M, F. O direito à saúde e a política nacional de atenção integral aos portadores de doenças raras no Brasil: p. 9-10, 2014.
ASSOCIAÇÃO BRASILEIRA DE PORFIRIA (ABRAPO). Porfirias. [SND]. Disponível em: < http://www.porfiria.org.br/porfirias.htm > Acesso em: 29 outubro 2015.
BARROS, Aidil de J. P., LEHFELD, Neide Aparecida de S. Projeto de Pesquisa:
propostas metodológicas. Petrópolis, RJ: Vozes, 2002.
BRASIL. Senado Federal. Constituição da República Federativa do Brasil. [2010b]. Disponível em:< http://www.senado.gov.br/atividade/const/con1988/con1988_07.05.2015/ind.asp > Acesso em:14 set.2015.
CASTELLÓ, J. C. et al. Orphan drugs and Orphan diseases. Europan Journal of Paediatric Neurology, Nice: v. 4, p. 141-149, 2000.
CERVO, Amado Luís; BERVIAN, Pedro A.; DA SILVA, Roberto. Metodologia
Científica. 6ª ed. São Paulo: Pearson Prentice Hall, 2006.
COMISSÃO EUROPEIA (EC). O que tem feito a UE?. [SND]. Disponível em < http://ec.europa.eu/health/rare_diseases/policy/index_pt.htm > Acesso em 03 nov. 2015.
DANTAS, N. S.; SILVA, R. T. Medicamentos Excepcionais. Escola Superior do Ministério Público da União. Brasília: p. 19-22, 2006. Disponivel em: <
http://escola.mpu.mp.br/linha-editorial/manuais-de atuacao/Medicamentos%20Excepcionais%20-%203a%20revisao.pdf > Acesso em: 02 novembro 2015.
DALFOVO, M. S.; LANA, R. A.; SILVEIRA, A. Métodos quantitativos e qualitativos: um resgate teórico. Revista Interdisciplinar Científica Aplicada, Blumenau, SC, v. 2, n. 4, pp. 01-13, 2008
DEAR, J. W. et al. Are rare diseases still orphans or happily adopted? The challnges of devoloping and using orphan medicinal products. British Journal of Clinical Pharmacology. London: v. 62:3, p. 266-268, 2006.
DENIS, A. et al. Policies for Orphan Diseases and Orphan Drugs. Bélgica: Belgian Health Care Knowledge Centre, 2009. Disponível em: < https://kce.fgov.be/sites/default/files/page_documents/d20091027332.pdf > Acesso em 15 nov 2015.
EKDOM, L. V. Price setting orphan drugs: identifying the influential factors on the price setting of orphan drugs. Dutch Steering Committee on Orphan Drugs. Amsterdam: 2006, p. 41-43.
EUROPEAN ORGANIZATION FOR RARE DISEASES (Eurordis). Rare disease: understanding this public health priority. Paris: 2005, 14 p. Disponível em: Acesso em: 13 set. 2015
EUROPEAN ORGANIZATION FOR RARE DISEASES (Eurordis). What a rare disease? [2010a]. Disponível em Acesso em 13 set. 2015
EUROPEAN ORGANIZATION FOR RARE DISEASES (Eurordis). Wo we are. [2010b]. Disponível em < http://www.eurordis.org/who-we-are > Acesso em 13 set. 2015.
GITES, B. et al. Benefits of the Orphan Drug Act for rare diseases treatments. Express Online, 2010. Disponível em : < http:// www.kgi.edu/documents/in_the_news/express_online_spring_2010_-_gites.pdf+&cd=1&hl=pt-BR&ct=clnk&gl=br >. Acessado em: 02 de novembro de 2015.
HEEMSTRA, H. E. et al. Predictor of orphan drug approval in the European Union. European Journal of Clinical Pharmacology. Heidelberg: v. 64, p. 545-552, 2008b.
LAKATOS, Eva Maria; MARCONI, Marina de Andrade e. Fundamentos de metodologia científica. 5. ed. São Paulo: Atlas, 2003.
LESLIE, M. Jumpstarting research into neglected diseases. Cell Press Journal, Portland: v. 127, p. 443 – 445, 2006
MELDAU, C. D.; Síndrome hemolítico-urêmica [SND]. Disponível em: < http://www.infoescola.com/doencas/sindrome-hemolitico-uremica > Acesso em 29 nov 2015.
MEEKINGS KN, Williams CSM, Arrowsmith JE. Orphan drug development : an economically viable strategy for biopharma R&D. Drug Discov Today 2012;17:13-14; p. 660-664.
MINGHETTI, P.; GIUDICI, E. M.; MONTANARI, E. A propose to improve the supply of orphan drugs. Pharmacological Research. Milan: v. 42, n. 1, p. 33-37, 2000.
NACIONAL ORGANIZATION FOR RARE DISORDERS (NORD). About NORD. [SND]. Disponível em: < http://rarediseases.org/about/ > Acesso em: 30 outubro 2015.
RINALDI, A. Adopting an Orphan: Incentives to develop drugs for rare disorders raise hopes and controversy. European Molecular Biology Organization. Heidelberg: v. 6, p. 508.
ROGOYSKI, R. The orphan drug act and the myth of the exlusivity incentive. The Columbia science and technology law review. New York: v. 7, p. 1-22, 2006.
SOUZA, M. V. de et al . Medicamentos de alto custo para doenças raras no Brasil: o exemplo das doenças lisossômicas. Ciênc. saúde coletiva, Rio de Janeiro , v. 15, supl. 3, p. 3443-3454, nov. 2010 . Disponível em Acesso em: 02 novembro 2015.
WORLD HEALTH ORGANIZATION (WHO). WHO definition of health. [2003]. Disponível em: . Acesso em: 01 set. 2015.
ANEXO A
Termo de Compromisso
Eu Camila Batista Magalhães aluna regularmente matriculada no Curso de Gestão de Negócios Internacionais do Programa Master da Business School São Paulo, declaro que o conteúdo do projeto final intitulado: Doenças Raras: Políticas Públicas Nacionais e Internacionais é autêntico, original, e de minha autoria exclusiva. As obras consultadas e as transcrições dos textos de apoio foram devidamente citadas e referenciadas.
Estou ciente de que, por ocasião da entrega do trabalho ou a qualquer tempo, caso o mesmo seja caracterizado como plágio total ou parcial, estarei reprovada, sem direito à revisão de notas, e sujeita às sanções previstas por lei.
São Paulo, ___ de______ de 2015
________________________________
Nome: Camila Batista Magalhães
Matricula nº 02.205.73.137
RG: 44932198-8
1 EURORDIS é uma aliança não-governamental centrada nos doentes, constituída por associações de doentes e por indivíduos com atividade no campo das doenças raras, que se dedica a melhorar a qualidade de vida de todas as pessoas que vivem com doenças raras na Europa. (EURORDIS, 2010b)
2 Tradução: “uma doença rara é uma rara condição médica que afeta menos de uma a cada mil pessoas; seu diagnóstico é difícil e não existem métodos de prevenção ou tratamento. ”
3 PATOLOGIA é um ramo da ciência médica primeiramente a respeito do exame dos órgãos, dos tecidos, e de líquidos corporais a fim fazer um diagnóstico da doença.
4 Tradução: paradoxo da raridade.
5 Tradução: (...) ainda que as doenças sejam raras, pacientes destas doenças são muitos.
6 OMS é a Organização Mundial da Saúde, que é uma agência especializada em saúde, fundada no ano de 1948 e é subordinada à Organização das Nações Unidas. A sede da OMS é em Genebra, na Suíça.
7 EPIDEMIOLOGIA é o estudo da frequência, da distribuição e dos determinantes dos problemas de saúde em populações humanas, bem como a aplicação desses estudos no controle dos eventos relacionados com saúde. É a principal ciência de informação de saúde, sendo a ciência básica para a saúde coletiva.
Etimologicamente, “EPIDEMIOLOGIA” significa o estudo que afeta a população (epi= sobre; demio= povo; logos= estudo).
8 Tradução: "Com a idade de 6, Samuel foi diagnosticado com uma doença metabólica rara. Quase três anos depois da morte de Samuel, ainda somos uma família com uma doença rara: eu descobri que eu tenho sintomas ligados ao fato de que sou portador, meu casamento acabou devido ao estresse de perder um filho e minha filha foi incapaz de se sentar a ela um nível de exames devido à dor de perder seu irmão mais novo e seu pai sair "
9 ORPHANET (Base de Dados de Doenças Raras e Medicamentos Órfãos): “é um banco de dados de informação sobre doenças raras e medicamentos órfãos para todos os públicos. Seu objetivo é contribuir para a melhoria do diagnóstico, cuidados e tratamento de pacientes com doenças raras”
10 NORD (Organização Nacional para Doenças Raras): “é uma organização norte-americana de saúde pública voluntária dedicada a ajudar pessoas com doenças órfãs ou raras. (NORD, 2015)
11 PORFIRIA: As porfirias constituem um grupo de pelo menos oito doenças genéticas distintas, além de formas adquiridas, decorrentes de deficiências enzimáticas específicas na via de biossíntese do heme, que levam a superprodução e acumulação de precursores metabólicos, para cada qual correspondendo um tipo particular de porfiria. Fatores ambientais, tais como: medicamentos, álcool, hormônios, dieta, stress, exposição solar e outros desempenham um papel importante no desencadeamento e curso destas doenças. (ABRAPO, SND)
12 SÍNDROME HEMOLÍTICO-URÊMICA (SHU) caracteriza-se por anemia hemolítica microangiopática, insuficiência renal aguda e trombocitopenia (baixo número de plaquetas). (DÉBORA MELDAU, SND)
13 ODA (Orphan Drug Act)
14 OOPD (Orphan Products Desenvolvimento)
Publicado por: Camila Batista Magalhaes Nader
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.