Avaliação da possível ação mutagênica em ratos Wistar machos tratados com unha-de-gato (Uncaria tomentosa (Willd.) D.C.)
índice
- 1. RESUMO
- 2. INTRODUÇÃO E JUSTIFICATIVA
- 3. REVISÃO BIBLIOGRÁFICA
- 4. OBJETIVOS
- 5. MATERIAL E MÉTODOS
- 5.1 Grupos Experimentais e Controle
- 5.2 Tempo de Sacrifício de Animais após Administração do Extrato Seco de
- 5.3 Coleta do Material
- 5.4 Teste do Micronúcleo em Eritrócitos Policromáticos
- 5.5 Análise dos Dados
- 5.6 Resultados
- 5.7 Discussões dos resultados
- 6. CONCLUSÃO
- 7. REFERÊNCIAS BIBLIOGRÁFICAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
O conhecimento das populações sobre os usos das plantas medicinais é o elo entre novas descobertas e uma terapêutica segura. A dificuldade que a população tem ao acesso a medicamentos cria a necessidade da construção de políticas públicas, para uso de plantas medicinais e medicamentos fitoterápicos. Estes, às vezes, apresentam efeitos terapêuticos superiores aos medicamentos convencionais e com efeitos colaterais minimizados. O objetivo deste trabalho foi verificar as possíveis ações tóxicas e mutagênicas do extrato seco de Uncaria tomentosa em eritroblastos policromáticos da medula óssea de ratos da linhagem Wistar, utilizando-se do Teste do micronúcleo. A Uncaria tomentosa (unha-de-gato) é usada como planta medicinal, por apresentar propriedades antiinflamatórias, antioxidantes, antimicrobianas, antivirais e por fortalecer do sistema imune. O micronúcleo é uma pequena massa nuclear, separada do núcleo principal. O teste do micronúcleo detecta substâncias mutagênicas que quebram os cromossomos ou que interferem na formação do fuso mitótico. O aspecto mais importante do teste do micronúcleo é que permite identificar eventual aumento na frequência de mutação em células expostas a uma variedade de agentes genotóxicos, expressando danos no cromossomo como micronúcleos. Sendo assim, o teste do micronúcleo é, entre os testes citogênicos, o que fornece uma medida maior de confiança da perda do cromossomo e de sua ruptura, muito utilizado por ser de fácil execução e de baixo custo. Os dados, de acordo com as condições experimentais testadas, mostram que não houve um aumento significativo da frequência do micronúcleo. Portanto, outros períodos de tratamentos deverão ser realizados, utilizando-se de um tempo maior de exposição destes animais à substância testada.
Palavras-chave: Ação Mutagênica. Ação tóxica. Uncaria tomentosa. Unha-de-gato. Micronúcleo. Ratos Wistar.
ABSTRACT
The knowledge of people about the uses of medicinal plants is the link between new discoveries and a safe therapy. The difficulty that the population has access to drugs creates the need to develop public policies for the use of medicinal plants and herbal medicines. These sometimes show therapeutic effects superior to conventional medicines and side effects minimized. The aim of this study is to assess the possible toxic and mutagenic actions of the dry extract of Uncaria tomentosa polychromatic erythroblasts in the bone marrow of Wistar rats, using the micronucleus test. The Uncaria tomentosa (cat's claw) is used as a medicinal plant, due to its antiinflammatory, antioxidant, antimicrobial, antiviral and by strengthening the immune system. The micronucleus is a small nuclear mass, separated from the main nucleus. The test detects the micronucleus mutagenic substances that break chromosomes or that interfere with the formation of the mitotic spindle. The most important aspect of the micronucleus test is that it allows us to identify any increase in mutant frequency in cells exposed to a variety of genotoxic agents, expressed as chromosome damage in micronucleus. Thus, the micronucleus test is cytogenic between tests, which provides a greater measure of confidence and loss of chromosome rupture, often used because of its easy implementation and low cost. The data, according to the experimental conditions, show that there was an increased frequency of micronucleus. So other periods of treatment should be carried out using a longer exposure to the substance of these animals tested.
Keywords: Mutagenic Action. Toxic Action. Uncaria tomentosa. Cat's Claw. Micronucleus. Rats.
2. INTRODUÇÃO E JUSTIFICATIVA
Nos últimos anos observa-se que, enquanto a indústria investe cada vez mais recursos para as pesquisas e desenvolvimento das tecnologias médicas (YUNES, R.A.; PEDROSA, R.C.; CECHINEL FILHO, V., 2001), crescem as dificuldades de acesso da população à medicina institucionalizada e aos medicamentos (RATES, 2001).
No Brasil, a condição precária de vida da população contrasta com a grande riqueza ambiental, principalmente em relação às plantas medicinais. O Brasil possui cinco áreas de grande abundância de plantas nativas, sendo o país com a maior diversidade vegetal do mundo (GUARIM NETO e MORAIS, 2003). Sabe-se que quando utilizadas de maneira adequada, as plantas medicinais e os medicamentos fitoterápicos apresentam efeitos terapêuticos, às vezes, superiores aos medicamentos convencionais, com efeitos colaterais minimizados (GALINA, 2003).
O conhecimento das populações sobre os usos das plantas medicinais é o elo entre novas descobertas e uma terapêutica segura. O conhecimento é verificado principalmente em estudos etnobotânicos realizados com parteiras, mateiros, quilombolas, indígenas, curandeiros, grupos religiosos entre outros. Em suma, percebe-se que mitos, lendas e tradições apontam para o emprego amplo de plantas medicinais em todos os tempos, em todas as camadas sociais e quase em toda a humanidade (ROMAN JUNIOR, 2003).
Mesmo tendo conhecimento dos benefícios do uso das plantas medicinais, poucos são os trabalhos realizados com elas, para a verificação da eficácia terapêutica (OLIVEIRA et al., 2007). Deste modo, entende-se que a saúde deva elencar, em suas referências, a valorização aos conhecimentos e às práticas vivenciadas pelas comunidades em relação às plantas medicinais. Haja vista a constatação de que a base empírica quanto ao uso das plantas medicinais pode ter uma comprovação científica que habilitará a extensão destes usos à sociedade industrializada.
No intuito de estabelecer as diretrizes para a atuação do governo na área das plantas medicinais e dos fitoterápicos, o governo federal elaborou a Política Nacional de Plantas Medicinais e Fitoterápicos, aprovada por meio do Decreto Nº 5.813, de 22 de junho de 2006 (Ministério da Saúde, 2006). Para garantir à população o acesso e o uso racional tanto das plantas medicinais como dos fitoterápicos e implementar novas pesquisas.
Como as plantas medicinais são capazes de produzir diferentes substâncias tóxicas em grande quantidade, aparentemente, para sua defesa contra vírus, bactérias, fungos e animais predadores, tais substâncias vêm sendo estudadas e caracterizadas para estudos genotóxicos (FONSECA e PEREIRA, 2004).
O estudo da genotoxicidade constitui um passo importante na avaliação toxicológica dos medicamentos de origem vegetal (PARRA, A.V.; RUIZ, A.R.; GONZÁLEZ, A.V., 1997). Neste sentido, o presente estudo propôs a realização de ensaios para avaliação da genotoxicidade com a planta Uncaria tomentosa (Willd. Ex Roem. & Schult.) D.C., conhecida na medicina popular como unha-de-gato, por meio do Teste do micronúcleo em eritroblasto policromático da medula óssea de ratos Wistar. Uma das maneiras de se prevenir o efeito adverso de certos produtos químicos e substâncias naturais é a triagem de seu potencial genotóxico, por meio de testes rápidos, baratos e eficazes.
Neste caso, o aspecto mais importante do teste do micronúcleo é que permite identificar eventual aumento na frequência de mutação em células que são expostas a uma gama variada de agentes genotóxicos, por isso é capaz de expressar os danos no cromossomo como micronúcleos. Assim, o teste do micronúcleo é originalmente, entre os testes citogênicos, o que fornece uma medida de confiança da perda do cromossomo e da ruptura (FENECH, 1998). Além de ser um ensaio confiável, o micronúcleo é muito utilizado também por ser uma metodologia simples, muito usada para avaliar efeitos genotóxicos, é de baixo custo e por permitir uma analise rápida de um elevado número de células.
3. REVISÃO BIBLIOGRÁFICA
3.1. Uncaria Tomentosa (Willd.) D.C.
O gênero Uncaria, compreendendo cerca de 60 espécies, caracterizase por plantas lenhosas, geralmente trepadeiras e alguns arbustos. As espécies de Uncaria, entre outras da família Rubiaceae, são muito estudadas sob o enfoque químico, devido à presença de alcalóides do tipo oxindólico, para os quais são relatadas várias atividades farmacológicas. No continente Sul Americano o gênero Uncaria é representado por duas espécies, U. guianensis (Aubl.) Gmel e U. tomentosa (Willd.) D.C., sendo esta última a mais estudada em relação a sua composição química e farmacologia (CARBONEZI, et al 2004).
A Uncaria tomentosa (Willd. Ex Roem. & Schult.) D.C. é também conhecida como unha-de-cigana, carrapato-amarelo, unha-de-gato e garra-degavião, é nativa na Amazônia Ocidental, no Amazonas, Acre e Rondônia, com características e propriedades mais ou menos semelhantes a da Uncaria guianensis (Aubl.) J.F.Gmel. É uma das mais utilizadas na medicina tradicional (LORENZI e MATOS, 2008). Ela aumenta a capacidade leucocitária em realizar fagocitose, reduzindo processos inflamatórios. Ainda, age no fortalecimento do sistema imunológico e na supressão de replicação viral, tem propriedades antioxidantes e antimicrobianas (EROWELE, G.I.; KALEJAIYE, A.O., 2009).
Segundo Paiva et al. (2009), a Uncaria tomentosa (Willd.) D.C. também é indicada no tratamento das artrites, reumatismo, abscessos, inflamações, febre, alergia, neoplasias, úlcera gástrica, contracepção, irregularidade menstrual, recuperação de parto, impurezas da pele, diabetes, disenteria, dores de cabeça, infecções bacterianas e fúngicas, além da ação analgésica e sedativa.
A Uncaria tomentosa (Willd.) D.C. submetida a muitas investigações químicas, apresentou seis alcalóides oxindólico pentaciclicos que são: rinocofilina, mitrafilina, isotepodia A, pterodifina, isorincofilina e isomitrafilina. Bieski (2006) descreve que, além dos alcalóides já citados, existem outros como: F-mitrafina, hisurteína, hisurtina, dihifrocorianteína, uncarina, isopteropodina A.; polifenois; (epicatequina); Procianidinas A, B1, B2, e B4; Glicosideos oxindólicos e Triterpenos do Ácido Quiinóvico, Fitosteróis: b-sitosterol, estgmatelrol, campesterol isolados.
3.2. Teste do Micronúcleo
O teste do micronúcleo foi descrito pela primeira vez por SCHIMIDT. W., em 1975. É um teste realizado em mamíferos “in vivo”, e detecta substâncias mutagênicas que quebram os cromossomos (substâncias clastogênicas) ou que interferem na formação do fuso mitótico, alterando a distribuição equitativa dos cromossomos durante a divisão celular. Os micronúcleos se formam pela extrusão de cromossomos inteiros ou seus fragmentos durante a divisão celular, sendo uma porção de cromatina resultante de mitoses aberrantes (REIS et al., 2004).
Localizam-se à parte, sendo adicionais ao núcleo principal da célula; não apresentam membrana que os delimite e correspondem ao que se denomina na hematologia de Corpúsculo de Howell-Jolly (JOKSIÉ; PETROVIÉ; ILIÉ, 2004).
Em 1997, Surrallés e Natarajan destacaram as principais vantagens da análise de células micronucleadas como sendo a velocidade e a facilidade com que este tipo de estudo pode ser efetuado, especialmente quando é aplicado em roedores em estudos in vivo, além de permitir a inferência de processos de aneugênese e clastogênese.
Hayashi et al. (1990) descreveram uma técnica para a análise de células micronucleadas do sangue periférico de camundongos com a utilização de lâminas pré-coradas com o corante fluorescente acridine orange, que proporciona coloração amarela ao DNA e vermelha ao RNA. Essas propriedades permitem a identificação dos reticulócitos, eritrócitos jovens ricos em RNA em nível de citoplasma, que se coram em vermelho pela presença desse ácido nucléico. Os micronúcleos, por seu conteúdo de DNA, se coram em amarelo e se tornam muito evidentes nestas células.
Segundo Kishi et al. (1992), em estudos comparativos entre a técnica convencional de coloração por giemsa de células da medula óssea de camundongos e a técnica de coloração descrita por Hayashi et al. (1990), esta última se mostrou tão sensível quanto a primeira. Ainda segundo esse mesmo autor, esse método que utiliza lâminas pré-coradas com acridine orange é de realização ainda mais fácil e rápida, por não ser necessário processamento do material biológico antes do preparo das lâminas e nem a fixação prévia à coloração. A facilidade para análise foi um ponto destacado por Kishi et al. (1992).
3.3. Ações Tóxicas e Mutagênicas
O número de evidências relatando os efeitos biológicos dos extratos de plantas está constantemente aumentando. A composição desses extratos naturais que, aparentemente exibem apenas propriedades benéficas, inclui componentes químicos com atividades mutagênicas, teratogênicas e/ou carcinogênicas. Se os componentes genotóxicos estão presentes, eles podem intercalar-se com a molécula de DNA levando a danos genéticos em regiões de fundamental importância para o controle do ciclo celular e apoptose, acelerando o processo neoplásico. Dessa forma, é muito importante a inclusão da abordagem genotóxica em avaliações toxicológicas dos compostos terapêuticos (SANTOS et al., 2008).
O DNA (ácido desoxirribonucléico) é o material genético de todos os seres vivos e de muitos vírus, sendo a sequência de bases nitrogenadas a forma na qual a informação genética é armazenada (LEWIN, 2001). Por apresentar essa função fundamental, o DNA é bastante protegido, sendo a única molécula biológica que apresenta um mecanismo próprio para prevenção e reparo de falhas em seu metabolismo (LEHNINGER et al., 1995). Entretanto, ainda assim está sujeito a mutações que, segundo Zaha (1996), são alterações súbitas no conjunto gênico de um organismo que não são explicáveis pela recombinação da variabilidade genética preexistente. Estas alterações, segundo Lewin (2001) podem ser decorrentes de processos celulares normais (mutações espontâneas) ou devidas à exposição do organismo a agentes químicos ou físicos (mutações induzidas).
As mutações despertam grandes interesses por estarem diretamente relacionadas ao desenvolvimento de diversas doenças degenerativas, tais como câncer e arteriosclerose (DE FLORA, 1998; SEO et al., 2000). Em nosso cotidiano, estamos constantemente em contato com agentes mutagênicos como a radiação solar, poluentes presentes no ar e na água ou mesmo elementos presentes em nossa dieta.
Além disso, estima-se que milhões de trabalhadores são expostos em sua rotina de trabalho a compostos químicos, dos quais, muitos têm conhecida ação mutagênica e/ou carcinogênica (ONG et al., 1986; HONGPING et al., 2006). Tem-se documentado, por exemplo, os riscos aos quais estão sujeitos os agricultores excessivamente expostos a praguicidas, agentes químicos que têm demonstrado citotoxicidade e genotoxicidade em células humanas (HOYOS et al., 1996; LIOI et al., 1998; MARQUEZ et al., 2005) e toxicidade fetal elevada em camundongos (PEÑA et al., 1999).
A conversão de células normais em células neoplásicas normalmente envolve vários passos. Uma das fases iniciais desse processo pode envolver a ação de um carcinógeno genotóxico (WEISBURGER, 2000). Entretanto, segundo Alberts et al. (2002), uma única mutação não é suficiente para converter uma célula sadia típica numa célula cancerosa. Eles afirmam que várias evidências indicam que a gênese de um câncer requer, como regra geral, que vários acidentes raros e independentes ocorram juntos em uma célula.
A avaliação da genotoxicidade pode ser realizada nos diferentes passos de interação do agente mutagênico com o DNA ou de seus efeitos. A capacidade do composto se ligar ao material genético pode ser avaliada pela observação de aductos no DNA; a capacidade de quebrar o DNA pode ser estimada por eluição alcalina ou pelo teste do Cometa e as mutações cromossômicas e/ou genômicas podem ser quantificadas pelos testes do micronúcleo ou aberrações cromossômicas (VAN GOETHEM et al., 1997).
Segundo Gebhart (1992), as metodologias citogenéticas clássicas usadas para avaliar a mutagenicidade de agentes químicos e físicos em mamíferos também podem ser empregadas para avaliação e identificação de agentes antimutagênicos. Gebhart (1992) e Kuroda et al. (1992) reportaram a importância do uso destes sistemas, principalmente para avaliar o mecanismo de ação de agentes antimutagênicos e anticlastogênicos usando diferentes tratamentos com agentes químicos.
O interesse na identificação de produtos naturais ou sintéticos que possam ter propriedades antimutagênicas ou anticarcinogênicas tem aumentado gradativamente, pois o conhecimento de tais produtos pode ser útil como medida preventiva para o ser humano no combate a vários males. O descobrimento de produtos que reduzem a taxa de mutações fatalmente diminuiria a incidência de câncer e outras doenças degenerativas, pois o homem poderia aumentar a exposição a determinados agentes antimutagênicos efetivos (HAYATSU et al, 1988), especialmente através da dieta (WATTEMBERG, 1983; RAMEL et al, 1986).
4. OBJETIVOS
O presente trabalho teve como objetivo verificar as possíveis ações tóxicas e mutagênicas do extrato seco de Uncaria tomentosa (Willd.) D.C. em ratos da linhagem Wistar, administrado em diferentes doses.
5. MATERIAL E MÉTODOS
Para avaliação genética dos efeitos mutagênicos do extrato seco da Uncaria tomentosa (Willd.) D.C. foram utilizados 25 ratos machos adultos (Linhagem Wistar), com peso médio de 280 gramas. Os animas foram mantidos no laboratório de Análise Experimental do Comportamento no Bloco Q do Campus II da UNOESTE em Presidente Prudente-SP. Onde permaneceram alojados em ambiente controlado, com temperatura (25ºC) e luminosidade (ciclo claro/escuro de 12/12horas). Os animais receberam ração sólida e água ad libitum e foram distribuídos em grupos de cinco animais em caixas de propileno. Os grupos experimentais foram tratados com doses fixas de 28,6mg do extrato vegetal de Uncaria tomentosa (grupos experimentais A1, A2, A3) e dois grupos controles, sendo o B1 grupo controle negativo que foi tratado somente com solução fisiológica e o B2 grupo controle positivo tratados com ciclofosfamida. As doses ministradas foram calculadas segundo o peso corporal do animal. Os ratos foram tratados in vivo, por gavagem, que é uma alimentação forçada por via oral, com 1mL da solução/100g pc e sacrificados 24 horas após o último tratamento. Este número de animais em confinamento por caixa, segundo Peron et al. (2008), é o número mínimo indicado. A escolha deste sistema teste (ratos Wistar) é por este animal ter um sistema de metabolização muito próximo ao do homem e a via de administração escolhida, por gavagem, também ser semelhante a do homem.
5.1. Grupos Experimentais e Controle
A1. Grupo 24 horas
Os cinco animais receberam duas doses diárias de 28,6mg do extrato vegetal/280 gramas de peso, via oral, por gavagem e sacrificados por deslocamento cervical dos animais, 24 horas após o último tratamento.
A2. Grupo 7 dias
Os cinco animais receberam duas doses diárias do extrato vegetal, diariamente, via oral, por gavagem, utilizando-se o mesmo procedimento descrito para o grupo 1, porém, também sendo sacrificados 24 horas após o último tratamento.
A3. Grupo 15 dias
Os cinco animais receberam, via oral, por gavagem, duas doses diárias do extrato vegetal, utilizando o procedimento para sacrificá-los 24 horas após o tratamento.
B1. Grupo controle - Negativo
Cinco animais receberam duas doses diárias de solução fisiológicas via oral, por gavagem durante 15 dias de tratamento e o sacrifício dos mesmos conforme os realizados para os Grupos A1, A 2 e A3.
B2. Grupo controle - Positivo
Cinco animais receberam dose única de ciclofosfamida (Genuxal) na proporção de 50mg/kg (DL50), mediante injeção intraperitoneal e sacrificados 24 horas após o tratamento.
5.2. Tempo de Sacrifício de Animais após Administração do Extrato Seco de
Uncaria tomentosa
Cinco animais, ratos da linhagem Wistar, foram tratados via oral, por gavagem, com dose fixa de 28,6mg do extrato vegetal/280 gramas de peso animal, com objetivo de se avaliar os efeitos do extrato quanto à frequência de eritrócitos policromáticos com micronúcleos, em diferentes tempos de sacrifício dos animais após o tratamento. Os animais tratados foram sacrificados de 24 horas até 15 dias após o último tratamento. A análise foi realizada mediante a contagem de 1000 eritrócitos micronucleados por lâmina.
5.3. Coleta do Material
Os animais dos grupos controles experimentais, mantidos no laboratório de Análise Experimental do Comportamento no Bloco Q do Campus II da UNOESTE em Presidente Prudente-SP, foram sacrificados por deslocamento cervical e depois foi retirada da medula óssea dos ossos longos (fêmur).
5.4. Teste do Micronúcleo em Eritrócitos Policromáticos
O método empregado para o teste do micronúcleo em eritrócitos policromáticos foi de acordo com a técnica de HEDDLE (1973) e SCHMID (1975), com os seguintes procedimentos:
a) Os animais foram pesados e marcados individualmente e o extrato de Uncaria tomentosa foi administrado via oral, nas doses estudadas;
b) Os animais foram sacrificados por deslocamento cervical;
c) O fêmur retirado, a epífise proximal foi cortada com o auxilio de uma tesoura;
d) Uma seringa contendo 1mL de soro bovino fetal foi introduzida na incisão do fêmur para aspirar a medula;
e) A suspensão foi homogeneizada com o auxílio de uma Pipeta Pasteur e Centrifugada a 1500rpm por 5 minutos;
f) O sobrenadante foi descartado e o botão de células homogeneizadas;
g) Uma gota da suspensão celular foi transferida para uma lâmina previamente limpa para a realização de uma extensão;
h) As lâminas foram transferidas para uma estufa à 37ºC por 1 hora e 30 minutos para ocorrer à fixação do material;
i) A coloração foi realizada com Eosina – Azul de Metileno segundo Leishman na forma concentrada por três minutos; E com o corante Leishman diluído (1:5) durante um minuto.
5.5. Análise dos Dados
Os resultados foram expressos em frequência de eritrócitos policromáticos micronucleados em 1000 EP por animal.
A fotodocumentação do material obtido foi feita em câmera Alpha Innotech acoplado em microscópio Leica (modelo DM/LS I/98).
Os dados deveriam ser submetidos à análise de variância com um critério de classificação, ou seja, inteiramente ao acaso comparando as medidas dos tratamentos (BERQUÓ et. al., 1981). Mas, tendo em vista a inexpressiva frequência de eritroblastos policromáticos, estes números foram apenas demonstrados na Tabela 1.
5.6. Resultados
No presente trabalho, analisou-se 25 animais distribuídos em três grupos experimentais, tratados com Uncaria tomentosa e, dois grupos controles (positivo e negativo), num total de 10 animais, com o objetivo de avaliar os efeitos mutagênicos e citotóxicos da Uncaria tomentosa, mediante o teste do micronúcleo em eritrócitos policromáticos.
A análise das células foi feita em microscópio binocular, com aumentos de 40x e 100x, para visualização dos eritrócitos policromáticos. Foram analisados, para os grupos tratados com Uncaria tomentosa, em teste cego, 25.000 células para o total dos tratamentos, sendo 1000 por animal (Foto 1).
A fotodocumentação do material obtido foi realizada em câmera Alpha Innotech acoplado em microscópio Leica (modelo DM/LS I/98).
Cinco ratos foram tratados com ciclofosfamida para constituir controle positivo e cinco, o controle negativo, constituindo os grupos controle B1 e B2, da técnica de frequência de eritrócitos micronucleados na medula óssea de mamíferos in vivo, junto ao laboratório. Foram analisadas para o grupo controle, em teste cego, 5.000 células por grupo, sendo 1000 por animal.
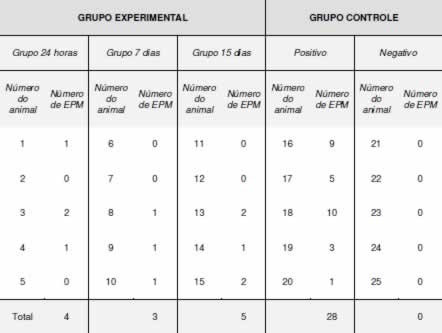
A Tabela 1 reúne a contagem de micronúcleo observado em 1000 eritrócitos policromáticos obtido da medula dos ossos longos dos ratos (linhagem Wistar) para os diferentes tratamentos controle (com soro fisiológico e com ciclofosfamida) e experimental com Uncaria tomentosa. Este trabalho deverá ter prosseguimento com períodos de tratamentos mais longos e então submeter os resultados a analise de variância segundo o indicado por Berquó (1981).
FOTO 1 - Foto de células da medula óssea de ratos da linhagem Wistar (aumento de 100x)
TABELA 1 - Número de eritrócitos policromáticos encontrados com micronúcleos, em 1000 células analisadas por animal para os grupos experimentais tratados com dose única de Uncaria tomentosa e, os controles positivo e negativo.
Fonte: Os autores.
5.7. Discussões dos resultados
Segundo o procedimento original (HEDDLE, 1973; SCHMID, 1975), os micronúcleos são contados em eritrócitos jovens. Quando os eritroblastos expelem seu núcleo, ao se transformarem em eritrócitos, os micronúcleos permanecem no citoplasma onde são facilmente reconhecíveis. Durante o período de 10 a 24 horas, os eritrócitos jovens são policromáticos (RNA-positivos), isto é, coram-se em azul.
Os micronúcleos nesse tipo de célula foram formados na mitose anterior, na presença do agente mutagênico. O período entre a última divisão e a formação de eritrócito policromático é de 8 a 12 horas, o que implica que os micronúcleos induzidos pelo agente são encontrados cerca de 10 horas após o tratamento. O intervalo mínimo, dentro do qual os micronúcleos podem ser detectados corresponde à duração do estágio de policromático, entre 10 a 24 horas (RABELLO-GAY et al., 1991).
Os micronúcleos são tipicamente arredondados, com diâmetro de 1/20 a 1/5 do diâmetro de eritrócito. Correspondem ao que se denomina, em hematologia, de corpúsculos de Howell-Jolly (RABELLO-GAY et al., 1991).
Segundo RABELLO-GAY et al. (1991), recomenda-se usar animais entre 7 a 12 semanas de idade, 5 para cada dose e contar 1000 eritrócitos policromáticos por animal.
Compostos testados pela primeira vez devem ter dois tratamentos, 0 a 24 horas e, amostras colhidas 48 horas após o primeiro tratamento, assim, os eritrócitos policromáticos presentes representam células tratadas 24 e 48 horas antes da coleta. O efeito de tratamento duplo geralmente é aditivo. Protocolos com três, quatro ou mais tratamentos induzem efeitos e diminuem a frequência de eritrócitos policromáticos (SALAMONE et al., 1980).
Depois de cada tratamento, há um intervalo do tempo particular durante o qual eritrócitos RNA-positivo micronucleados, se induzidos, poderiam estar presentes. Visto que os micronúcleos são formados durante a divisão das células eritropoéticas nucleadas, mas corado nos eritrócitos anucleados maduros. O micronúcleo não pode aparecer precocemente após o tratamento da enucleação. No rato, este tempo mínimo entre o tratamento e o aparecimento dos micronúcleos é de aproximadamente 5 horas (MAC GREGOR et al., 1987). Para a maioria dos produtos químicos, aumentos substanciais nas frequências dos micronúcleos não têm sido mais encontrados antes de 9-12 horas, após tratamento. A extensão de vida do eritrócito RNA-positivo, desde a medula óssea, foi relatado entre 10 e 30 horas nos camundongos e ratos (MAC GREGOR et al., 1987), os eritrócitos RNA positivos micronucleados formados remanescerão na medula óssea pelo menos 10- 12 horas.
Devido às diferenças entre os agentes do teste um tempo depois do tratamento, onde o pico de frequência do micronúcleo ocorre, é importante que duas ou mais amostras sejam feitas, somente se um ou dois tratamentos forem realizados. Os dados disponíveis indicam que este pico de frequência ocorre geralmente entre 24 e 48 horas após o tratamento, mas que em determinados casos pode ocorrer tão tarde quanto 72 horas após o tratamento (MAC GREGOR et al., 1987). O intervalo entre amostras deve ser mais curto do que o tempo onde faria exame de uma população de células clastogênicas afetadas na eritropoiese. Este período de tempo é aproximadamente 24 a 36 horas nos camundongos e ratos.
Desde que um clastogênico possa afetar mais do que um único ciclo celular do eritroblasto, o período onde eritrócitos policromáticos micronucleados são observáveis pode ser mais longo que 24-36 horas (MAC GREGOR et al., 1987).
Entretanto, a frequência de eritrócitos policromáticos micronucleados não é geralmente constante durante este período, mas ascende para um máximo e declina. Porque é desejável provar tão próximo como possível o tempo da frequência de eritrócitos policromáticos micronucleados, é recomendado que o tempo entre amostras não exceda aproximadamente 24 horas.
Segundo as considerações acima, as programações da amostragem são recomendadas para experimentos com camundongos e ratos. Se um tratamento for empregado, um mínimo de três amostras deve ser obtido entre 20 e 72 horas após o tratamento. Se dois tratamentos forem empregados, um mínimo de duas amostras deve ser obtido entre 20-48 horas após a última dose. Se somente forem feitos exames em duas amostras, utilizar tempo de aproximadamente 20-48 horas, depois da última dose, seria apropriado para detecção da maioria dos produtos químicos conhecidos atualmente para induzir micronúcleos. Se mais de dois tratamentos diários forem empregados por um período de três ou mais dias consecutivos, deve ser suficiente uma única amostra obtida aproximadamente 18-24 horas depois da última dose (MAC GREGOR et al., 1987).
No caso da mitomicina C e dimetil-benzeno-antroceno, após uma única injeção intraperitoneal, a frequência de micronúcleos na medula ocorre após 36 e 72 horas, respectivamente. Para certos agentes alquilantes (busulfan, ciclofosfamida), antimetabólitos (Ara C, 5-fluoruracil, 6-mercaptopurina, metotrexato) e atuantes do fuso (colchicina, vincristina) o pico é ao redor de 30 horas (RABELLO-GAY et al., 1991). Segundo RABELLO-GAY et al. (1991) recomenda-se usar animais entre 7 a 12 semanas de idade. Cinco para cada dose e contar 1000 eritrócitos policromáticos por animal. As espécies de laboratório que são apropriados para o uso do teste de micronúcleo incluem o camundongo (Mus musculus), o rato (Rattus rattus) e o Hamster chinês (Cricetulus griseus) (MAC GREGOR et al., 1987).
No presente trabalho, o sacrifício dos animais se deu 24 horas após estes terem recebido a última dose da substância testada, é devido se ter verificado em testes realizados em períodos de 15, 24 e 48 horas, que o tempo de 24 horas é aquele que evidenciou um aumento apreciável na frequência de eritrócitos policromáticos. Este fato sugere que outros períodos sejam testados e que tratamentos com períodos mais longos de tempo sejam realizados.
Os animais tratados com ciclofosfamida foram sacrificados com 24 horas, o que constitui os grupos controle positivo da técnica junto ao Laboratório, bem como animais tratados com soro fisiológico (controle negativo). Os resultados, para o controle positivo, quanto à frequência de eritrócitos policromáticos micronucleados em 1000 células analisadas foi igual à 28/1000 e para os grupos experimentais tratados com a Uncaria tomentosa em todos os períodos de tratamentos foi de 12/25000 células, isto é, em todas as lâminas analisadas e de todos os animais tratados com a Uncaria tomentosa. Estas diferenças entre o controle positivo, provavelmente, devem-se ao fato do segundo grupo ficar menos tempo exposto ao manuseio laboratorial e submetido a períodos de tratamento de curta duração. O controle negativo não apresentou eritrócitos policromáticos micronucleados.
O uso de animais não tratados não é geralmente necessário durante testes rotineiros. É importante, entretanto, que cada laboratório determine a frequência de micronúcleos nas células dos animais tratados com o veículo, ou com o solvente controle relativo à frequência espontânea em animais não tratados, de modo que todo o efeito do veículo, ou do solvente seja conhecido (MAC GREGOR et al., 1987). O controle positivo da substância, isto é, uma substância conhecida para induzir o micronúcleo na medula óssea, deve ser incluída em cada experiência para confirmar que todas as características do protocolo foram realizadas corretamente.
O agente de controle positivo, preferencialmente, deve ser um que esteja quimicamente relacionado à substância de teste. Além disso, o agente e a dose devem ser escolhidos para produzir um resultado moderado ou fraco positivo. Isto fornece uma melhor avaliação da sensibilidade do teste do que o uso de uma dose elevada de um clastogênico potente do qual se possa de qualquer forma, sempre ser detectado, indiferente de ser ou não ótima a sensibilidade do teste (MAC GREGOR et al., 1987).
A ciclofosfamida é agente alquilante de amplo espectro e é largamente utilizado no tratamento de neoplasias em geral (GOODMAN e GILMAN, 2006).
ROESER et al. (1978) citaram que os agentes alquilantes se enquadram entre as drogas mais notáveis na quimioterapia, mas promovem a destruição gonadal. Estes agentes inibem a replicação de DNA e a transcrição de RNA através do cruzamento inter e intra-cadeias de DNA, e isto afeta a síntese normal de DNA.
Geralmente, no tratamento de neoplasias, a ciclofosfamida é utilizada em combinação com outros agentes quimioterapêuticos. Embora o sucesso da quimioterapia tenha atingido alta porcentagem de cura em pacientes jovens com tumores, o tratamento tem resultado em efeitos colaterais em vários órgãos. Além do efeito tóxico agudo promovido pela ciclofosfamida, a droga também apresenta grande potencial de indução à mutagenicidade (ANDERSON et al., 1995), teratogenicidade e carcinogenicidade (GOODMAN e GILMAN, 2006), e pode promover oligospermia ou azoospermia (CAI et at., 1997).
Os resultados mostram, segundo as condições estudadas, que a frequência de micronúcleos nos eritrócitos pode ser dependente da dose e do tempo de exposição do animal à mesma. Os dados sugerem, de acordo com as condições experimentais testadas, que quanto maior a dose, maior a frequência de micronúcleos.
No presente trabalho, observando-se a frequência de células micronucleadas, sob as circunstâncias de tratamento empregadas e, quando comparadas ao controle positivo, podemos dizer que não houve um aumento significativo. Os resultados do presente estudo indicam que, nestas condições experimentais, que a Uncaria tomentosa não apresenta potencial de risco mutagênico e clastogênico. Ressaltamos, no entanto, que existe a necessidade de se testar a clastogenicidade da Uncaria tomentosa em outros sistemas de células e em outras condições devido ao alto consumo desta substância.
6. CONCLUSÃO
Os dados, de acordo com as condições experimentais testadas, mostram que não houve um aumento significativo da frequência do micronúcleo.
Portanto, outros períodos de tratamentos deverão ser realizados, utilizando-se de um tempo maior de exposição destes animais à substância testada.
Haja vista que outros trabalhos deverão ser feitos com utilização de outros sistemas de células.
7. REFERÊNCIAS BIBLIOGRÁFICAS
ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K.; WALTER, P. Molecular Biology of the Cell. New York: Garland Science, 2002.
ANDERSON, D., BASARAN, N., BLOWERS, A., EDWARDS, A.J. The effect of antioxidants on bleomycin treatment in in vitro and in vivo genotoxic assays. Mutation Research, Amsterdam, v.329, n.1, p.37-47, 1995.
BERQUÓ, E. S.; SOUZA, J. M. P.; GODLIEB, G. L. D. Bioestatística. São Paulo: EBU, 1981.
BIESKI, I. G. C. Fitoterápicos e plantas medicinais na saúde pública do município de Cuiabá-MT. Lavras–MG, 92p Trabalho de Conclusão no Curso de Plantas Medicinais, Manejo, Uso e Manipulação, pela Universidade Federal de Lavras – UFLA. LAVRAS - MG, 2005.
BRASIL. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Assistência Farmacêutica. A fitoterapia no SUS e o Programa de Pesquisa de Plantas Medicinais da Central de Medicamentos / Ministério da Saúde, Secretaria de Ciência, Tecnologia e Insumos Estratégicos, Departamento de Assistência Farmacêutica. – Brasília: Ministério da Saúde, 2006. p.
CAI, L.; HALES, B.F.; ROBAIRE, B.. Induction of apoptosis in the germ cells of adult male rats after exposure to cyclophosphamide. Biol Reprod 56: 1490-7, 1997.
CARBONEZI, C. A. et al. Determinação por RMN das configurações relativas e conformações de alcalóides oxindólicos isolados de Uncaria guianensis. Quím. Nova [online], v.27, n.6, 2004 ISSN 0100-4042
DE FLORA, S. Mechanisms of inhibitors of mutagenesis and carcinogenesis. Mutation Research, v. 402, p. 151-158, 1998.
EROWELE G. I., KALEJAIYE A. O. Pharmacology and therapeutic uses of cat's claw. Am J Health Syst Pharm. 2009 Jun 1;66(11):992-5
FENECH, M. Important variables that influence base-line micronucleus frequency in cytokinesis-blocked lymphocytes-a biomarker for DNA damage in human populations. Mutat Res., v. 404, p. 155-165, 1998.
FONSECA C. A.; PEREIRA, D. G. Aplicação da genética toxicológica em planta com atividade medicinal. Infarma. v.16, n.7-8, p.51-54, 2004.
GALINA, K. J. Guazuma ulmifolia Lam., Sterculiaceae: Estudo botânico, químico e microbiológico. Araraquara: UNESP, 2003
GEBHART, E. Anticlastogenicity in cultured mammalian cells. Mutation Research, v. 267, p. 211-220, 1992.
GOODMAN, A.; GILMAN, L.. The Pharmacological Basis of Therapeutics. 11th Ed., The MacGraw Hill Companies. 2006; pp 1324–1328, 1415.
GUARIM NETO, G; MORAIS, R. G; Recursos medicinais de espécies do cerrado de Mato Grosso: um estudo bibliográfico. Acta Bot. Bras., out/dez. 2003, vol.17, nº 4, p.561-584. Issn 0102-3306
HAYASHI, M.; MORITA, T.; KODAMA, Y.; SOFUNI, T.; ISHIDATE JR, M. The micronucleus assay with mouse peripheral blood reticulocytes using acridine orangecoated slides. Mutation Research, v. 245, p. 245-249, 1990.
HAYATSU, H.; ARIMOTO, S.; NEGISHI, T. Dietary inhibitors of mutagenesis and carcinogenesis. Mutation Research, v. 202, p. 429 – 446, 1988.
HEDDLE, J. A. A rapid in vivo test for chromosomal damage. Mutation Res, v. 18, p. 187-190, 1973.
HONGPING, D.; JIANLIN, L.; MEIBIAN, Z.; WEIC, W.; LIFEN, J.; SHIJIE, C.; WEI, Z.; BAOHONGA, W.; JILIANG, H. Detecting the cytogenetic effects in workers occupationally exposed to Vincristine with four genetic tests. Mutation Research, 2006. No Prelo.
HOYOS, L. S.; CARVAJAL, S.; SOLANO, L.; RODRIGUEZ, J.; OROZCO, L.;
LÓPEZ, Y.; AU, W. W. Cytogenetic monitoring of farmers exposed to pesticides in Colombia. Environmental Health Perspectives, v. 104, p. 535-538, 1996.
JOKSIÉ, G.; PETROVIÉ, S.; ILIÉ, Z. Age-related changes in radiation-induced micronuclei among healthy adults. Brazilian Journal of Medical and Biological Research, v. 37, p. 1111-1117, 2004.
KISHI, M.; HORIGUCHI, Y.; WATANABE, S.; HAYASHI, M. Validation of the mouse peripheral blood micronucleus assay using acridine orange supravital staining with urethane. Mutation Research, v. 278, p. 205-208, 1992.
KURODA, Y.; JAIN, A. K.; TEZUKA, H.; T., K. Antimutagenicity in cultured mammalian cells. Mutation Research, v. 267, p. 201-209, 1992.
LEHNINGER, A. L.; NELSON, D. L.; COX, M. M. Princípios de bioquímica. Porto Alegre: ArtMed, 1995.
LEWIN, B. Genes VII. Porto Alegre: Artmed, 2001.
LIOI, M. B.; SCARFI, M. R.; SANTORO, A.; BARBIERI, R.; ZENI, O.; SALVEMINI, F.;
BERARDINO, D.; URSINI, M. V. Cytogenetic damage and induction of pro-oxidant state in human lymphocytes exposed in vitro to gliphosate, vinclozolin, atrazine and dpx-e9636. Environmental and Molecular Mutagenesis, v. 32, p. 39-46, 1998.
LORENZI, H.; MATOS, F. J. A. Plantas Medicinais no Brasil: Nativas e Exóticas. Nova Odessa: Instituto Plantarum, 2008.
MAC GREGOR, J. T. et al. Guidelines for the conduct of micronucleus assays in mammalian bone marrow erythrocytes. Mutation Res, v. 189, p. 103-112, 1987.
MARQUEZ, C.; VILLALOBOS, C.; POBLETE, S.; VILLALOBOS, E.; DE LOS ANGELES GARCIA, M.; DUK, S. Cytogenetic damage in female Chilean agricultural workers exposed to mixtures of pesticides. Environmental and Molecular Mutagenesis, v. 45, n. 1, p. 1-7, 2005.
OLIVEIRA, D. G., PRINCE, K. A., HIGUCHI, C. T., SANTOS, A. C. B., LOPES, L. M. X., SIMÕES, M. J. S., LEITE, C. Q. F. Antimycobacterial acticity of some Brazilian indigenous medicinal drinks. Rev, Ciênc. Básica Apl., v.28, n.2, p.165-169, 2007.
ONG, T.; WHONG, W.; STEWART, J.; BROCKMAN, H. E. Chlorophyllin: A potent antimutagen against environmental and dietary complex mixtures. Mutation Research, v. 173, p. 111-115, 1986.
PAIVA, L. C. A.; Ribeiro R. A.; PEREIRA, J. V.; OLIVEIRA, N. M. C.. Avaliação clínica e laboratorial do gel da Uncaria tomentosa (unha de gato) sobre candidose oral. Revista Brasileira de Farmacognosia, v. 19, p. 423-428, 2009.
PARRA, A. V.; RUIZ, A. R.; GONZÁLEZ, A. V. Estudio genotóxico in vitro e in vivo en tinturas de Melissa officinalis L. (Toronjil) y Mentha piperita L. (Toronjil de menta). Revista Cubana de Plantas Medicinales 1997; 2(1): 6-11.
PEÑA, L. F. M.; MESQUITA, S. F. P.; CÓLUS, I. M. S. Evaluation of the genotoxicity and fetal toxicity of the herbicide Paraquat. Acta Scientiarum, v. 21, n. 2, p. 219- 223, 1999.
PERON, A. P.; FELIPES, J.; MATTGE, G. I.; CANTAGALLI, L. B.; MARIUCCI, R. G.;
VICENTINI, V. E. P. Avaliação mutagênica das plantas medicinais Baccharis trimera Less. e Solanum melongena L. em células de medula óssea de ratos Wistar. Revista Brasileira de Biociências, v. 6, n. 2, p. 127-130, abr./jun. 2008.
RABELLO-GAY, M. N.; RODRIGUES, M. A. R.; MONTELEONENETO, R. Mutagênese, carcinogênese, teratogênese: critérios e métodos de avaliação. Ribeirão Preto: Sociedade Brasileira de Genética, 1991. 241 p.
RAMEL, C.; ALEKPEROV, U. K.; AMES, B. N.; KADA, T.; WATTENBERG, L. W. Inhibitors of mutagenesis and their relevance to carcinogenesis. Mutation Research, v. 168, p. 47-65, 1986.
RATES, S.M.K.. Promoção do uso racional de fitoterápicos: uma abordagem no ensino de Farmacognosia. Rev. bras. farmacogn. [online]. 2001, vol.11, n.2, pp. 57- 69.
REIS, S. R. A. et al. Avaliação da presença de micronúcleos em células esfoliadas da língua de indivíduos dependentes químicos de etanol através dos métodos de Feulgen e Papanicolau. Revista Odonto Ciência, v. 19, n. 46, p. 367-371, 2004.
ROESER, H. P.; STOCKS, A.; SMITH, A. Testicular damage due to cytoxic drugs and recovery after cassation of therapy. Aust. N. Z. J. Med. v. 8, p. 250-254, 1978.
ROMAN JÚNIOR, W. A. Identificação de nitrocomposto e Di-Hidroflavonóis, atividades antibacteriana, antifúngica e antiviral de substâncias isoladas dos extratos liofilizados das raízes de Heteropteris aphrodisiaca O. Mach., Malpighiaceae, Nó-decachorro. 2003. 132 f. Dissertação (Mestrado em Ciências Farmacêuticas) – Faculdade de Ciências Farmacêuticas, UNESP, Araraquara, 2003.
SALOMONE, M. et al. Towards an improved micronucleus test. Studies on 3 model agents, Mytomycin C, Cyclophosphamide and Dimethylbenzanthracene. Mutation Res. v. 74, p. 347-356, 1980.
SANTOS R. A.; CABRAL T. R.; CABRAL I. R.; ANTUNES L. M. G.; ANDRADE C. P.;
SANTOS P. C. C.; BAHIA M. O.; PESSOA C.; NASCIMENTO J. L. M.; BURBANO R.
R.; TAKAHASHI C. S. 2008. Genotoxic effect of Physalis angulata L. (solanaceae) extract on human lymphocytes treated in vitro. Biocell 32: 195-200.
SCHMID, W. The micronucleus test. Mutation Res. v. 31, p. 9-15, 1975.
SEO, K.Y.; JELINSKY, S. A.; LOECHLER, E. L. Factors that influence the mutagenic patterns of DNA adducts from chemical carcinogens. Mutation Research, v. 463, p. 215–246, 2000.
SURRALLÉS, J.; NATARAJAN, A. T. Human lymphocytes Micronucleus Assay in Europe. An international survey. Mutation Research, v. 392, p. 165-174, 1997.
VAN GOETHEM, F.; LISON, D.; KIRSCH-VOLDERS, M. Comparative evaluation of the in vitro Micronucleus Test and the Alkaline Single Cell Gel Electrophoresis Assay for the detection of DNA damaging agents: Genotoxic effects of cobalt powder,
tungsten carbide and cobalt-tungsten carbide. Mutation Research, v. 391, p. 31-43, 1997.
WATTEMBERG, L. W. Inhibition of neoplasia by dietary constituents. Cancer Research, v. 43, p. 2448-2453, 1983.
WEISBURGER, J. H. Eat to live, not live to eat. Nutrition, v. 16, p. 767-773, 2000.
YUNES, R.A.; PEDROSA, R.C.; CECHINEL FILHO, V. 2001. Fármacos e fitoterápicos: a necessidade do desenvolvimento da indústria de fitoterápicos e fitofármacos no Brasil. Quím Nova 24: 147-152
ZAHA, A. Biologia molecular básica. Porto Alegre: Mercado Aberto, 1996.
Publicado por: Livia Clelis Luiz
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.