SÍNTESE DE ÉSTERES ATRAVÉS DE REAÇÕES DE ESTERIFICAÇÃO E TRANSESTERIFICAÇÃO, POR VIA CATALÍTICA ÁCIDA, BÁSICA, ENZIMÁTICA E RADIAÇÃO MICROONDAS
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 2.1 Considerações Gerais
- 2.2 Síntese de Ésteres
- 2.3 Catalisadores
- 3. OBJETIVOS
- 3.1 Objetivo Geral
- 3.2 Objetivos Específicos
- 4. ÉSTERES
- 4.1 Principais Aplicações
- 4.1.1 Uso como Flavorizante
- 4.1.2 Uso em Medicamentos
- 4.1.3 Combustíveis
- 4.1.4 Polímeros
- 4.1.5 Outras Aplicações dos Ésteres
- 4.2 Reações de Obtenção de Ésteres
- 4.2.1 Esterificação
- 4.2.2 Transesterificação
- 4.3 Catalisadores
- 4.3.1 Ácidos
- 4.3.2 Bases
- 4.3.3 Enzimas
- 4.3.4 Radiação por Microondas
- 5. METODOLOGIA
- 6. DISCUSSÃO
- 6.1 Catálise Ácida
- 6.2 Catálise Básica
- 6.3 Síntese Enzimática
- 6.4 Radiação por Microondas
- 7. CONCLUSÃO
- 8. REFERÊNCIAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
Ésteres são compostos usados em diversos setores industriais com atuação destacada na indústria alimentícia, cosmética e petroquímica através de sua aplicação como flavorizantes, essências e biodiesel, respectivamente. São compostos obtidos, principalmente, por síntese química através das reações de esterificação e transesterificação. Essas reações acontecem com baixa velocidade e por esse motivo são usados catalisadores como ácidos, bases, enzimas e radiação por microondas. Através de um levantamento de dados buscados na literatura científica, o presente trabalho visou compreender tais reações de obtenção de ésteres em vários tipos de catalisadores. O material pesquisado foi obtido eletronicamente e complementado através das informações buscadas em livros. Os estudos realizados comprovaram que, tanto os ácidos e bases, como as enzimas e radiação por microondas, são eficazes nas reações de esterificação e transesterificação. Na síntese do butanoato de etila e etanoato de 3-metil-butila, foi usado um catalisador ácido e foi comprovada a eficiência do catalisador através do aroma dos produtos da reação. Em uma reação de transesterificação, os autores usaram metóxido de potássio como catalisador básico e obtiveram taxas de conversão semelhante em óleo de soja in natura e óleo de soja usado em fritura. O uso de lípase, uma classe de enzimas, na catálise do butirato de isoamila resultou em taxas de conversão bastante promissoras que possibilita estudos aprofundados a essa enzima. Na condução de uma reação de transesterificação usando microondas, os autores reduziram em 88% o tempo da reação.
Palavras-chave: Biodiesel; Catalisadores; Éster; Esterificação; Transesterificação.
2. INTRODUÇÃO
2.1. Considerações Gerais
Ésteres são compostos muito utilizados industrialmente como formadores de aromas, eles são responsáveis pelo odor característico de frutas e fragrâncias, como por exemplo, o butirato de etila que proporciona o aroma de morango a diversos produtos (ARAGÃO et al., 2006). Essas características sensoriais são garantias de aceitação dos produtos (ARAGAO et al., 2009) e a sensação de sabor e odor ocasionada pelos aromas é produzida pelos sentidos quando se ingere um alimento, constituindo assim um dos mais importantes atributos dos alimentos e bebidas (SIMÕES et al., 2009).
Além de serem usados como formadores de aroma os ésteres estão associados também a vários setores industriais, como na formação de monômeros que produzem os polímeros, na indústria de medicamentos além de outras inúmeras aplicações (SKORONSKI, 2006). Essa classe de químicos é de grande importância principalmente na produção de biocombustíveis em virtude do aproveitamento e utilização de novas fontes de matérias-primas renováveis como também no desenvolvimento de novas formas de produção (ANTUNES, 2009).
2.2. Síntese de Ésteres
Quando um éster é obtido de forma natural sua extração oferece alto custo e a pequena quantidade obtida faz com que a utilização industrial seja inadequada por isso se utiliza a síntese para produção de ésteres (ARAGÃO et al., 2009). Um éster pode ser sintetizado por diversas reações sendo as mais importantes a esterificação e a transesterificação (SKORONSKI, 2006).
A esterificação é uma reação de condensação usada para síntese de ésteres (SOLOMONS e FRYHLE, 2002), ela ocorre quando um ácido carboxílico reage com um álcool produzindo um éster e água como subproduto (ALVES, 2010). A reação de esterificação, onde um álcool reage com um ácido carboxílico é chamada de esterificação de Fischer e foi descoberta em 1895 (COSTA et al., 2004).
A transesterificação de um modo geral é a reação no qual um lipídeo reage com um álcool produzindo um éster e esse processo é bastante utilizado para produção de combustíveis (SILVA et al., 2010). A reação de transesterificação vem recebendo maior destaque por dar origem a combustíveis provenientes de fontes renováveis de energia, o que faz com que demanda de produção de biodiesel aumente no Brasil e no mundo (SILVA et al., 2006).
2.3. Catalisadores
A síntese de um éster envolve reações com velocidade muito baixa, sendo necessário então a utilização de um catalisador como os ácidos, as bases, as enzimas, (SKORONSKI et al., 2010) e atualmente a irradiação por microondas também está sendo usada na catálise de reações (ALVES et al., 2010).
Os catalisadores ácidos são usados na catalise de reações de obtenção de ésteres e quando se utiliza um ácido como o sulfúrico ou clorídrico, a reação de esterificação que na ausência de um catalisador ocorreria de forma lenta, encontra o equilíbrio e se desenvolve em poucas horas (SOLOMONS e FRYHLE, 2001).
As bases como o hidróxido de sódio e hidróxido de potássio são muito usadas na catalise de reações, sobretudo na transestericação, por apresentar diversas vantagens em relação aos demais catalisadores (ALVES, 2010). Entre as vantagens oferecidas pelos catalisadores alcalinos, se destacam o baixo custo (SUAREZ et al., 2009) e a taxa de conversão que é cerca de 4000 vezes maior se comparado a um catalisador ácido (ALVES, 2010).
As enzimas são utilizadas como catalisadores biológicos e estudos atuais demonstram que elas podem ser aplicadas como agente catalisador na síntese de diversos ésteres com processos conduzidos em condições mais brandas de pressão, temperatura e pH (SKORONSKI, 2006). Além disso, as enzimas apresentam vantagens que são atribuídas a venda do produto, pois o fato de um composto ser sintetizado por via biológica faz com que ele venha ser considerado natural, diferentemente dos compostos sintetizados com catalisadores químicos (SKORONSKI, 2006).
A utilização da irradiação de microondas na catálise de reações é atribuída ao fato de que a mesma apresenta diversas vantagens tais como: a redução do tempo da reação, a diminuição de resíduos gerados, o rendimento superior aos métodos convencionais e por não ser necessário o uso de solventes orgânicos que permitem a realização de um procedimento com poucas interferências (ALVES et al., 2010). É importante ressaltar que além desses quatro tipos, existem outros catalisadores, porém, não serão detalhados por não fazerem parte do objetivo dessa pesquisa.
A catálise de reações de esterilização e transesterificação por ácidos, bases, enzimas e por radiação microondas é primordial na síntese de ésteres em virtude da baixa velocidade dessas reações. Nesse contexto, a importância do conhecimento dos ésteres e processos de síntese dos mesmos é indiscutível. Portanto, a compreensão da estrutura e das reações de formação de ésteres é de grande valia, tanto para a comunidade científica, quanto para as indústrias que lidam com este tipo de composto químico. Este trabalho, no entanto, mostra um pouco dos modos de realização dessas reações, além dos tipos diversos de catalisadores empregados na síntese dos ésteres.
3. OBJETIVOS
3.1. Objetivo Geral
Compreender as reações de obtenção de ésteres por diversas vias catalíticas: ácida, básica, enzimática e radiação por microondas, de acordo com os estudos já realizados na literatura científica.
3.2. Objetivos Específicos
-
Diferenciar as reações de esterificação e transesterificação na obtenção de ésteres.
-
Compreender a utilização dos catalisadores (ácidos, bases, enzimas, radiação) nestas reações.
-
Verificar o rendimento das reações pela alteração do meio catalítico.
4. ÉSTERES
Ésteres são compostos orgânicos obtidos pela reação entre um ácido carboxílico e um álcool catalisado por um ácido forte (SOLOMONS e FRYHLE, 2001). Podem, também, serem formados através da reação de ácidos inorgânicos, anidridos ácidos, halogênios entre outros compostos, porém, a reação de um ácido carboxílico com um álcool é a mais conhecida (ANTUNES, 2009).
A IUPAC (International Union of Pure Applied Chemistry) sugere que os ésteres sejam nomeados a partir dos ácidos que provêm com terminação ato ou oato, e o nome dos alcoóis assume a nomenclatura de um radical com a terminação ila (SOLOMONS e FRYHLE, 2002). Por exemplo, acetato de etila, propanoato de terc-butila, acetato de vinila, etanoato de etila, entre outros (SOLOMONS e FRYHLE, 2002). Quando um éster tem a sua estrutura cíclica é chamado de lactona (ALLINGER et al., 1976).
Os ésteres que são derivados de ácidos e alcoóis inferiores são líquidos incolores de odor agradável e apresentam baixa massa molar, sendo miscíveis em água (SKORONSKI, 2006). Já os ésteres derivados de alcoóis superiores com alta massa molar são insolúveis em água (SKORONSKI, 2006). Os ésteres possuem ponto de ebulição menor do que os dos ácidos e alcoóis podendo ser comparados com os pontos de ebulição dos aldeídos e cetonas (SOLOMONS e FRYHLE, 2002). A Tab. 1 mostra as propriedades físicas de alguns ésteres.
Tabela 1: Ésteres e Suas Propriedades Físicas.
|
Éster |
P.F. (°C) |
P.E. (°C) |
Solubilidade em Água ( g/100mL a 20°C) |
|
Formato de Metila |
-99 |
31,5 |
Muito Solúvel |
|
Formato de Etila |
-79 |
54 |
Solúvel |
|
Acetato de Metila |
-99 |
57 |
24,4 |
|
Acetato de Etila |
-82 |
77 |
7,39 (25°C) |
|
Butanoato de Etila |
-93 |
120 |
0,51 |
|
Hexanoato de Etila |
-68 |
168 |
0,063 |
|
Octanoato de Pentila |
-35 |
260 |
< 0,001 |
|
Benzoato de Metila |
-12 |
199 |
0,15 |
|
Benzoato de Etila |
-35 |
213 |
0,08 |
Fonte: Modificado de SKORONSKI, 2006.
Em virtude das interações de Van der Walls os ésteres são solúveis em solventes orgânicos apolares e pouco solúveis com os polares como os hidrocarbonetos, haletos de aquila e éteres (SKORONSKI, 2006). A maioria dos ésteres é solúvel em alcoóis e os que apresentam até três carbonos em sua estrutura são praticamente solúveis em água (SKORONSKI, 2006).
4.1. Principais Aplicações
Os ésteres representam um quarto do valor no que se referem a aditivos alimentares no mercado mundial, esses compostos foram avaliados em US$ 3 bilhões (GOMES et al., 2004). Destacam-se entre os principais compostos na indústria, e mesmo em pequenas quantidades (cerca de 1 a 100ppm) conferem os aromas de frutas e flores aos produtos (SIMÕES et al., 2009).
Os ésteres, também, são compostos de ampla aplicação no setor industrial com destaque para a produção de combustíveis, em especial o biodiesel, é usado em fármacos, em aromas nas indústrias alimentícia e cosmética e também é utilizado como monômero na produção de polímeros (SKORONSKI, 2006).
4.1.1. Uso como Flavorizante
O aroma está entre os principais atributos que determinam a escolha e o consumo dos alimentos (SIMÕES et al., 2009). Historicamente, os gregos e romanos perfumavam seus vinhos com rosas, violetas, ervas e condimentos exóticos trazidos da China, Índia e Egito (SIMÕES et al., 2009). Os avanços na química orgânica que ocorreram durante o século XIX tornaram possíveis que substâncias como a vanilina e a cumarina, ambas com propriedades aromatizantes, pudessem ser sintetizadas e adicionadas aos produtos alimentícios (SIMÕES et. al., 2009).
Nos dias atuais, as indústrias produzem uma grande quantidade de ésteres que são usados como aromas em balas, doces, medicamentos entre outros produtos (FELTRE, 2004). Para estas aplicações os ésteres naturais, tais como os derivados do óleo de baleia, cera de carnaúba e óleo de jojoba podem ser usados, mas são produtos caros e não estão disponíveis em grandes quantidades, então se utilizam métodos para a produção de tais ésteres a partir de matérias-primas mais baratas e que tem grande disponibilidade no mercado (OLIVEIRA et al., 2004).
Os ésteres possuem em geral odor agravável semelhante ao de frutas (WATANABE, 2010), o acetato de isopentila possui odor semelhante ao de banana, o valerato de isopentila tem o odor característico da maçã e o propionato de isobutila assemelha-se ao rum (ALLINGER et al., 1976). Essa característica é primordial para que uma das suas principais aplicações seja a utilização como aroma artificial de produtos, onde os ésteres são denominados “flavorizantes” (FELTRE, 2004). Esse termo está relacionado à palavra de origem inglesa “flavor” que significa, ao mesmo tempo, sabor e aroma (FELTRE, 2004).
O etanoato de etila é uma referência em relação aos ésteres devido à sua grande produção industrial, pois somente no ano de 2004 a produção mundial desse composto químico foi de cerca de 1,5 milhões de toneladas para ser utilizado como solvente na indústria química e farmacêutica, na indústria alimentícia na produção de chá e café descafeinado, perfumes e aromas artificiais, entre outras aplicações (NASCIMENTO et al., 2008).
Na indústria farmacêutica os flavorizantes são usados em medicamentos para melhorar o seu sabor, eles podem ser de origem natural como os óleos, essências extraídos das plantas e sabores de frutas e de origem sintética como o acetato de benzila que é responsável pelo sabor artificial de cereja, abricó, pêssego e morango (BALBANI et al., 2006).
4.1.2. Uso em Medicamentos
Substâncias que contêm a função éster carboxílico são usadas nos diversos medicamentos, o cloridrato de procaína, por exemplo, é comercializado com o nome de Novocaína® e é um dos anestésicos locais mais comuns, o salicilato de metila é um dos componentes do Gelol® medicamento utilizado no tratamento de traumas musculares (SKORONSKI, 2006).
Os barbituratos fazem parte da classe de hipnóticos mais importantes, e foram usados pela primeira vez na medicina em 1903, eles são produzidos pelo processo de condensação da uréia com ésteres malônicos (ALLINGER et al., 1976).
4.1.3. Combustíveis
Em virtude do grande apelo ambiental relacionado à diminuição do uso de combustíveis fósseis, estão sendo pesquisadas fontes de combustíveis que sejam menos agressivos ao meio ambiente (SKORONSKI, 2006). Atualmente, os óleos vegetais transformados ou transesterificados se apresentam como uma alternativa para a substituição de combustíveis derivados de petróleo (FROEHNER e LEITHOLD, 2007).
Nesse contexto, a importância dos ésteres é estendida à produção de biocombustíveis com o aproveitamento e o uso de novas fontes renováveis e o desenvolvimento de novas formas de produção (ANTUNES, 2009).
O biodiesel é o um dos bicombustíveis mais conhecidos e pode ser definido como mono-alquil éster de ácidos graxos que provem de fontes renováveis (óleos vegetais e gorduras animais) obtido através da transesterificação, onde ocorre a transformação de triglicerídeos em moléculas de ésteres de ácidos graxos (FERRARI et al., 2004). Podemos definir óleo como um composto que permanece líquido em condições ambientes, já a gordura é o que composto se solidifica em condições ambientes (FELTRE, 2004). A denominação de éster alquílico é aplicada ao o biodiesel, pois ele é o resultado da reação entre um ácido graxo, um álcool e um catalisador (ALVES, 2010).
4.1.4. Polímeros
Na indústria de polímeros os ésteres são usados como monômeros, podemos citar o tereftalato de metila que é usado para formação do polímero politeraftalato de etileno usado na fabricação de garrafas plásticas (PET) e fibras para indústria têxtil (SKORONSKI, 2006). Polímeros são macromoléculas que apresentam um grande número de átomos em sua composição, o número de moléculas pode variar de 2 x 103 a 1 x 105 , eles são constituídos por unidades menores são denominadas monômeros (FELTRE, 2004).
O acetato de vinila é o monômero utilizado na obtenção do poliacetato de vinila que é matéria prima para fabricação de películas para vidros à prova de choque em veículos e fixadores de tintas (SKORONSKI, 2006).
4.1.5. Outras Aplicações dos Ésteres
A utilização dos ésteres na indústria é diversificada, um exemplo disso são os ésteres presentes em bebidas destiladas como a cachaça (NASCIMENTO et al., 2009) Os ésteres alifáticos como o acetato de etila e butanoato de etila são originados durante a fermentação alcoólica, proporcionando sabor e aroma característicos a essa bebida (NASCIMENTO et al., 2009). A Tab. 2 mostra alguns ésteres e suas respectivas aplicações na indústria.
Tabela 2: Ésteres e Suas Aplicações na Indústria.
|
Composto |
Aplicação industrial |
|
Acetato de Metilo |
Solvente de tintas, colas e removedores de verniz. Reações químicas e extrações. |
|
Acetato de Etila |
Solvente de tintas, colas e removedores de verniz. Reações químicas e extrações |
|
Pentanoato de Etilo |
Aroma alimentar (maçã). |
|
Acetato de Pentilo |
Fragrância (maça, banana). |
|
Fenilacetato de Metilo |
Fragrância (mel). |
|
Ácido Acetilsalicílico |
Fármaco. |
|
Polimetacrilato de Metila |
Fabricação de fibras acrílicas para lentes de contato e filmes transparentes. |
|
Poliacetato de Vinila |
Fabricação de película para vidros à prova de choques em veículos. Fabricação de fixador para tintas. |
|
Politereftalato de Etileno |
Fabricação de filmes para produção de garrafas plásticas tipo PET. |
Fonte: Modificado de ANTUNES, 2009 e SKORONSKI, 2006.
O acetato de etila e acetato de butila são usados industrialmente como solventes, sobretudo na fabricação de vernizes, e alguns ésteres que possuem alto ponto de ebulição são aplicados como agentes plastificantes para resinas e plásticos, estas resinas e plásticos são os poliésteres (ALLINGER et al., 1976).
Na indústria farmacêutica os aromatizantes, também conhecidos por flavorizantes, são usados na melhoria do sabor e normalmente são segredos industriais, por esse motivo não vem especificado na bula (BALBANI et al., 2006).
4.2. Reações de Obtenção de Ésteres
Como vimos acima, os ésteres podem ser obtidos por diversas formas reacionais através de síntese química. Abaixo está descritos alguns métodos de obtenção destes compostos químicos.
4.2.1. Esterificação
A esterificação é um processo químico para obtenção de ésteres através da reação de um ácido orgânico ou inorgânico com um álcool, onde há substituição de uma hidroxila de um ácido por um radical alcoxíla do álcool com a eliminação de água (MELO JUNIOR, 2008). O método mais utilizado é a reação de um ácido carboxílico com um álcool (SILVA et al., 2010) onde esse processo é denominado de esterificação de Fischer ou esterificação direta e consiste em um processo lento e reversível com um rendimento de cerca de 60% (FELTRE, 2004). A reação de esterificação de Fischer é chamada também de reação de condensação, ou seja, consiste na união de duas moléculas: ácido carboxílico um e um álcool gerando um éster (ALLINGER et al., 1976).
O processo de esterificação pode ser revertido, quando isso acontece a reação recebe o nome de hidrólise que pode ser provocada quando é adicionada água com o excesso no produto da esterificação (ALLINGER et al., 1976). A Fig. 1 mostra a reação de formação do acetato de etila. Pode ser observado que o átomo de hidrogênio do álcool ataca o grupo hidroxila do ácido carboxílico. Isto é mais bem entendido pelo estudo do mecanismo desta reação, o que não é objetivo deste trabalho.
Figura 1: Reação de esterificação do acetato de etila.
.jpg)
Um aspecto a ser notado na reação de esterificação é que o subproduto da reação é a água, diferentemente da reação de transesterificação que gera glicerol, isso representa uma vantagem ambiental muito grande (MELO JUNIOR, 2008).
O processo de esterificação é utilizado na obtenção de ésteres de interesse comercial, sobretudo os solventes, diluentes, plastificantes, surfactantes, polímeros, essências e fragrâncias sintéticas, intermediário químico para indústrias, de herbicidas e de pesticidas (SILVA et al., 2010). É um processo bastante difundido, muito utilizado especialmente pelas indústrias farmacêuticas e de perfumarias (MARIA et al., 2009).
4.2.2. Transesterificação
A transesterificação é um dos métodos usados para a síntese de ésteres com um mecanismo similar a esterificação catalisada por ácido (SOLOMONS e FRYHLE, 2002). Podemos definir transesterificação como a reação de um éster com um álcool que tem como produto um novo éster, ela também é conhecida por alcoólise (FELTRE, 2004).
A transesterificação é a técnica mais conhecida no mundo para produção de biodiesel (ZATTA, 2010) e consiste na reação de um triglicerídeo com um álcool na presença de um catalisador (MELO JUNIOR, 2008). Os triglicerídeos usados na reação de transesterificação são formados a partir dos glicerídeos que por sua vez são ésteres da glicerina com ácidos graxos (FELTE, 2004). Na transesterificação são necessários três mols de álcool para cada mol de triglicerídeo (SILVA et al., 2010). A Fig. 2 mostra uma reação de transesterificação.
Figura 2: Reação Transesterificação do Óleo de Soja.
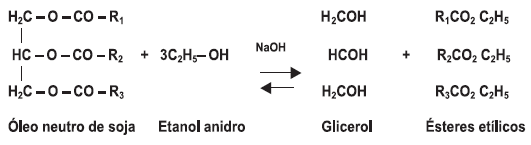
A transesterificação pode ser realizada em meio ácido e básico, porém, a reação ocorre mais rapidamente quando utilizado um catalisador alcalino, sendo que os catalisadores mais eficientes são: o hidróxido de potássio e hidróxido de sódio (FERRARI et al., 2004). O uso do hidróxido de sódio é preferível ao invés de metóxido de sódio, por causa dos perigos e inconvenientes do uso de metal de sódio (FERRARI et al., 2004). Os titanatos de alquila também são usados na transesterificação, mas são catalisadores muito fortes e seu uso se restringe apenas em escala industrial (ALLINGER et al., 1976).
4.3. Catalisadores
Catalisador é um composto químico capaz de acelerar uma reação sem alterar o processo final (ALLINGER et al., 1976). A catálise de reações pode ser realizada por catalisadores homogêneos ou heterogêneos (ALVES, 2010). A catálise homogênea acontece quando os reagentes estão na mesma fase do catalisador enquanto na heterogênea os reagentes se encontram em fases diferentes (ALVES, 2010).
A produção de catalisadores é feita por indústrias especializadas, e envolvem pesquisas aprofundadas em processos sofisticados de fabricação (FELTRE, 2004). Nos últimos anos vários catalisadores surgiram, um exemplo deles são as enzimas e radiação por microondas, ambos livres de solventes, além das conhecidas bases de Brønsted e bases ou ácidos de Lewis (CARDOSO, 2008).
4.3.1. Ácidos
As reações de esterificação podem ser catalisadas por ácido numa reação em que uma pequena quantidade de ácido reage com um ácido carboxílico aumentando a velocidade da reação de uma forma considerável (SOLOMONS e FRYHLE, 2002). O ponto de equilíbrio controla a quantidade de ésteres formados, portanto, é possível aumentar a quantidade de ésteres gerados com um aumento de ácido ou álcool (SOLOMONS e FRYHLE, 2002).
A esterificação de ácidos carboxílicos com alcoóis é conhecida por esterificação de Fischer (ANTUNES, 2009). ela é processada segundo os seguintes passos: o ácido carboxílico recebe um próton que é proveniente do ácido forte utilizado como catalisador; o ataque do álcool tem origem de um intermediário tetraédrico com dois grupos hidroxila equivalente; após ocorrer a troca de próton um dos grupos hidroxila é eliminado e finalmente é transferido do próton para uma base formando assim o éster (ANTUNES, 2009). A Fig. 1 mostra este tipo de reação.
Quando a reação é acelerada por catálise ácida, ela pode ser homogênea ou heterogênea com a utilização de um catalisador ácido de Brønsted ou Lewis (ANTUNES, 2009). São exemplos de catalisadores homogêneos do tipo ácido de Brønsted os ácidos sulfúrico, clorídrico, iodídrico, benzeno sulfónico, metanossulfónico e p-toluenossulfónico, ácidos como o n-octanoato e trifluoreto de boro podem ser citados como exemplo de ácidos de Lewis (ANTUNES, 2009).
4.3.2. Bases
A maioria dos catalisadores usados para a produção de biodiesel é de origem básica, sendo que os mais usados em processos industriais são o hidróxido de potássio (KOH) e o hidróxido de sódio (NaOH) pela sua disponibilidade (ALVES, 2010). Nesse contexto, a maior parte dos trabalhos descritos na literatura cita o KOH e NaOH onde foram observados maior rendimento e seletividade (GERIS et al., 2007). Apesar disso, os hidróxidos de metais alcalinos e os carbonatos e alcóxidos de metais alcalinos (metóxido de sódio, etóxido de sódio, propóxido de sódio, butóxido de sódio) também podem ser utilizados em catálise básica (GERIS et al., 2007).
Apesar da reação de transesterificação ser estabelecida com o uso de catalisadores ácidos e básicos, os catalisadores alcalinos, sobretudo a soda cáustica ou outras bases fortes, são dominantes em virtude dos baixos custos e rapidez que proporciona ao processo (SUAREZ et al., 2009). A taxa de conversão dos catalisadores básicos é 4000 vezes maior do que os catalisadores ácidos e o custo das bases são bastante inferiores aos demais catalisadores como, por exemplo, as enzimas (ALVES, 2010).
O processo de transesterificação alcalina apresenta algumas dificuldades, uma delas é alta pureza das matérias-primas que de vem estar praticamente isentas de ácidos graxos livres, fosfatídeos e água, essa limitação pode comprometer o futuro da hegemonia dessa tecnologia (SUAREZ et al., 2009).
4.3.3. Enzimas
Em 1926 foi isolada e cristalizada por James Sumner’s a primeira enzima a urease, capaz de catalisar a hidrólise da uréia em amônia (NH3) e dióxido de carbono (CO2) (DALLA VECHIA et al., 2004). Desde então as enzimas, exceto alguns RNAs (ribozimas), desempenham a função de catalisar reações em organismos aumentando a velocidade de uma reação cerca de 1014 vezes (DALLA VECHIA et al., 2004).
As enzimas são catalisadores biológicos muito eficientes que provocam um aumento considerável na velocidade de reações (SOLOMONS e FRYHLE, 2002). Fazem parte da classe das proteínas (SKORONSKI, 2006), e são encontradas em células de animais, plantas e em microorganismos (DALLA VECHIA et al., 2004).
As enzimas são catalisadores importantíssimos para o ser humano, e sem a sua existência a vida não seria possível (ALLINGER et al., 1976). Quimicamente podemos definir as enzimas como macromoléculas de alta massa molar formadas por subunidades conhecidas por aminoácidos (COSTA NETO, 2002).
Nos últimos anos, sua utilização na indústria vem aumentando rapidamente apesar de que ainda há um grande campo para expansão e novas enzimas vão sendo usadas industrialmente (OLIVEIRA et al., 2000). As enzimas são proteínas fundamentais na biotecnologia e bioindústria, pois catalisam e asseguram reações metabólicas na indústria microbiológica e tornam a biossíntese de metabólitos de interesse aptos na engenharia genética (SKORONSKI, 2006).
Estudos realizados demonstram que as enzimas podem ser usadas como catalisadores na síntese de diversos ésteres, em processos que apresentam condições mais brandas de temperatura, pressão e pH em comparação com os métodos convencionais (SKORONSKI et al., 2010). Além da catálise de ésteres, as enzimas são usadas em várias reações químicas e são capazes de acelerar significativamente reações sem alterarem seu equilíbrio e sem serem consumidas pela reação (SKORONSKI, 2006).
Um fato deve ser observado, quando a produção de um éster se dá por um catalisador inorgânico, ele é considerado artificial apesar de ser quimicamente igual ao natural, porém, se o composto for sintetizado com ação de uma enzima como catalisador, o mesmo é considerado natural, sendo assim, o composto se torna mais atrativo comercialmente (SKORONSKI, 2006). Pelo fato de agregar valores aos compostos, a biocatálise atualmente é um dos campos mais promissores dentro das novas tecnologias de síntese (CARVALHO et al., 2005).
De todas as enzimas usadas como catalisadores, as lípases são as mais usadas e estima-se que 20% das biotransformações atuais são realizadas com as lípases (OLIVEIRA et al., 2000). Nos processos catalisados pelas lipases em meio orgânico, a síntese de ésteres apresenta-se bastante promissora, devido a sua importância e a grande quantidade de ésteres na vida cotidiana, em produtos naturais como os triglicerídeos, fosfolipídeos, esteróides, aromatizantes e fragrâncias, que apesar das propriedades químicas diferentes possuem em comum uma ligação éster (PAULA et al., 2005).
4.3.4. Radiação por Microondas
A tecnologia de microondas se desenvolveu principalmente durante a 2º Guerra Mundial onde os fornos de microondas eram usados no aquecimento de alimentos, porém, somente a partir dos anos 80 esse tipo de energia passou a ser utilizada em laboratórios para os mais variados fins tais como secagem de amostras, sínteses, extração de compostos orgânicos, mineralização de amostras orgânicas e inorgânicas (ROSINE et al., 2004).
As microondas do forno são radiação eletromagnética não ionizante com uma freqüência correspondente a 300 a 300.000 MHz equivalente a comprimentos de onda de 1 mm a 1 m, as microondas estão situadas numa região correspondente ao infravermelho e ondas de rádio no espectro eletromagnético (SANSEVERINO, 2001).
Figura 3: Localização da Região de Microondas no Espectro Eletromagnético. (Figura retirada de SANSEVERINO, 2001).
.png)
Nos dias atuais é de extrema necessidade o desenvolvimento de processos químicos ambientalmente sustentáveis (MARIA et al., 2009), a demanda por processos sintéticos cada vez mais limpos e eficientes faz com que essas reações livres de solventes e/ou catalisadas sob radiação microondas sejam consideradas ideais (SILVA et al., 2006). As microondas são bastante eficientes para aquecer rapidamente meios reacionais reduzindo o tempo de realização muitas vezes de dias e horas para minutos ou segundos (SILVA et al., 2006). A utilização de microondas pode ser usada em várias reações, por exemplo, em alquilações, substituições nucleofílicas aromáticas, condensações, cicloadições, reações com organometálicos, oxidações, reduções, esterificações, rearranjos, reações via radicais, abertura de epóxidos, reações de transferência de fase e polimerizações entre outras (ALVES et al., 2010)
O interesse na utilização de radiação por microondas nas mais diversas reações, pode ser explicado pelas suas diversas vantagens como a significativa redução de tempo, simplicidade nos procedimentos, menor quantidade de resíduos gerados, diminuição da decomposição térmica e as reações são realizadas na ausência de solventes orgânicos e apesar disso, apresentam rendimentos superiores aos dos métodos convencionais (ALVES et al., 2010).
Recentemente as microondas estão sendo usadas na obtenção de compostos orgânicos em laboratório, onde as reações acontecem em fornos caseiros ou criados especialmente para esta finalidade (SANSEVERINO, 2001). Existem no mercado internacional, vários fornos de microondas com características diferentes que se adaptam aos mais diversos fins, porém os preços ainda são elevados o que impossibilitam seu uso como equipamento de rotina de um laboratório, então muitos pesquisadores tem optado por desenvolver projetos e fabricar os seus próprios fornos utilizando os fornos domésticos para fins laboratoriais, com ou sem adaptações (SILVA et al., 2006).
5. METODOLOGIA
A presente pesquisa consiste em uma revisão bibliográfica sobre os compostos orgânicos conhecidos como ésteres. Para sua composição, fez-se um levantamento de dados baseado nas informações obtidas em artigos acadêmicos, monografias de conclusão de curso, dissertações de mestrado e teses de doutorado. Essas fontes de pesquisa foram encontradas em publicações eletrônicas e o conteúdo obtido foi complementado com livros.
A busca desse material foi realizada utilizando-se como palavras-chave: éster; esterificação; transesterificação; catalisadores; reações de esterificação; reações de transesterificação; catalisadores ácidos; catalisadores básicos; microondas; catálise por microondas; flavorizantes; aromatizantes; ésteres e aromatizantes, ésteres e o biodiesel; biocatálise; enzimas aplicadas como catalisadores; catálise enzimática; ésteres e polímeros, ésteres na indústria farmacêutica; grupo funcional de éster; compostos orgânicos; esterificação de Fischer. O Graf. 1 mostra as fontes de pesquisa usadas para fundamentação do material teórico
Gráfico 1: Fontes de Pesquisas Utilizadas.
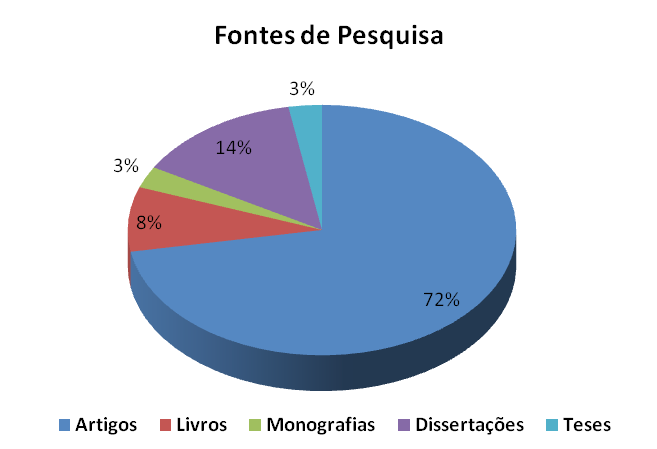
A seleção do material foi feita em conformidade com o assunto proposto de forma que em todas as fontes disponíveis foram analisados, além dos títulos, todo o conteúdo, uma vez que o título nem sempre é indicativo do conteúdo e abrangência do trabalho.
6. DISCUSSÃO
6.1. Catálise Ácida
Com o intuito de realizar uma reação de esterificação para síntese do butanoato de etila e etanoato de 3-metil-butila, COSTA et al. (2004) realizou reações de esterificação de Fischer usando ácido súlfurico como catalisador. Nesse experimento, foi comprovada a eficiência da reação, principalmente, através da distinção entre o aroma dos reagentes e produtos da reação de esterificação, ou seja, neste experimento as reações foram realizadas sem a contabilização do rendimento de cada uma delas. As presenças dos ésteres foram comprovadas apenas organolepticamente. Segundo os autores, esta identificação sensorial demonstrou ser um instrumento importante, pois permitiu a discussão da identificação de um fenômeno químico através do olfato, mesmo sem haver alterações visuais na mistura.
6.2. Catálise Básica
Para realizar uma reação de transesterificação e obtenção de biodiesel, GERIS et al. (2007) conduziu seu experimento utilizando óleo de soja in natura e óleos usados em frituras. A catálise das reações de transesterificação ocorreu em meio básico com o uso de metóxido de potássio, obtido da reação entre o metanol e o hidróxido de potássio. Foram obtidos resultados demonstrando que ambas as fontes apresentaram rendimentos similares, cerca de 89,5% para o óleo de soja in natura e 88% para o óleo de soja usado em fritura, o que permitiu a conclusão que esses óleos podem ser promissores para a produção de biodiesel. Segundo GERIS et al. (2007), deve se levar em consideração que alguns pré-tratamentos devem ser realizados antes do processo de transesterificação tais como o aquecimento, filtração, lavagem. A Fig. 4 mostra um fluxograma do pré-tratamento realizado no óleo de soja usado em fritura. O óleo de soja após ser usado em frituras se torna um resíduo indesejado, portanto a utilização desse óleo como matéria prima é favorável, tanto como formação de uma nova fonte de energia, como também para evitar a poluição trazida por esse resíduo ao meio ambiente.
Para FERRARI et al (2004), a taxa de conversão de óleo de soja neutro em biodiesel, depende de como o processo de transesterificação é conduzido, dessa forma fatores como o tipo de catalisador, temperatura e pureza dos reagentes, também tem influência direta no curso da reação.
Figura 4: Fluxograma do Pré-Tratamento Aplicado aos Óleos Residuais.
.png)
Fonte: Modificado de ALVES, 2010.
6.3. Síntese Enzimática
ARAGÃO et al. (2009), conduziu a síntese do butirato de isoamila em diferentes sistemas usando enzimas diversificafas. Segundo os autores, o uso de uma lipase na síntese do butirato de isoamila, resultou em valores de conversão bastante promissores que possibilita a essa enzima ser objeto de estudos posteriores em decorrência do grande potencial de aplicação na síntese de ésteres. Na síntese de diversos ésteres, WATANABE et al. (2010) utilizou enzimas como catalisadores e constataram que os catalisadores biológicos podem substituir os catalisadores químicos, poupando insumos na neutralização de um ácido empregado como catalisador químico.
6.4. Radiação por Microondas
Na realização de uma reação de transesterificação via catálise ácida utilizando microondas, DALL’OGLIO et al. (2005) observou que, a transesterificação do óleo vegetal e/ou gordura animal, produzem biodiesel com porcentagens de conversão entre 50 e 98%. A reação de transesterificação etílica de óleos e gorduras produz ésteres etílicos de ácidos graxos com um alto percentual de conversão e com tempo reacional baixo comparado à metodologia convencional, constituindo-se, assim, como um novo método para a produção de biodiesel.
No entanto SILVA et al. (2006), fez adaptações em um forno microondas convencional, pelo fato de um aparelho para fins laboratoriais ter um custo muito elevado. Esta adaptação contribuiu, também, para aumentar a vida útil de um forno microondas.
Foram conduzidos experimentos utilizando argila para realização de reações de transesterificação e os autores obtiveram uma taxa de conversão de 50-99%, o que é considerada excelente. Apesar dessa ótima taxa de conversão o tempo da reação foi muito alto, 48h. Porém, quando utilizado o forno microondas adaptado houve uma redução de cerca de 42h e 30min no tempo total da reação, ou seja, a reação ocorreu com um tempo total cerca de 5h e 30 min.
ALVES et al. (2010) realizou diversas reações orgânicas usando como catalisador um aparelho microondas doméstico, e foi observada uma grande eficiência, versatilidade e significativa redução do tempo quando comparados a métodos convencionais. A Fig. 5 mostra um forno microondas caseiro com adaptações para utilização em laboratório.
Figura 5: Forno Microondas Adaptado

Fonte: SILVA et al., 2006.
7. CONCLUSÃO
A utilização do óleo de soja usado em frituras para a produção do biodiesel é de grande importância, não apenas para a utilização deste material como fonte de energia, mas também para evitar a contaminação do meio ambiente. Neste contexto, as reações de transesterificação contribuem de forma significativa na produção de fontes de energia alternativas.
As reações de esterificação são muito importantes para a síntese de ésteres em virtude da grande demanda desses compostos. A quantidade de flores para extração de essências ou mesmo a retirada de compostos de origem animal seria imensa se não fosse a produção por meio de síntese desses compostos.
A utilização de catalisadores se mostrou essencial para significativa diminuição do tempo das reações de esterificação e transesterificação. Os diversos meios catalíticos aplicados pra realização das reações estudadas demonstraram haver poucas interferências no rendimento das reações. A taxa de conversão, principalmente na aplicação de radiação por microondas e catalisadores básicos, foi excelente.
As catálises enzimáticas e por radiação microondas se mostram como promissoras fontes catalíticas em virtude de não necessitarem de solventes orgânicos. Isso garante menos trabalho para neutralização dos produtos das reações e menos poluição ao meio ambiente.
8. REFERÊNCIAS
ALLINGER, N. L.; et al.; Química Orgânica. Tradutores Ricardo B. de Alecastro, Jossyel de Souza Peixoto, Luiz R. Neves de Pinho. 2. ed. Rio de Janeiro: LTC, 1976. p.170-171, p. 260-261, p.478-482, 854p.
ALVES, G. C. S.; Utilização dos Óleos de Fritura para a Produção de Biodiesel. Monografia (Graduação Tecnologia em Biocombustíveis), Faculdade de Tecnologia de Araçatuba, Araçatuba, 2010.
ALVES, R. B.; et al.; Reações Orgânicas Clássicas Auxiliadas por Irradiação Microondas. Revista Virtual e Química. v. 2, n. 3, 2010. Disponível em: http://www.uff.br/rvq> Acesso em: 29 set. 2011.
ANTUNES, B. M. H. S.; Estudo Teórico e Experimental da Esterificação do Ácido Acético com Etanol. Dissertação (Mestrado em Engenharia Química), Universidade de Aveiro, Aveiro, 2009.
ARAGÃO, V. C.; et al.; Otimização da Síntese de Butirato de Etíla Utilizando Lipase Microbiana. XXI CONGRESSO DE INICIAÇÃO CIENTÍFICA E TECNOLÓGICA EM ENGENHARIA / VI FEIRA DE PROTÓTIPOS, 2006, Rio Grande. Anais eletrônicos... Rio Grande: FURG, 2006. Disponível em: http://200.169.53.89/download/CD%20congressos/2006/CRICTE%202006/trabalhos/576365-ega-29-08-24524.pdf> Acesso em: 29 set. 2011.
ARAGÃO, V. C.; et al.; Síntese Enzimática do Butirato de Isoamila Empregando Lipases Microbianas Comercias. Química Nova. v. 32, n. 9, 2009.
BALBANI, A. P. S.; STELZER, L. B.; MONTOVANI, J. C.; Excipientes de Medicamentos e as Informações da Bula. Revista Brasileira de Otorrinolaringologia. v. 72, n. 3, 2006.
CARDOSO, A. L.; Estudo Cinético das Reações de Catalisados por Ácidos de Lewis e de Brønsted para Produção de Biodiesel. Dissertação (Pós-Graduação em Agroquímica) Universidade Federal de Viçosa, Minas Gerais, 2008.
CARVALHO, P. O. et al.; Potencial de Biocatálise Enantiosseletiva de Lípases Microbianas. Química Nova. v. 28, n. 4, 2005.
COSTA NETO, P. R.; Obtenção de Ésteres Alquílicos (Biodiesel) por Via Enzimática a partir de Óleo de Soja. Tese (Doutorado em Química), Universidade Federal de Santa Catarina, Florianópolis, 2002.
COSTA, T. S.; et al.; Confirmando a Esterilização de Fisher por Meio de Aromas. Química Nova na Escola. n. 19, 2004.
CASTRO, H. F.; MENDES, A. A.; SANTOS, J. C.; Modificações de Óleos e Gorduras por Biotransformação. Química Nova. v. 27, n. 1, 2004.
DALLA VECCHIA, R.; NSCIMENTO M. G.; SOLDI V.; Aplicação Sintética de Lipases Imobilizando Polímeros. Química Nova. v. 27, n. 4, 2004.
DALL’OGLIO, L. E.; et al.; Uso da Radiação de Microondas para a Produção de Biodiesel. Disponível em: http://www.biodiesel.gov.br/docs/congressso2006/producao/Microondas06.pdf> Acesso em: 29 set. 2011.
FELTRE, R. Química: química orgânica. 6.ed. São Paulo: Moderna, 2004. p.92-105, p.301-316, 339p. 378p.
FERRARI, R. A.; OLIVEIRA V. S.; SCARBIO A.; Biodiesel de Soja – Taxa de Conversão em Ésteres Etílicos, Caracterização Físico–Química e Consumo em Gerador de Energia. Química Nova. v. 28, n. 1, 2005.
FROEHNER, S.; LEITHOLD, J.; Transesterificação de Óleos Vegetais: Caracterização em Camada Delgada de Densidade. Química Nova. v. 30, n. 8, 2007.
GERIS, R.; et al.; Biodiesel de Soja – Reação de Transesterificação Para Aulas Práticas de Química Orgânica. Química Nova. v. 30, n. 5, 2007.
GOMES, F. M.; SILVA, M. B.; CASTRO, H. F.; Avaliação das Condições Reacionais para a Síntese Enzimática do Butirato de Butila Empregando Lipase de Candida Rugosa. Revista Brasileira de Ciências Farmacêuticas. v. 40, n. 2, 2004.
MARIA, T. M. R.; et al.; Argilas Como Catalisadores Verdes na Esterificação do Colesterol. Caracterização Espectroscópica e Identificação de Polimorfos por Métodos de Análise Térmica. Uma Proposta Laboratorial Interdisciplinar para o 1° Ciclo Universitário. Química Nova. v. 32, n. 8, 2009.
MELLO JÚNIOR, C. A. R. Esterificação Catalítica e Não-Catalítica para Síntese do Biodiesel em Reator Microondas. Dissertação (Pós-Graduação em Engenharia de Processos), Universidade Tiradentes, Aracajú, 2008.
NASCIMENTO, E. S. P.; CARDOSO, D. R.; FRANCO, D. W.; Comparação de Técnicas de Determinação de Ésteres em Cachaça. Química Nova. v. 32, n. 9, 2009.
OLIVEIRA, D.; et al.; Influência das Variáveis de Processo na Alcoólise Enzimática de Óleo de Mamona. Ciência e Tecnologia de Alimentos de Campinas. v. 24, n. 2, 178-182, 2004.
OLIVEIRA P. C.; ALVES G. M.; CASTRO, H. F.; Síntese do Butirato de N-Butila Empregando Lípase Microbiana Imobilizada em Copolímero de Estireno-Divinilbenzeno. Química Nova. v. 23, n. 5, 2000.
PAULA, A. V. P.; BARBOZA, J. C. S.; CASTRO, H. F.; Estudo da Influência do Solvente, Carboidrato e Ácido Graxo na Síntese Enzimática de Açucares. Química Nova. v. 28, n.5, 2005.
ROSINE, F.; NASCIMENTO C. C.; NÓBREGA, J. A.; Experimentos Didáticos Envolvendo Radiação Microondas. Química Nova. v. 27, n. 6, 2004.
SANSEVERINO, A. M.; Microondas em Síntese Orgânica. Química Nova. v. 25, n. 4, 2002.
SILVA, N. S.; et al.; Aproveitamento de Co-produtos da Cadeia Produtiva do Biodiesel de Mamona. Exacta. São Paulo, v. 8, n. 3, 2010.
SILVA, S. C.; FERREIRA, V. F.; SOUZA, M. C. B. V.; Adaptação de Forno Microondas Doméstico para Realizações de Reação de Transesterificação Sob Refluxo e Catálise por Argilas. Química Nova. v. 29, n. 2, 2006.
SIMÕES, D. R. S.; >WASZCZYNSKYJ, N.; WOSIACKI, G.; Aromas em Maçã, Suco e Sidra: Revisão. Boletim do CEPPA. v. 27, n. 1, 2009.
SKORONSKI, E.; Estudo Cinético da Síntese do Octanoato de n-Pentila Catalisada pela Enzima Lipozyme TL IM. Dissertação (Pós – Graduação em engenharia Química), Universidade Federa de Santa Catarina, Florianópolis, 2006.
SKORONSKI, E.; et al.; Estudo Cinético da Obtenção de Ésteres Utilizando Enzima Lipozyme TL IM como Catalisador. Ciência e Tecnologia de Alimentos de Campinas. v. 30 n. 4, 2010.
SOLOMONS, G.; FRYHLE, C. Química Orgânica. Rio de Janeiro: LTC, v. 2, 2002. p.88-105.
SUAREZ, P. A. Z.; et al.; Transformação de Triglicerídeos em Combustíveis, Materiais Polimétricos e Insumos Químicos: Algumas Aplicações da Catálise na Oleoquímica. Química Nova. v. 30, n. 3, 2007.
WATANABE, F. M. F.; OLIVEIRA, A. C. D.; RODRIGUES, M. L. F.; Biosíntese de Ésteres Através do Extrato Bruto Concentrado Contendo Lípase. XIV SEMINÁRIO DEPESQUISAS e XI SEMINÁRIO DE INICIAÇÃO CIENTÍFICA, 2010, Curitiba. Anais eletrônicos... Curitiba: UTP. Disponível em: http://www.utp.br/revista-ic-online/n_3_2011/resumos%202009-2010/res_8_amp_biossint.pdf>. Acesso em: 15 jun. 2011.
ZATTA, L.; Caulitina e Haoisita “In-Natuta” e Ativada Com Ácidos Minerais Como Catalisadores Heterogêneos Para Esterificação (M) Etílica de Ácidos Graxos. Pós-Graduação (Engenharia), Setor de Tecnologia da Universidade Federal do Paraná, Curitiba, 2010.
Publicado por: GLEIDSTON RAGNER PEREIRA DOS SANTOS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.