Sumário
1. RESUMO
A nitroglicerina foi descoberto pelo italiano Ascanio Sobrero, sendo utilizado de princípio como um medicamento para o coração para a doença chamada angina pectoris, doença cardíaca associada com um suprimento inadequado de sangue ao músculo cardíaco. A nitroglicerina sendo muito instavél e de difícil manuseio e transporte foi transformada em dinamite. A dinamite começou a ser muito utilizada como explosivo tanto em guerras como para industrias de demolição, assim como o explosivo tnt, que tem o grupo NO em comun com a nitroglicerina. Apesar das suspeitas do trinitrotolueno ser dado como canceríigeno nem um estudo ainda provou essa teoria.
Palavras chave:nitroglicerina, tnt, explosivo
2. Introdução
2.1. Breve histórico da nitroglicerina
A trinitroglicerina (mais conhecida como nitroglicerina) foi descoberta em fevereiro de 1847 pelo italiano Ascanio Sobrero. Inicialmente ela foi utilizada, em pequenas doses, como medicamento, para angina, devido sua propriedade de provocar a dilatação dos vasos sangüíneos. O uso industrial da nitroglicerina sempre esteve baseado na sua grande capacidade explosiva. [1]. A figura 1 mostra a estrutura da nitroglicerina.
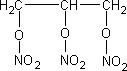
Figura 1: estrutura química da nitroglicerina
A nitroglicerina é um líquido oleoso de cor amarelo-pálida. É altamente sensível ao choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. A equação química abaixo representa essa reação.
4C3H5N309 (l) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2(g) [2].
Os valores de entalpias de ligação das moléculas de N2 (941 KJ/mol), de CO2 (1598 KJ/mol), de H2O (926 KJ/mol) fazem com que essa reação seja extremamente exotérmica. [2]. Para que a nitroglicerina seja mais segura de manusear, é usualmente transformada em dinamite. [5].
Assim devido as suas características, no presente trabalho será estudado a instabilidade do TNT, sua toxicidade, seu manuseio na indústria, e algumas aplicações, como por exemplo, na medicina.
3. Objetivo
Estudar a instabilidade da nitroglicerina e suas aplicações na medicina e como explosivo.
4. Desenvolvimento
4.1. Produção industrial
A nitroglicerina foi o primeiro alto- explosivo a ser empregado em grande escala. A nitração é efetuada lentamente pela adição de glicerina muito pura (99,9% ou mais) a uma mistura com composição aproximada ácido sulfúrico, 59,5%; ácido nítrico. 40%; e água 0,5%.
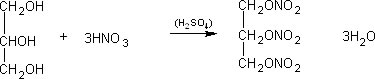
O mecanismo de reação que ocorre na fabricação da nitroglicerina é um mecanismo de reação por substituição (SN1) já que a glicerina é um álcool secundário. Um álcool é capaz de sofrer uma reação de substituição nucleofílica se o seu grupo OH for convertido em uma base mais fraca (melhor grupo de saída), e isso pode ser feito por meio de sua protonação. A protonação transforma o grupo de partida OH- (em uma base forte) em uma molécula de água (uma base fraca), a qual é suficientemente fraca para ser deslocada por um nucleófilo. A reação de substituição é lenta e requer aquecimento para ocorrer em período de tempo razoável. O intermediário carbocátion formado na reação SN1 tem dois destinos possíveis: pode combinar-se com um nucleófilo e formar um produto de substituição ou perder um próton e formar um produto de eliminação. Porém somente o produto de substituição é realmente obtido. O par de elétrons do átomo de oxigênio na molécula de glicerina vai se ligar com o hidrogênio do acido nítrico, rompendo assim a ligação entre eles. Na molécula de glicerina se forma um cabocátion onde haverá dois caminhos. No primeiro a glicerina reage com a água e com o nucleófilo (NO3-) formando o produto de substituição que é a nitroglicerina. No segundo caminho, ocorre um rearranjo na molécula de glicerina tornando mais estável e formando assim o produto de eliminação. [11]
A figura 2 mostra o processo de produção da dinamite e da nitroglicerina. A nitração completa-se em 60 a 90 min., em nitradores com agitação, equipados com serpentinas e aço de arrefecimento, cujo fluído é uma salmora a 5ºC, para manter a temperatura abaixo de 10ºC. Depois da nitração, a mistura da nitroglicerina e do ácido usado escoa, por uma calha (que é mais fácil de limpar do que um tubo), para tanques de separação e sedimentação, a uma certa distância do nitrador. A nitroglicerina é cuidadosamente separada do ácido e vai para um tanque de lavagem, onde é lavada duas vezes com água quente e com uma solução de carbonato de sódio a 2%, para assegurar a completa remoção do ácido residual. As lavagens continuam com água quente até que não haja traço de alcalinidade. Para tornar a nitroglicerina mais fácil e mais segura de manusear, ela é usualmente transformada em dinamite,para isso a nitroglicerina é enviada para misturadores. A produção de dinamites modernas usa, em geral, serragem, nitrato de amônio ou nitrato de sódio como agente de absorção da nitroglicerina, onde se adiciona um oxidante, nitrato de sódio. Antes de chegar ao misturador são adicionados serragem, carvão, NaNO2, enxofre (ingredientes de carga inerte), os quais são transferidos para o secador e posteriormente é misturados a nitroglicerina. A mistura é peneirada e em seguida é encaminhada para os dois processos subseqüentes: fabricação da dinamite gelatinosa, que recebe algodão pólvora; e a dinamite normal que não recebe mais nenhum aditivo. Os processos seguintes são referentes ao encartuchamento, os quais são feitos de papel com posteriores embalagens dos cartuchos de dinamite. Os ácidos usados na formação da nitroglicerina são reciclados, eles passam por um tanque de decantação e depois são recuperados. O ácido nítrico é enviado a um reator NH4NO3 depois passa por um cristalizador pronto para ser usado na fabricação da dinamite. Em um tanque que contem amônia, ela é fornecida para o reator e serve para ser transformada em ácido nítrico onde vai ser utilizado no inicio da fabricação da nitroglicerina. Os nitradores em aço inoxidável, agitados, pequenos e de operação contínua propiciam maiores rendimentos, menores custos operacionais e segurança maior que a do processo descontínuo. A figura abaixo mostra o fluxograma da produção industrial da nitrolicerina. A figura 2 apresenta o fluxograma de produção da nitroglicerina e da dinamite. [5].
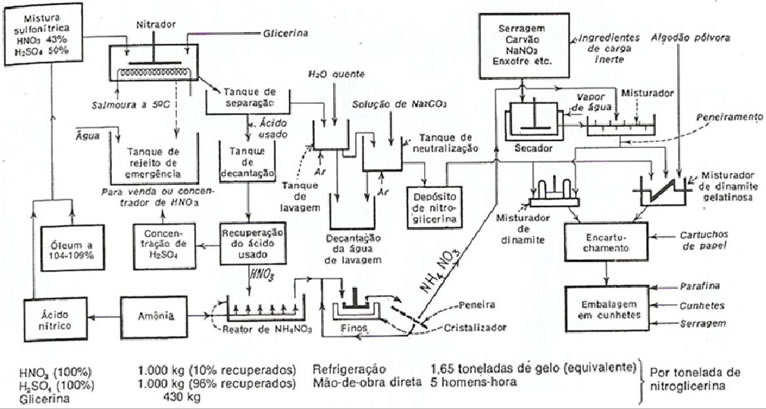
Fig. 2 fluxograma da fabricação da nitroglicerina e dinamites.
5. Aplicações
5.1. Em medicina
A angina pectoris é uma doença cardíaca associada com um suprimento inadequado de sangue ao músculo cardíaco. Durante um ataque de angina, o paciente sofre dores fortes do peito e nos braços. Pode-se obter alivio em questão de minutos, colocando-se 0,4 mg de um tablete de nitroglicerina sob a língua. A nitroglicerina, assim como outros nitritos e nitratos, relaxa os músculos das coronárias e produz um aumento no fluxo de sangue. [3]
A quebra de nitroglicerina produz óxido nítrico, que relaxa os músculos lisos e, assim, causa venodilatação em todo o corpo. Isso reduz a pressão arterial e permite que o sangue se acumule nas veias. [4].
A reação que converte arginina em NO e em citrulina é catalisado pelo óxido nítrico sintase (NOS):
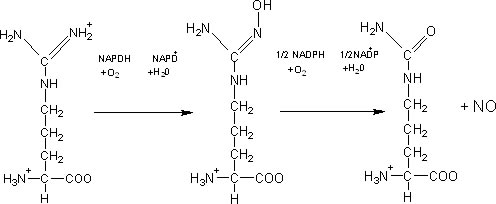
L-arginina L-hidroxiargina L-citrulina
[8].
A reação procede via um intermediário hidroxiarginina que é ligado à enzima e requer um grama de coenzimas redox. Uma vez que o óxido nítrico é um gás, ele é rapidamente difundido pela membrana da célula, embora sua alta reatividade evite que ele atue além de 1 mm de seu sítio de síntese. O NO é produzido por células endoteliais em resposta a uma grande variedade de agentes e de condições fisiológicas. As células nervosas também sintetizam NO. A síntese de NOS independe do endotélio dilata as artérias do cérebro e outras. O cérebro contém mais NOS do que qualquer outro tecido do corpo, sugerindo que o NO seja essencial para o funcionamento do sistema nervoso central. Um terceiro tipo de NOS é encontrado nos leucócitos. [8].
5.2. Como explosivo
Quantidades enormes de energia podem ser armazenadas em ligações químicas. Talvez a ilustração mais vívida desse fato seja em vista certas substâncias moleculares usadas como explosivos. As entalpias de ligação nos permitem examinar mais atentamente algumas das propriedades dessas substâncias explosivas. Um explosivo deve ter as seguintes características: (1) deve se decompor exotermicamente; (2) os produtos de sua decomposição têm de ser gasosos, para que uma enorme pressão de gás acompanhe a decomposição; (3) sua decomposição deve ocorrer muito rapidamente; e (4) ele deve ser estável o suficiente para que possa ser detonado com previsibilidade. A combinação dos três primeiros efeitos leva à violenta evolução de calor e gases. Para apresentar a reação mais exotérmica, um explosivo deve ter ligações químicas fracas e deve decompor-se em moléculas com ligações muito fortes. As entalpias de ligação mais fortes são encontradas nas ligações entre nitrogênio - nitrogênio, carbono-oxigênio. Não causa surpresa o fato de que os explosivos são normalmente projetados para compor os produtos gasosos N2(g), CO2(g) e CO(g). Vapor de água é também quase sempre produzido. Muitos explosivos comuns são moléculas orgânicas que contêm grupo nitro (NO2) ou nitrato (NO3) ligados a um esqueleto de carbono, como a nitroglicerina e o TNT. [2].
Para tornar a nitroglicerina mais fácil e mais segura de manusear, ela é usualmente transformada em dinamite. A dinamite fabricou-se, originalmente, pela absorção de nitroglicerina em terra de infusórios. As dinamites modernas usam, em geral, serragem, nitrato de amônio ou nitrato de sódio como o agente de absorção da nitroglicerina, a que se adiciona um oxidante. Essa mistura é fácil de manipular e pode conter até 75% de nitroglicerina e ainda reter o sólido. [5].
6. Características do TNT
A molécula de trinitrotolueno é uma molécula de tolueno a qual foram ligados três grupos nitro (-NO2). O trinitrotolueno é o potente explosivo TNT.A figura 3 mostra a estrutura do TNT.
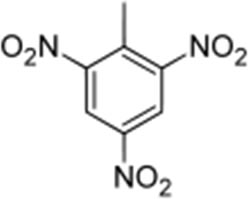
Fig.3 Estrutura química do TNT
É explosivamente instável, pois possui ligações químicas muito fracas, ao aquecer o TNT essas ligações se rompem, principalmente porque as ligações dos átomos de nitrogênio de sua estrutura tendem a se soltar dos átomos de oxigênio, o átomo de oxigênio tende a ligar com o anel benzênico deixando o átomo de nitrogênio livre para se reagrupar, liberando assim muita energia e formando os gases de dióxido de carbono, monóxido de carbono e água. Num instante, portanto, a molécula compacta pode ser convertida numa volumosa nuvem de gás, e a onde de pressão dessa expansão constitui o choque destrutivo da explosão. [6].
A Decomposição de TNT durante a detonação depende de uma série de fatores. Pode ser representado pela seguinte equação:
16C7H5(NO2)3 = 20CO2 + 47CO + CH4 + H2O + 2C2H2 + 2HCN + 14.5 H2 + 21.5 N2 + 3NH4HCO + 29C .[7].
Sendo que o calor da explosão do TNT é de 950 kcal/kg, o volume dos gases Vo = 690 l/kg, a temperatura t = 2820 ºC. [7].
6.1. Toxicidade do a- trinitrotolueno
Há uma considerável diversidade de opinião quanto à toxicidade de trinitrotolueno.Na Alemanha, a substância é considerada completamente ou quase completamente não tóxica, enquanto na Grã-Bretanha é considerada como um material altamente tóxico. Em uma das fábricas de munições, nos Estados Unidos, 17.000 casos de intoxicação, 475, incluindo casos fatais, ocorreram durante os primeiros sete meses e meio da 1ª Guerra Mundial. Eles deviam ser causados pela TNT como este foi um período de produção apressada de munição. Durante os 20 meses que se seguiram, o número de casos de intoxicação caiu para 7.000, incluindo 105 casos fatais. [7].
Quando a pessoa tem contato da pele com o TNT por um longo período, pode desenvolver uma reação alérgica na pele como coceira e irritação ou catarata nos olhos. Não existe informação para mostrar se o TNT provoca defeitos congênitos. Os animais que foram alimentados ou respiravam TNT também tinha doenças do sangue e hepáticos. Os machos expostos a níveis altos de TNT tinham sérios problemas reprodutivos. Os animais com TNT de 15 a 364 dias podem ter aumento do baço. Eles também podem ter efeitos nocivos sobre o sistema imunológico. Não está claro se o TNT provoca câncer nos seres-humanos. Os ratos que comeram TNT por longos períodos desenvolveram tumores na bexiga. Portanto o TNT é considerado como possível agente cancerígeno em humanos. [10].
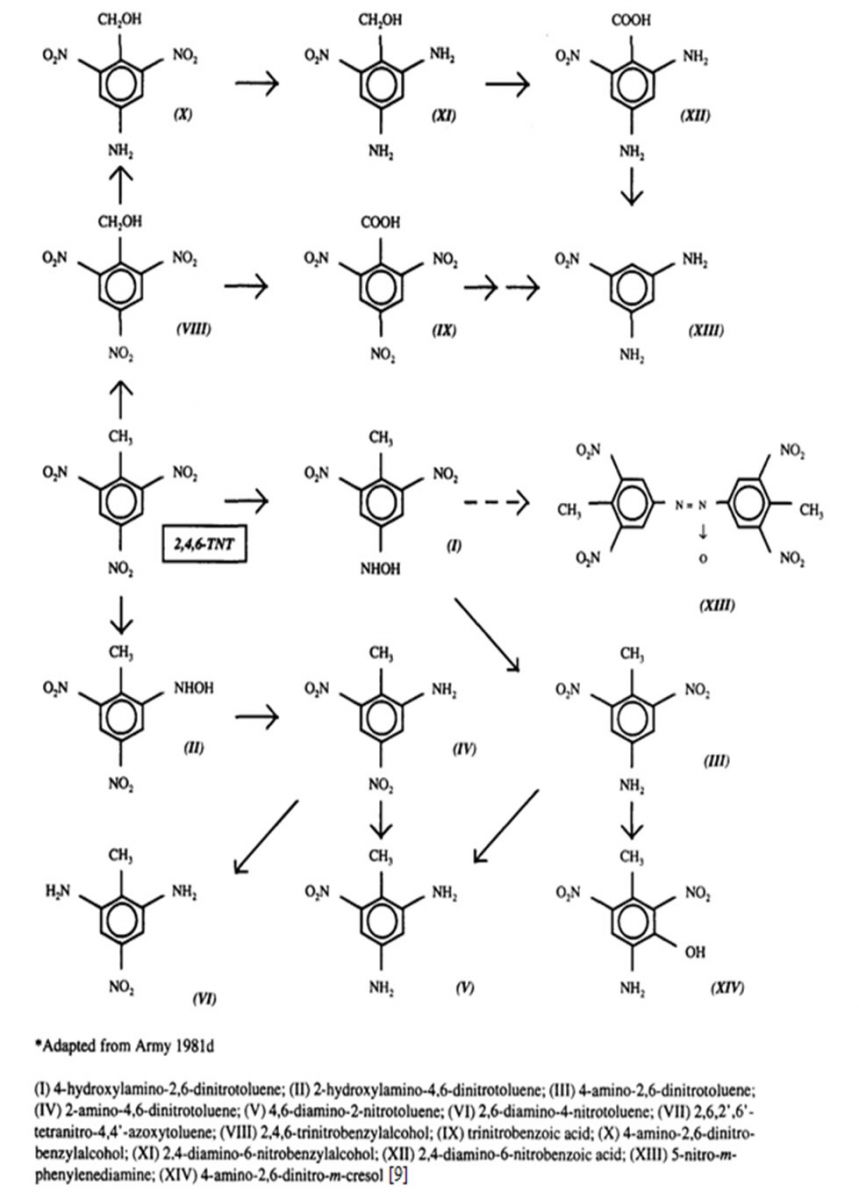
Quase sem exceção, os nitrocompostos e os ésteres do acido nítrico, usados como explosivos, são tóxicos. O grau de toxidez varia amplamente com a substância, embora a maior parte seja capaz de provocar envenenamento agudo, se for tomada oralmente. [5]. Não foram localizados estudos que visam especificamente o metabolismo após a exposição oral de 2,4,6-trinitrotolueno em seres humanos. A molécula de 2,4,6-trinitrotolueno pode sofrer várias transformações metabólicas, como a oxidação do grupo metil, a oxidação do anel de benzeno, a redução dos três grupos nitro, e conjugação.
A figura 4 mostra a possível biotransformação do 2,4,6-trinittotolueno.[9].
6.2. TNT no meio ambiente
O 2,4,6-trinitrotolueno entra no meio ambiente por águas residuais e resíduos sólidos resultantes da fabricação do composto, processamento e destruição de granadas e bombas, bem como a reciclagem de explosivos. O composto move na superfície da água e através dos solos para águas subterrâneas. Na superfície da água o 2,4,6-trinitrotolueno é rapidamente decomposto em outros composto químicos pela luz solar. A fotólise do 2,4,6-trinitrotolueno em soluções aquosas é um fenômeno bem conhecido, que é responsável pelo desenvolvimento de "água-de-rosa", e é provavelmente o processo de destino mais importante para o 2,4,6 trinitrotolueno em sistemas aquosos . Em estudos de laboratório com água destilada, a taxa de aumentos de transformação ao longo do tempo, uma vez que a fotólise também é promovida pela presença de produtos da fotodecomposição no meio aquoso. O 2,4,6-trinitrotolueno pode ser mais persistentes em corpos d'água profunda em repouso ou outros sistemas de água onde a luz solar é diminuida. Um número de produtos da fotodecomposição do 2,4,6-trinitrotolueno foram identificados, incluindodinitroantrila,trinitrobenzaldeido, álcool trinitrobezilico, trinitrobenzeno, nitroanilinas,condensado e derivados azo e azoxy e 1,3,5 trinitrobenzeno. Recentemente, um produto de degradação profunda vermelho-acastanhada 2,4,6-trinitrotolueno de Mycobacterium cultivada em condições aeróbias foi identificada . [9].
Tabela 1: compostos químicos encontrado na fotodecomposição do 2,4,6- trinitrololueno.[9]
|
Azo |
R-N=N-R’ |
|
Azoxy |
|
|
Trinitrobenzeno |
|
|
Nitroanilina |
7. Conclusão
A nitroglicerina é um composto altamente instável empregado nas indústrias farmacêuticas e de explosivos. Muito utilizado como explosivo, a dinamite é um explosivo de fácil manuseio e de orçamento baixo, o TNT estudado neste trabalho, tem somente o grupo nitrato em comum com a dinamite, sendo assim é um alto explosivo devido à sua instabilidade, é também muito utilizado em construções e demolições. É considerado um composto possivelmente cancerígeno ao ser humano devido à presença do tolueno em sua estrutura.
8. Bibliografia
[1] Covre. G.J; Química: o homem e a natureza; editora FTD; ed. 1ª; 2000;
[2] Brown T. L; LeMay. H.E, Bursten, B.E; Química a ciência central, 9ª edição, Ed. pearson, São Paulo, 2005.
[3] Allinger, N. L., Cava. M. P., De jongh. D. C., Lebel. N. A., Stevens. C. L., Química orgânica, 2ª edição, Ed. LTC, 1976.
[4] Dvlin, T. M., Manual de bioquímica com correlações clinicas, 6ª edição, editora blücher, São Paulo, 2006.
[5] Shreve, R. N; Brink Jr., J. A; Indústria de processos químicos, 4ª edição, Ed. Guanabara, Rio de Janeiro, 1997.
[6] Atkins, P. W., Moléculas, Edusp, São Paulo, 2000.
[7] Urbanski. T., Chemistry and technology of explosives vol. 1, 1964.
[8] Voet. D., Voet. J. G., Pratt. C. W., Fundamentos de bioquímica, 1ª edição, Ed. artmed, Porto alegre, 2006.
[9] Agency for Toxic Substances and Disease Registry (ATSDR). 1995. Toxicological profile for 2,4,6-trinitrotoluene (TNT). Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service. . Acesso em 1 de setembro de 2010.
[10] Acesso em 1 de setembro de 2010.
[11] Bruice, P. Y; Química orgânica , 4ª edição, volume 1, Ed. Pearson, São Paulo, 2006.