IMPACTO DE DIFERENTES NEUROHORMÔNIOS NA ATIVAÇÃO DE LINFÓCITOS T DE INDIVÍDUOS NORMAIS E ANSIOSOS
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. O sistema neuroimunoendócrino
- 3.1 Ativação e diferenciação dos linfócitos T
- 3.2 O sistema límbico em foco
- 3.3 A ação imunomoduladora dos neuropeptídeos e dos hormônios hipofisários e adrenais
- 3.4 Tipos de neurotransmissores
- 3.4.1 Aminas biogênicas:
- 3.4.2 Dopamina:
- 3.4.3 Recepotores da dopamina:
- 3.4.4 Noradrenalina:
- 3.4.5 Receptores noradrenérgicos:
- 3.4.6 Neuromoduladores:
- 3.4.7 Peptídeos:
- 3.4.8 Substância P:
- 3.4.9 Neurohormônios:
- 3.4.10 Hidrocortisona:
- 4. Hipótese
- 5. Objetivos
- 6. METODOLOGIA
- 6.1 Diagnóstico de Ansiedade
- 6.2 Avaliação do estado imune geral e da ocorrência de desordens inflamatórias imunomediadas
- 6.3 Obtenção das células mononucleares do sangue periférico
- 6.4 Ativação dos linfócitos T
- 6.5 Teste de viabilidade celular
- 6.6 Análise estatística
- 7. RESULTADOS
- 8. DISCUSSÃO
- 9. CONCLUSÃO
- 10. REFERÊNCIAS
- 11. ANEXO
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
Os transtornos psiquiátricos abrangem uma ampla faixa de afecções caracterizadas por padrões de comportamento anormal e sinais e sintomas psicológicos que resultam em disfunções orgânicas, dentre elas deficiências do sistema imune. Os distúrbios de ansiedade, por exemplo, são considerados os mais prevalentes em termos de doença psiquiátrica, acometendo aproximadamente 15 a 20% de pacientes ambulatoriais. São classificados em transtorno do pânico, ansiedade generalizada, fobias e transtorno de estresse pós-traumático. Esses distúrbios afastam muitas vezes o indivíduo do convívio social, limitam sua capacidade produtiva e resultam em perdas importantes, muitas das quais atreladas a doenças relacionadas a distúrbios das células de defesa.
Indivíduos ansiosos têm maior percepção do estresse e menor capacidade de adaptação ao mesmo. Nesse sentido, durante situações aonde o individuo se sente ameaçado, a natureza aperfeiçoou mecanismos de resposta que são a fim de prepará-lo para luta ou fuga. Assim, quando diante de uma situação de estresse biológico, seja uma infecção ou trauma, são ativadas respostas orgânicas de adaptação, como eixo Hipotálamo-pituitária-adrenal (HPA), cujo produto final, é a produção de níveis elevados de noradrenalina e cortisol. Outros mediadores menos diretamente relacionados ao estresse podem ter a sua produção elevada na periferia, tais como a dopamina e a substância P. Entretanto, uma ativação crônica e inadequada desses circuitos biológicos, como descrito em pacientes ansiosos, está atrelada a efeitos deletérios sobre a saúde do indivíduo.
Como a saúde esta diretamente relacionada à capacidade das células do sistema imune de interpretar e responder de maneira adequada aos estímulos que ameaçam a saúde do homem, e sabendo que as células de defesa expressam receptores para os mais diferentes neurohormônios relacionados ao estresse, o objetivo de nosso trabalho foi avaliar o impacto de alguns mediadores do estresse sobre a ativação dos linfócitos T, as células mais importantes do nosso sistema de defesa. Para tanto, nós avaliamos a ativação das células T de indivíduos normais (grupo controle) ou ansiosos por 03 dias na presença ou ausência de doses de relacionadas ao estresse de noradrenalina, cortisol, substância P e dopamina. Para ativar as células T doses mitogênicas de fitohemaglutinina A (PHA) foram usadas. Nossos resultados revelaram que, diferentes do grupo controle, as células T de indivíduos ansiosos apresentaram um estado elevado de ativação na ausência de qualquer estímulo exógeno. Interessantemente, a adição de um ativador policlonal de células T não aumentou e até tendenciou a reduzir o nível de ativação linfocitária. Nesse sistema, adição dos neurotransmissores ou do cortisol diminui a capacidade dos linfócitos T em responder a PHA. Efeito mais dramático no status de ativação das células T foi observado quando todos os neurohormônios foram adicionados às culturas de células de indivíduos ansiosos. Nesse contexto, ensaios da viabilidade celular revelaram que essas células não apenas diminuíam seu potencial de responder ao PHA como, em sua maioria, morreram por apoptose.
Apesar de preliminares, nossos dados sugerem novos mecanismos relacionados à baixa do sistema defesa envolvendo situações de estresse biológico, assim como sugere que os efeitos deletérios são mais severos em indivíduos ansiosos.
Palavras-chave: ansiedade, psiquiatria, neurohormônios, imunologia, neurotransmissores
Abstract
Psychiatric disorders cover a wide range of diseases characterized by abnormal patterns of behavior and psychological signs and symptoms that result in organ dysfunction, among them immune system deficiencies. Anxiety disorders, for example, are considered the most prevalent in terms of psychiatric illness, affecting approximately 15 to 20% of outpatients. They are classified as panic disorder, generalized anxiety, phobias and posttraumatic stress disorder. These disorders often isolates the individual from society, restricting its production capacity and results in significant losses, many of them tied to diseases related to disorders of immune cells.
Anxious individuals have a higher perception of stress and less ability to adapt to it. Accordingly, in situations where the individual feels threatened, nature has perfected response mechanisms wuch prepares you for fight or flight. So, when faced with a situation of biological stress, being an infection or trauma, organic responses are activated , such as the hypothalamic-pituitary-adrenal (HPA), whose final product is the production of high levels of norepinephrine and cortisol. Other mediators less directly related to stress may have its production elevated in the periphery, such as dopamine and substance P. However, a chronic and inappropriate activation of these biological circuits, as described in anxious patients is linked to deleterious effects on the health of the individual.
Considering that health is directly related to the ability of immune cells to interpret and respond appropriately to stimuli that threaten human health, and knowing that the defense cells express receptors for many different stress-related neurohormones, the goal of our study was to evaluate the impact of some stress mediators on the activation of T lymphocytes, the cells of our most important defense system. Therefore, we evaluated the activation of T cells from normal individuals (control group) or anxious individuals for to 03 days in the presence or absence of dose-related stress, norepinephrine, cortisol, substance P and dopamine. To activate the T cell mitogenic doses of phytohemaglutinin A (PHA) were used. Our results revealed that, different from the control group, the T cells of anxious individuals showed a high state of activation in the absence of any exogenous stimulus. Interestingly, the addition of a polyclonal activator of T cells did not increase and even showed a tendency of reduction of the level of lymphocyte activation. In this system, addition of the neurotransmitters or cortisol decreases the ability of T lymphocytes to respond to PHA. An even more dramatic effect on the activation status of T cells was observed when all neurohormones were added to cell cultures of anxious individuals. In this context, cell viability tests revealed that these cells not only decreased their potential to respond to PHA, but also, most of the times, died by apoptosis.
Although preliminary, our data suggests new mechanisms related to a low defense system involving situations of biological stress, and suggests that the deleterious effects are more severe in anxious individuals.
Palavras-chave: anxiety, psychiatry, immunology, neurotransmitters, neurohormones
2. INTRODUÇÃO
A saúde deve ser vista como a capacidade do organismo em regular sua fisiologia diante de estímulos que ameaçam sua vida. Nesse contexto, o Sistema Imune (SI) exerce um papel capital, através das interações formadas por circuitos celulares e bioquímicos, constituindo um verdadeiro órgão sensorial, já que somos incapazes de perceber microorganismos pelos sentidos originais. Ele nos fornece a capacidade de interpretar estímulos estranhos (antígenos), através de mecanismos biológicos responsivos á liberação de citocinas.
As citocinas são proteínas, ou glicoproteínas, produzidas principalmente pelas células do sistema imune, e constituem um circuito bioquímico utilizado para ativar e controlar as reações imunológicas, bem como para enviar sinais a outros órgãos e sistemas que cooperam nos eventos imunes. Enquanto algumas destas representam a primeira resposta do organismo diante de uma ameaça, outras são mais importantes na fase tardia da resposta imune adaptativa.
Muitos trabalhos sugerem que é através das citocinas que o SI exerce seus efeitos sobre fatores psiconeuroendócrinos. Portanto, é através da secreção coordenada não apenas de citocinas, como também de neuropeptídios e hormônios que a integridade do organismo, frente a diversos desafios, é mantida. O grande gerenciador dessa relação neuroimunoendócrina é o eixo hipotálamo-pituitária-adrenal, ou eixo HPA. Uma hiperatividade do eixo HPA, como observados nos transtornos psiquiátricos, torna indivíduos mais suscetíveis a diferentes condições patológicas, como a doenças infecciosas por baixa da imunidade. Ao mesmo tempo, como todo o circuito de ação e reação, qualquer interferência inadequada do SI sobre o Sistema Nervoso Central (SNC) pode estar atrelada a diferentes psicoses.
3. O sistema neuroimunoendócrino
3.1. Ativação e diferenciação dos linfócitos T
A defesa do organismo contra microrganismos patogênicos e controle de neoplasias é mediada por eventos celulares e moleculares pertencentes a dois diferentes ramos do Sistema Imune (SI): a imunidade natural e a adaptativa. Enquanto as células da imunidade natural, como os macrófagos, são fundamentais como primeira linha de combate a microorganismos patogênicos, a população celular do ramo adquirido, os linfócitos B e T (TCD4+ e TCD8+), realizam o controle final dos agentes infecciosos e das células próprias transformadas por, dentre outras funções, amplificarem a função das células da imunidade natural.
Na hierarquia das funções imunes, os linfócitos T CD4+ ocupam uma posição de destaque por regular a função de todas as células da imunidade natural, tais como macrófagos e neutrófilos, bem como as outras células da imunidade adquirida, os linfócitos T CD8+ e células B. Apesar da participação majoritária das células T CD4+ nas fases eferentes da resposta imune, a indução e o estabelecimento da resposta imune primária específica mediada por estes linfócitos são dependentes das células apresentadoras de antígeno (APC), particularmente das células dendríticas.
As células dendríticas (CDs) surgem de precursores da medula-óssea e colonizam diferentes órgãos e tecidos.
Seguindo os eventos iniciais da resposta imune mediada pelas células da imunidade natural no local de infecção, e sob a ação de diferentes estímulos inflamatórios, as CDs adquirem mobilidade e se direcionam para os gânglios linfáticos regionais, onde irão iniciar a ativação dos linfócitos T. Durante sua trajetória, as CDs maduras tornam-se, através da expressão de diferentes moléculas de superfície, extremamente eficientes em apresentar diferentes antígenos para os linfócitos T.
Uma eficiente ativação primária das células T CD4+ depende de diferentes sinais cognitivos e solúveis acionados pelas CDs maduras durante a sinapse imunológica nos órgãos linfóides secundários. O primeiro sinal fornecido CDs é a apresentação de peptídeos antigênicos acoplados às moléculas de MHC de classe II. Essa fase da resposta imune é fundamental, pois permite o reconhecimento, por parte dos linfócitos T CD4+ específicos, de peptídeos antigênicos. Entretanto, uma ativação eficiente dos linfócitos T CD4+ contra seus alvos requer que as CDs maduras enviem um segundo sinal que é inespecífico ao tipo de antígeno. Esse segundo sinal é mediado por pares de moléculas co-estimuladoras, como por exemplo, moléculas pertencentes aos membros da família B7 (CD80 e CD86) expressos na superfície das CDs que se ligam as moléculas do CD28 dos linfócitos T CD4+. O engajamento desses dois sinais, primeiro e segundo, permite a produção de IL-2 pelas células T CD4+-antígenos específicas. A IL-2, conhecida também como fator de crescimento de células T, permite a proliferação de clones de linfócitos T CD4+.
Seguindo a ativação, um terceiro sinal, deflagrado principalmente por mediadores solúveis secretados pelas CDs, induz a diferenciação desses linfócitos TCD4+ clássicos em diferentes fenótipos que produzirem padrões polarizados de citocinas capazes de regular e coordenar uma variedade de respostas imunes. Vários fatores influenciam a diferenciação final de linfócitos TCD4+ ativados pelas CDs, mas citocinas e neurohormônios parecem ser imperativos no destino do fenótipo diferenciado.
Neste contexto, a ativação das células T CD4+ na presença de um excesso de IL-12 induz estes linfócitos a se diferenciarem no fenótipo Th1. Nesse sistema, a presença dos hormônios prolactina ou da diidroepiandrosterona potencializa a capacidade das CDs maduras em induzir células com fenótipo Th1 por amplificar a secreção de IL-12. Os linfócitos Th1, quando ativados, secretam grandes quantidades de IL-2 e IFN-g, e mediam uma resposta conhecida como imunidade celular, por envolver, majoritariamente, a ativação de fagócitos. O IFN-g aumenta não apenas o poder microbicida dos fagócitos humanos, por exemplo, macrófagos e neutrófilos, como também aumenta a função lítica das células NK e a produção de anticorpos IgG1 e IgG3 pelos linfócitos B. Os eventos envolvidos na resposta imune celular são fundamentais para controlar todos os microorganismos que causam infecções intracelulares (obrigatórios e facultativos).
O controle de infecções virais e do crescimento tumoral é efetuado pelos linfócitos T CD8+. As células T CD8+ clássicas periféricas reconhecem antígenos peptídicos apresentados na superfície da APCs, acoplados a moléculas de MHC de classe I. Quando ativados, esses linfócitos T são citotóxicos, adquirindo um poderoso arsenal de proteínas líticas, tais como as perforinas e as granzimas, capazes de eliminar células-alvo por apoptose. Estes linfócitos podem também exercer funções imunomoduladoras por secretar citocinas, preferencialmente, IFN-g. Portanto, pela tendência em potencializar as respostas Th1, estes linfócitos T citotóxicos são chamados de Tc-1. Vários estudos revelam que uma eficiente ativação e manutenção da memória em populações de linfócitos T CD8+ antígenos-específicas dependem de sinais oriundos das células T CD4+ ativadas pelas CDs maduras.
Na presença da IL-4 e/ou de prostaglandina E2 (PGE2), os linfócitos T CD4+ ativados se transformam em Th2 . A diferenciação celular em Th2 é favorecida pela presença de elevadas doses de cortisol e/ou catecolaminas, ambos capazes de atenuar a secreção de IL-12 pelas CDs. A resposta imune mediada pelos linfócitos Th2, também conhecida como resposta imune humoral, é determinada pela secreção elevada de citocinas como IL-4, IL-5, IL-6, e IL-13, e a via efetora final é ativação dos linfócitos B com produção de IgG4 e IgE. Enquanto a resposta imune celular é responsável pelo controle da maioria das infecções intracelulares, a imunidade mediada pelos linfócitos Th2 está mais envolvida no combate a infecções por helmintos e em reações alérgicas mediadas pela IgE. Uma regulação cruzada tem sido descrita na dicotomia Th1/Th2. Em muitos sistemas de ativação in vitro e in vivo, por exemplo, a diferenciação de células em Th1 regula negativamente uma resposta imune humoral. Vários trabalhos sugerem que o inverso é verdadeiro.
Mais recentemente, a secreção da IL-23 pelas CDs maduras tem sido implicada na indução de células Th17. Essas células TCD4+ secretam IL-17 que induz uma onda de citocinas inflamatórias e quimiocinas por diferentes tipos celulares que têm sido implicadas tanto na proteção contra diferentes bactérais e fungos como também na gênese de diferentes doenças auto-imunes.
3.2. O sistema límbico em foco
Todo o circuito neural que controla o comportamento emocional e os impulsos motivacionais é regulado por uma porção do SNC chamada de Sistema Límbico. Uma parte importante desse sistema é o hipotálamo, com suas estruturas relacionadas.
O hipotálamo tem vias de comunicação de mão dupla com todos os níveis do Sistema Límbico, controla a maioria das funções vegetativas, emocionais e endócrinas do corpo, bem como muitos dos aspectos da imunidade de um indivíduo. No contexto do eixo hipotálamo-pituitária-adrenal (HPA), o hipotálamo influencia eventos imunes por controlar as secreções endócrinas da porção anterior da hipófise.
A hipófise, também conhecida como pituitária, é histologicamente subdividida em duas regiões, a hipófise anterior e a hipófise posterior. A parte mais anterior, ou adenohipófise, é constituída de diferentes tipos celulares que, quando estimulados pelo hipotálamo, secretam diferentes hormônios tais como o hormônio de crescimento (GH), o hormônio adrenocorticotrófico (ACTH) e a prolactina (PRL).
A secreção do ACTH pela adenohipófise permite ativar o extremo do eixo HPA, que se refere à indução dos hormônios adrenocorticais pelas glândulas adrenais. Estas glândulas localizam-se adjacentes aos pólos superiores dos rins, e são histologicamente subdivididas em duas áreas, a medula e o córtex. A região medular está funcionalmente relacionada ao sistema nervoso simpático, produzindo epinefrina e norepinefrina em resposta a estimulação simpática. Já no córtex adrenal se processa a síntese dos glicocorticosteróides, dentre eles, majoritariamente, o cortisol.
3.3. A ação imunomoduladora dos neuropeptídeos e dos hormônios hipofisários e adrenais
Como mencionado anteriormente, não apenas as citocinas determinam os mecanismos efetores imunes como um número elevado de neuro-hormônios também pode influenciar positivamente ou negativamente vários eventos da imunidade. Enquanto os hormônios de crescimento (GH) e a prolactina (PRL) aumentam a resistência a infecções, por amplificar a resposta do tipo Th1, a secreção elevada do cortisol está associada à depressão da resposta imune celular. Uma deficiência funcional dos linfócitos Th1 irá interferir com a produção e ação dos anticorpos produzidos pelas células B.
Quanto aos neurotransmissores, às catecolaminas liberadas nos órgãos linfóides oriundas tanto das fibras nervosas simpáticas do SNC quantos das adrenais, agem sobre as células T e B modulando várias funções imunes. A produção crônica, ou de grande porte, de noradrenalina e adrenalina tem efeito deletério sobre eventos da imunidade celular, favorecendo ou exacerbando a produção de citocinas Th, particularmente IL-4 e IL-5. Acredita-se que muitos desses efeitos deletérios estejam relacionados à produção sustentada de cortisol, induzida pelas catecolaminas, característicos de pacientes com hiperatividade do eixo HPA, como observado em algumas patologias mentais. Ademais, no contexto da esquizofrenia, alguns trabalhos têm sugerido que a produção de níveis elevados de dopamina, uma catecolamina, está atretalada a anormalidades imunofuncionais nos pacientes durante a psicose.
3.4. Tipos de neurotransmissores
3.4.1. Aminas biogênicas:
Incluem as catecolaminas (noradrenalina e dopamina) e a serotonina. Cada um desses neurotransmisores é sintetizado em um núcleo distinto de neurônios, cujos axônios se projetam amplamente para todo o cérebro e para a medula. Exercem, portanto, uma influência desproporcional sobre a atividade do cérebro e são de importância central para o tratamento farmacológico de transtornos do pensamento, do humor e de ansiedade.
Embora esses compostos estejam presentes em quantidades muito pequenas no SNC, podem ser localizados com o uso de métodos histoquímicos extremamente sensíveis. Acredita-se que as drogas estimulantes do SNC, como a cocaína e anfetaminas, atuam principalmente nas sinapses catecolamínicas. A cocaína bloqueia a recaptação da dopamina e da noradrenalina e as anfetaminas induzem a liberação destes neurotransmissores pelas terminações pré-sinápticas.
A dopamina, a noradrenalina e a adrenalina são sintetizadas a partir de um mesmo aminoácido, a tirosina. O passo enzimático limitante para a taxa de síntese de qualquer catecolamina é catalisado pela tirosina quinase. Esta é uma fosfoproteína sujeita à regulação por uma série de proteinoquinases e fosfatases. Ela transforma a tirosina em 3,4-diidroxifenilalanina (dopa), que em seguida é transformada no seu produto ativo, a dopamina.
As ações da dopamina são determinadas por duas vias. A dopamina pode ser recaptada pelo neurônio e reciclada como neurotransmissor, via esta chamada de recaptação. Em segundo lugar, a dopamina pode ser metabolizada; duas enzimas são responsáveis por isso, a monoamino oxidase (MAO - localizada no terminal pré-sináptico) e de forma menos importante a catecol-O-metiltransferase (COMT – localizada no citoplasma da célula pós-sináptica e no meio extracelular). O metabólito principal da dopamina é o ácido homovanílico(HVA), que é dosável na urina, soro e líquor.
A noradrenalina é formada a partir da dopamina, convertida em nora pela ação da dopamina-β-hidroxilase, ocorrida dentro do neurônio que a utiliza como neurotransmissor(noradrenérgico). Nos neurônios que liberam adrenalina, a enzima letonalina-N-metiltransferase (PNMT) converte a noradrenalina em adrenalina. Como a dopamina, as duas rotas principais de desativação são a recaptação de volta para o neurônio pré-sináptico e o metabolismo pela MAO e COMT.
3.4.2. Dopamina:
As principais vias que contém dopamina são os tratos nigroestriatal, o mesolímbico e túbero-infundibular. O primeiro se projeta dos corpos celulares da substância negra para o corpo estriado, ambos núcleos da base. Esses complexos, junto com o globo pálido, formam os núcleos da base, integrantes do “sistema extrapiramidal” que é responsável pela modulação e controle dos movimentos (“iniciadores e terminadores dos movimentos”).
O disparo inibitório proveniente dos axônios dos núcleos da base seria responsável pelo freio permanente dos movimentos não desejados. A necessidade de realizar um movimento interromperia esse disparo tônico frenador e liberaria os comandos motores corticais para os ordenadores subcorticais. A substância negra mesencefálica secreta dopamina para o corpo estriado (formado pelos núcleos caudado e putame), gerando uma inibição de sua função, o corpo estriado por sua vez é responsável por liberar acetilcolina no córtex motor, o que inibe a sua atividade. Portanto a dopamina indiretamente estimula o córtex motor.
Isso explica porque em doenças como Parkinson, em que há degeneração da substância negra, o paciente se apresenta com hipertonia, bradicinesia , tremor de repouso e instabilidade da marcha. Os receptores D2 do núcleo caudado suprimem a atividade neste local, com a ausência de atividade do receptor (por falta de dopamina, por exemplo), ocorre um excesso de inibição provocada pelo caudado no córtex motor.
Num outro extremo, o excesso de dopamina remove a resposta inibitória, podendo dar origem atos motores estranhos, os tiques. O transtorno obsessivo compulsivo também foi relacionado com o excesso de receptores D2.
O trato mesolímbico-mesocortical se projeta de seus corpos celulares para a área tegmantal ventral(VTA), adjacente à substância negra, para a maioria das áreas do córtex cerebral e do sistema límbico. Portanto também está relacionado com as respostas emocionais e afetivas. Por ele se projetar para o sistema límbico e para o neocórtex, pode estar envolvido na intermediação de efeitos antipsicóticos dos medicamentos neurolépticos.
Os sistemas dopaminérgicos podem estar particularmente envolvidos no denominado sistema de recompensa ou procura de prazer pelo cérebro, o que explicaria o alto potencial de adicção da cocaína, já que esta é uma bloqueadora de recaptação de dopamina.
Por último, o trato túbero-infundibular se situa no núcleo arqueado da área periventricular do hipotálamo e se projetam para o infundíbulo e para a hipófise anterior. A dopamina atua como fator de liberação no trato, ao inibir a produção de prolactina da hipófise anterior. Isso é averiguado em pacientes que tomam antagonistas de receptores da dopamina, que se apresentam com níveis de prolactina aumentados.
A dopamina também está associada com a fisiopatologia da esquizofrenia. A hipótese de que o excesso de dopamina explicaria os sintomas da doença é atualmente o mais aceito. Essa teoria advém da observação de que medicamentos capazes de bloquear os receptores de dopamina têm atividade antipsicótica e aquelas com estímulo de sua atividade pode desencadear os sintomas (delírios e alucinações).
3.4.3. Recepotores da dopamina:
Existem 5 tipos de receptores de dopamina(D1 até D5), que podem ser divididos em dois grupos. No primeiro os receptores D1 e D5 estimulam a formação de cAMP através da ativação da proteína G estimulante. No segundo, os receptores D2, D3 e D4 inibem a formação e de cAMP pela ativação da proteína G inibidora.
O receptor D2 predomina no estriado (núcleo caudado e putame); o D3 fica centrado no núcleo accumbens, apesar de existir em outras regiões e o D4 está mais especificamente localizado no córtex frontal.
3.4.4. Noradrenalina:
A maior concentração de neurônios noradrenérgicos (e adrenérgicos) que se projetam para o cérebro está no compacto lócus ceruleus da ponte. Os axônios desses neurônios se projetam pelo feixe medial do cérebro anterior para o córtex cerebral, o sistema límbico, o tálamo e o hipotálamo. Apesar de diferenças consideráveis na densidade das fibras que inervam diversos locais, as regiões do SNC recebem, em sua maioria, uma estimulação noradrenérgica difusa.
Quando aplicada a neurônios, a noradrenalina tende a hiperpolarizá-los, aumentando a condutância de potássio em muitas regiões do SNC, ela intensifica a estimulação excitatória através de mecanismos diretos ou indiretos. O mecanismo indireto se dá por desinibição, neurônios de circuitos locais inibitórios são inibidos; o mecanismo direto ocorre por bloqueio de condutância do potássio, diminuindo a descarga neuronal. Dependendo do tipo de neurônio, esse efeito é mediado por receptores α1 ou β. A facilitação de transmissão sináptica excitatória está de acordo com muitos dos processos comportamentais que supostamente envolvem vias noradrenérgicas, como a atenção e a reatividade.
A noradrenalina também desempenha papel vital no sistema nervoso autônomo (SNA), as fibras pós-ganglionares simpáticas liberam, em sua maioria, noradrenalina, por isso se chamam de fibras adrenérgicas (em contrapartida da maioria das fibras pós-ganglionares parassimpáticas que são colinérgicas). Dentro desse sistema controla as funções vegetativas, involuntárias de diversos órgãos, por exemplo, relaxamento da bexiga, taquicardia, vasoconstricção periférica, midríase, sudorese, etc...
As aminas biogênicas podem estar envolvidas nos transtornos do humor, essa hipótese se baseia nas observações de que os antidepressivos tricíclicos e os inibidores da MAO são eficientes no alívio dos sintomas depressivos. A contribuição da noradrenalina para a fisiopatologia ainda não está bem esclarecida, no entanto modelos animais sugerem a existência de inter-relações com os neurônios serotoninérgicos na gênese dos sintomas depressivos.
3.4.5. Receptores noradrenérgicos:
Todos os subtipos de receptores noradrenérgicos são metabotrópicos; os dois grandes grupos de receptores são os α-adrenérgicos e os β-adrenérgicos. Os avanços da biologia molecular os subdividiram ainda em três tipos de receptores α1 e três tipos de α2 e um tipo de α3, além de três tipos de receptores β. Os receptores α parecem estar ligados ao sistema do metabolismo (turnover) do fosfoinositol, possivelmente inibindo a formação de cAMP, enquanto os receptores β parecem estimular sua produção. Os receptores β1 e β2 parecem regular a função de vários órgãos do corpo, em antagonismo como os receptores α. Estão expressos em adipócitos, e sua ativação por agonistas reduz a quantidade de gordura corporal, sendo alvo de terapia farmacológica antiobesidade.
3.4.6. Neuromoduladores:
Neuromoduladores são as substâncias químicas liberadas na fenda sináptica, cujas ações pós-sinápticas modulam e influenciam a ação mais rápida e eficiente dos neurotranmissores. A maioria deles age por segundos mensageiros (cAMP, proteína G), muitas vezes causando modificações metabólicas intracelulares sem gerar um potencial de ação, e sim alterações a longo prazo no desempenho funcional do neurônio. Dentre eles se destacam os peptídeos (gastrina, substância P, vasopresina, etc...), e até mesmo gases (óxido nítrico e monóxido de carbono).
3.4.7. Peptídeos:
Chegam a 300 os peptídeos que podem estar presentes no cérebro humano. Tratam-se de proteínas curtas, consistindo de menos de 100 aminoácidos. Os peptídeos são produzidos no corpo das células para a transcrição e a translação de mensagens genéticas; são armazenados nas vesículas sinápticas e liberados pelo terminal do axônio. Dentre eles se encontram a substância P, peptídeos opióides (encefalinas, endorfinas), colecisticinina, vasopresasina, etc...
Sua atividade é determinada pela ação de enzimas denominadas peptidases, que fazem clivagem de peptídeos entre resíduos específicos de aminoácidos. Os peptídeos estão sujeitos à diversos refinamentos além daqueles impostos aos demais neurotransmisores. O processamento diferencial do ácido ribonucléico (RNA) transcrito primeiro do ácido desoxirribonucléico (DNA) pode levar a diferentes RNA mensageiros. A maioria destes neurotransmissores na verdade codificam peptídeos mais longos (pré-hormônios), que são clivados no corpo celular em pró-hormônios. Durante seu transporte por vesículas até os terminais do axônio, eles são clivados para a forma final de peptídeo. Além disso, a maioria dos peptídeos coexiste nessas vesículas de armazenamento com outros neurotransmissores.
3.4.8. Substância P:
A substância P (SP) é contida em pequenos neurônios sensitivos primários não-mielinizados de medula espinhal e tronco encefálico, a partir dos quais é liberada causando um PEPS lento nos neurônios alvo. Ela é também o principal neuromodulador na maioria dos neurônios da via nigroestriatal. Algumas anormalidades da SP foram encontradas em pacientes com síndrome de Huntington, demência tipo Alzheimer e transtornos do humor.
Sabe-se que esta substância está associada de forma mais proeminente à intermediação da sensação de dor, principalmente na periferia. O glutamato, que é liberado junto com a SP dessas sinapses presumivelmente também exerce um papel na modulação da dor. Na periferia, ao ser liberado pelos neurônios da fibra sensitiva eferente da medula (tipo C), estimula os mastócitos a secretarem histamina e serotonina, substancias comprovadamente alogênicas. Essas por sua vez, também estimulam a manutenção da secreção de bradicinina e prostaglandinas que são secretadas em resposta, por exemplo, a uma lesão na pele. A SP também age nos vasos sanguíneos, gerando vasodilatação, eritema e calor na região.
3.4.9. Neurohormônios:
Um neurohormônio se distingue pelo fato de que é liberado na corrente sanguínea, e não no espaço extraneuronal do cérebro. Uma vez no sangue, pode então se difundir para o espaço estraneuronal e atuar sobre os neurônios. Um exemplo importante dessa classe é o cortisol (hidrocortisona).
3.4.10. Hidrocortisona:
A hidrocortisona, derivado do colesterol, exerce uma grande variedade de efeitos fisiológicos, incluindo regulação do metabolismo intermediário, função cardiovascular, crescimento e imunidade. Sua síntese e secreção estão estreitamente ligados ao SNC, que é muito sensível ao feedback negativo dos níveis circulantes de cortisol e glicocorticóides.
Os glicocorticóides, dentre eles o cortisol, exercem importantes efeitos no sistema nervoso central, que está em foco neste momento. A insuficiência supra-renal provoca uma acentuada redução no ritmo alfa do eletroencefalograma e está associada à depressão. Em quantidade aumentada, freqüentemente produzem distúrbios do comportamento em seres humanos; em princípio insônia e euforia e, posteriormente depressão. Além disso, cortisol e outros glicocorticóides em supradose (grandes doses) podem levar ao aumento da pressão intracraniana.
Adicionalmente, já foi constatado que os corticóides aumentam a amplitude e diminuem a latência dos potenciais de ação sinápticos. Principalmente nas interações multisinápticas da formação reticular ascendente (que regula o sono-vigília) e no hipotálamo. Esses achados condizem com a hipótese de que o cortisol aumenta a excitabilidade geral do SNC, e o faz principalmente por aumentar os potenciais excitatórios dos neurônios. Não há evidências conclusivas de que eles atuem diminuindo os potenciais inibitórios neuronais.
Apesar do maior impacto do estresse esteja relacionada a uma queda da resposta imune mediada pelos linfócitos Th1 e TCD8+, o estudo dos mecanismos envolvidos nessa baixa imunológica tem rendido resultados altamente contraditórios e pouco reproduzíveis, revelando a necessidade de mais estudos.
4. Hipótese
Acreditamos que os efeitos deletérios e duradouros dos neurohormônios/neurotransmissores produzidos durante o estresse estejam relacionados a desordens do humor, tal como ansiedade
5. Objetivos
1- Avaliar o nível de ativação dos linfócitos T de indivíduos normais e ansiosos na ausência ou na presença de ativador policlonal de linfócitos T, a fitohemaglutinina A (PHA);
2- Analisar o impacto de diferentes neurohormônios relacionados ao estresse sozinhos ou em combinação na ativação dos linfócitos T de indivíduos normais e ansiosos;
3- Avaliar o impacto dos neurohormônios na viabilidade das células T ativadas com PHA obtidas de indivíduos normais e ansiosos.
6. METODOLOGIA
6.1. Diagnóstico de Ansiedade
Antes de qualquer procedimento, para cada indivíduo foi apresentado a carta de aprovação do estudo pelo Comitê de Ética em Pesquisa, bem como o termo de consentimento livre e esclarecido que foi assinada pelo mesmo. Seguindo a aplicação de um questionário estruturado e validado (na íntegra no anexo) foram incluídos indivíduos que preenchessem os critérios de ansiedade. Como controle, um grupo de indivíduos saudáveis sem desordens emocionais de nenhuma natureza com idades e sexo compatíveis ao grupo de pacientes estudados foi incluído em nosso estudo. Em ambos os grupos foram excluídos indivíduos que apresentassem doenças crônicas ou que fizessem uso de drogas imunomoduladoras, tais como drogas ilícitas, glicocorticóides e contraceptivos orais. Também foram excluídos indivíduos tabagistas e com obesidade mórbida.
6.2. Avaliação do estado imune geral e da ocorrência de desordens inflamatórias imunomediadas
Para avaliar o status imune geral e obter informações sobre intercorrências imunopatológicas, como por exemplo, as ocorrências de doenças infecciosas, alérgicas e auto-imunes, um conjunto de perguntas foi incluída durante a aplicação do questionário para avaliar a escala de ansiedade.
6.3. Obtenção das células mononucleares do sangue periférico
Após consentimento oral e por escrito de cada indivíduo convidado a participar de nosso estudo, 20 mL de sangue periférico foram colhidos de cada indivíduo em seringa estéreis contendo heparina. Todas as coletas e experimentos foram realizados no laboratório de Imunofisiologia e Imunopatologia dos linfócitos T coordenado pela professora e orientadora do projeto, Dra. Cleonice Alves de Melo Bento. Para obter as células mononucleares do sangue periférico (CMSP) o sangue total foi obtido e processado como descrito em Schuleck e colaboradores. Resumidamente, o sangue total foi colocado, cuidadosamente, em um tubo falcon (50 mL) contendo 10 mL de Ficoll-Hypaque (d= 1.007 g/l). Os tudos então foram submetidos a uma centrifugação a 2000 rpm a temperatura ambiente. Após 20 minutos, os tubos foram removidos e as PBMC (ou CMSP) recuperadas com uso de pipetas Pasteur estéreis, na interface entre a salina e a solução de Ficoll. As células obtidas foram em seguidas submetidas a dois procedimentos de lavagem com solução de Hanks (Sigma, Co).
As CMSP purificadas foram contadas em solução de azul de trypan a 0.4% (v/v) e a quantidade de células viáveis foi ajustada para 0.5 x 106 /ml em meio RPMI completo. Esse meio completo é composto de meio de cultura RPMI 1640 suplementado com 50 U/ml de penicilina, 50 mg/ml de estreptomicina, 2 mM de L-glutamina, 10 mM de tampão HEPES. Para enriquecê-lo adicionamos soro fetal bovino previamente inativado pelo calor (56 0C/45 minutos) a 10 % (v/v). Finalmente, a suspensão celular foi ativada ou não com o mitógeno de células T, a fitohemaglutinina (PHA, Sigma Co) a 4 g/ml. Para avaliar o status de ativação dos linfócitos T as placas de cultura de células foram mantidas por 03 dias em atmosfera úmida a 37 0C/5 % CO2.
6.4. Ativação dos linfócitos T
Aproximadamente 0.5 x 105/poço de PBMC mantidas em placas de cultura de 96 poços de fundo chato foram ativadas com PHA (4 mg/ml) por 3 dias. Para avaliar o impacto dos diferentes neuromediadores e do cortisol sobre a ativação das células T, doses relacionados ao estresse de Noradrenalina (10-5 M), Substância P (10-5 M), Dopamina (5 x 10-5) e hidrocortisol (10-5) foram adicionados às culturas no tempo zero (início). Todos os reagentes foram obtidos a partir da Sigma Co. Após 3 dias de cultura, o nível de ativação celular in vitro na presença e na ausência dos neuromediadores e de cortisol foi medido através do ensaio colorimétrico MTT, como descrito previamente em Pauwels et al., 1988. Brevemente, 40 L de uma solução de 3-(4,5-dimetil-tiazol-2-il)-2,5-difeniltetrazolium (MTT) a 7,5 % foi adicionado 72 horas após o início da cultura. Em seguida, as placas foram incubadas a 370C por 2 horas a 5% de C02. Após a incubação, 150 L da cultura foram recolhidos e 100 L de uma solução de isopropanol contendo 2% de triton X-100 e 0,04% de ácido clorídrico foram adicionados. Para dissolver os cristais de formozan (produto do MTT reduzido pelas células ativadas), as culturas foram exaustivamente homogenizadas para romper as células e revelar o produto colorido. O nível de ativação foi lido num leitor de ELISA usando o filtro de 630 nm e os valores foram expressos como densidade óptica (D.O.).
6.5. Teste de viabilidade celular
Em diferentes tempos de cultura de CMSP, as células T ativadas com PHA foram ressuspendidas e imediatamente diluídas 1:2 (v/v) em solução de azul de trypan a 0.4% (v/v). Após 3 a 5 minutos de repouso na solução, o número de células totais e viáveis foi contado em microscópio óptico com o auxílio da objetiva de 100 x usando câmara de newbauer. Para avaliar a porcentagem de viabilidade celular a seguinte equação foi aplicada: VIABILIDADE CELULAR (%)= total de células viáveis total de células (viávies + não-viáveis) x 100.
6.6. Análise estatística
Todas as análises estatísticas foram conduzidas usando o programa de gráfico GraphPad Prism versão 4.0 para Windows (GraphPad). O teste U não-paramétrico de Mann-Whitney foi usado para determinar se as diferenças entre os grupos estudados foram significativas. Diferenças foram consideradas significativas quando o p < 0.05.
7. RESULTADOS
O objetivo primário de nosso estudo foi avaliar o impacto dos diferentes mediadores produzidos durante o estresse sobre a ativação dos linfócitos T de indivíduos normais e ansiosos. Para estabelecer o critério de ansiedade, os indivíduos responderam a várias perguntas durante a aplicação de um questionário estruturado. Para relacionar a ansiedade com alguns eventos adversos relacionados ao sistema imune, algumas perguntas foram acrescentadas ao questionário original. No total de 125 indivíduos adultos jovens (21-42 anos) entrevistados, 14 preencheram os critérios de ansiedade (11.2%). Para o nosso estudo sobre a ativação dos linfócitos T, amostras de sangue periférico (20 mL) desses indivíduos ansiosos e de 16 pessoas normais (não ansiosas) foram obtidas em seringas estéreis contendo heparina. Imediatamente a coleta, as células mononucleares do sangue periférico (CMSP) foram purificadas através da centrifugação em gradiente de Ficoll. Apesar de nossa pequena amostra, números inferiores de CMSP foram obtidos a partir do sangue periférico de indivíduos ansiosos, quando comparados ao grupo controle (Tabela).
Tabela: Caractéristicas gerais dos invidíuos recrutados a participar do estudo.
|
|
Normais (n=16) |
Ansiosos (n=14) |
|
Maior suscetibilidade a doenças infecciosas (%)*1 |
6.3 |
36 |
|
Reações alérgicas mediadas por IgE (%) |
6.3 |
18.8 |
|
Doenças auto-imunes (%) |
0% |
0% |
|
Número de CMSP/mL de sangue (x 106) |
0.3±0.7* |
0.15±0.6*2 |
*1Relato pessoal quanto ao número e tempo de intercorrências por doenças infecciosas.
*2 p= 0.0121
Como podemos observar na figura 1A, o nível de ativação celular basal foi significativamente superior em culturas de CMSP de indivíduos ansiosos (p=0.0296). A adição de um ativador policlonal de células T humanas, o PHA, no entanto, aumentou, de maneira significativa, a ativação apenas nas culturas dos indivíduos normais (p= 0.0022).
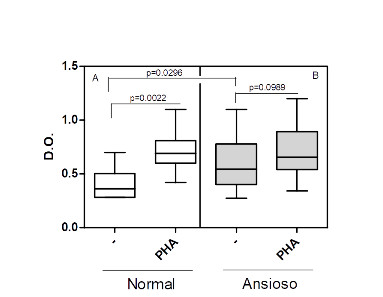
Figura 1: Avaliação da ativação dos linfócitos T de indivíduos normais e ansiosos na ausência ou na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (A, n=16) e ansiosos (B, n=14) foram mantidas por 03 dias em atmosfera de 5% de CO2 a 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, a 4 g/mL. O nível de ativação das células T foi avalido através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem à mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
Em culturas de CMSP de indivíduos normais, a noradrenalina, adicionada em doses relacionadas ao estresse, diminui significativamente a ativação das células T induzida pelo PHA. Esta inibição foi revertida seguindo a adição da dopamina (Figura 2). Nas culturas de CMSP de indivíduos ansiosos, a ativação dos linfócitos T pela PHA foi inibida pela noradrenalina e não foi alterada nem pela adição de substância P ou Dopa ou ainda hidrocortisona (Figura 2).
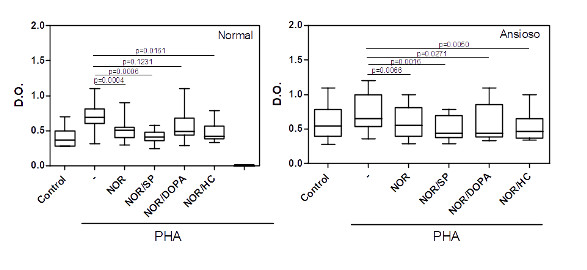
Figura 2: Efeito da noradrenalina sobre a ativação dos linfócitos T de indivíduos normais e ansiosos na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n=14) foram mantidas por 3 dias em atmosfera de 5% de CO2 à 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto de doses relacionadas ao estresse de noradrenalina (NOR, 10-5M) sozinha ou em combinação com substância P (SP, 10-5M) ou dopamina (DOPA, 5 x 10-5M) ou ainda de Hidrocortisona (HC, 10-5M) na ativação das células T foi avaliado. O status de ativação foi avalido através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem à mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
A substância P (SP), um neuropeptídeo conhecido por amplificar diferentes vias da resposta imune, não alterou o nível de ativação em culturas de linfócitos T estimuladas pela PHA no grupo controle. Porém, uma redução significativa na D.O. foi observada quando a cultura foi ativada na presença conjuntan de SP com noradrenalina (NOR) ou dopamina (DOPA) ou ainda hidrocortisona (HC) (Figura 3A). Interessantemente, a ativação dos linfócitos T em cultura de células de indivíduos ansiosos foi inibida pela SP e não foi modificada seguindo a adição conjunta de qualquer outro neurohormônio (Figura 3B).
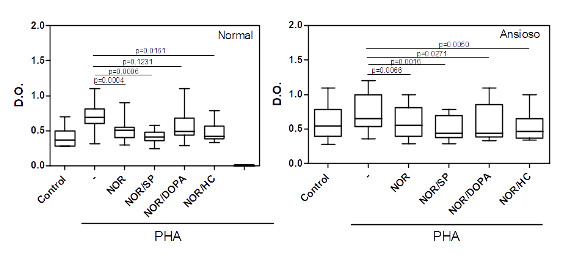
Figura 3: Efeito da substância P sobre a ativação dos linfócitos T de indivíduos normais e ansiosos na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n=14) foram mantidas por 3 dias em atmosfera de 5% de CO2 à 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto de doses relacionadas ao estresse de substância P (SP, 10-5 M) sozinha ou em combinação com noradrenalina (NOR, 10-5 M) ou dopamina (DOPA, 5 x 10-5 M) ou ainda de Hidrocortisona (HC, 10-5 M) na ativação das células T foi avaliado. O status de ativação foi avalido através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem a mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
A dopamina (DOPA) é um neurotransmissor cujos níveis são elevados durante o estresse e, principalmente, em pacientes esquizofrênicos. Em nosso sistema, doses elevadas de DOPA, sozinha ou e combinação com NOR, não alteraram a ativação das células T induzida pela PHA em culturas de CMSP de indivíduos normais. Em culturas de CMSP de indivíduos ansiosos, a DOPA sozinha, ou em combinação com os diferentes neurohormônios, reduziu o nível de ativação dos linfócitos T induzida pela PHA.
A ativação do eixo HPA durante situações de stress garante a produção de níveis elevados de hidrocortisol que tem, dentre muitos efeitos, uma ação imunossupressora. Em nosso sistema, a presença de hidrocortisona reduziu a ativação dos linfócitos T induzida pela PHA em culturas de células obtidas de indivíduos normais e ansiosos (figura 5). Interessantemente, nós observamos que dentre as culturas de CMSP de indivíduos ansiosos, aquelas que apresentaram elevado nível de ativação espontânea e pobre resposta à PHA, a presença de HC, porém, aumentou a capacidade dos linfócitos T em responder ao mitógeno (Figura 6).
Finalmente, na presença de todos os neurohormônios, a ativação das células T induzida pela PHA foi dramaticamente reduzida, principalmente nas culturas de células obtidas de indivíduos ansiosos (Figura 7), aonde pudemos observar uma intensa morte celular (Figura 8).

Figura 4: Efeito da dopamina sobre a ativação dos linfócitos T de indivíduos normais e ansiosos na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n=14) foram mantidas por 03 dias em atmosfera de 5% de CO2 à 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto de doses relacionadas ao estresse de dopamina (Dopa, 5 x 10-5 M) sozinha ou em combinação com noradrenalina (NOR, 10-5 M) ou substância P (SP, 10-5 M) ou ainda de Hidrocortisona (HC, 10-5 M) na ativação das células T foi avaliado. O status de ativação foi avaliado através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem à mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
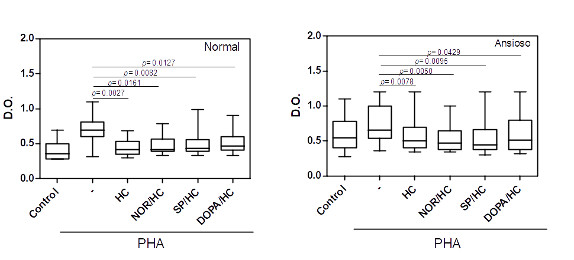
Figura 5: Efeito da hidrocortisona sobre a ativação dos linfócitos T de indivíduos normais e ansiosos na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n-14) foram mantidas por 3 dias em atmosfera de 5% de CO2 à 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto de doses relacionadas ao estresse de hidrocortisona (HC, 10-5 M) sozinha ou em combinação com noradrenalina (NOR, 10-5 M) ou substância P (SP, 10-5 M) ou ainda de dopamina (DOPA, 5 x 10-5 M) na ativação das células T foi avaliado. O status de ativação foi avalido através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem à mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
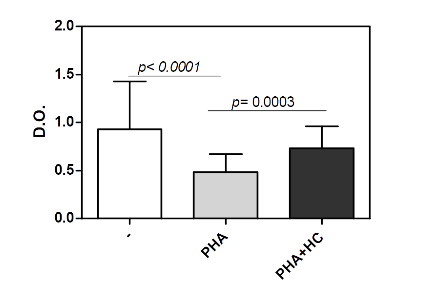
Figura 6: Efeito da hidrocortisona sobre a ativação dos linfócitos T de indivíduos ansiosos com reduzida resposta à PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos ansiosos (n=05) que responderam pobremente à PHA (4 g/mL) foram mantidas com elevadas doses de hidrocortisona (HC, 10-5 M). O status de ativação foi avaliado através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. Os resultados revelam a média ± desvio padrão obtidos de 05 indivíduos ansiosos.
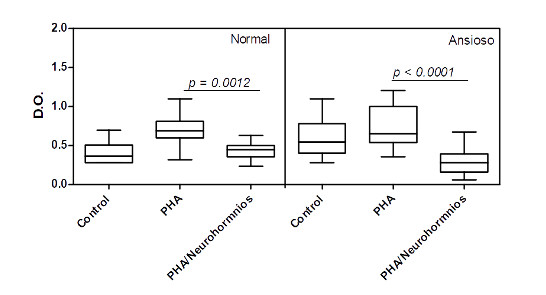
Figura 7: Efeito dos neurohormônios sobre a ativação dos linfócitos T de indivíduos normais e ansiosos na presença de PHA.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n=14) foram mantidas por 03 dias em atmosfera de 5% de CO2 à 37 0C na ausência ou na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto da ação conjunta dos neurohormônios (10-5M de noradrenalina, 10-5M de substância P, 5 x 10-5M de dopamina e 10-5M hidrocortisona) sobre a ativação dos linfócitos T ativados foi aferido através do teste colorimétrico MTT (ver metodologia). Os valores de p estão indicados na figura. As linhas horizontais dentro das barras correspondem à mediana. Os limites das barras correspondem aos percentis 25 e 75 e as linhas verticais indicam a variação.
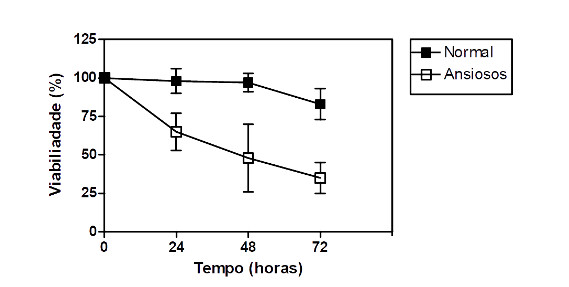
Figura 8: Impacto dos neurohormonios na viabilidade dos linfócitos T ativados obtidos de indivíduos normais e ansiosos.
Culturas de células mononucleares do sangue periférico (0.5 x 106/mL) obtidas de indivíduos normais (n=16) e ansiosos (n=14) foram mantidas por 03 dias em atmosfera de 5% de CO2 à 37 0C na presença do ativador policlonal de células T, o PHA, à 4 g/mL. O impacto da ação conjunta dos neurohormônios sobre a viabiliade dos linfócitos T ativados foi aferida pelo método de azul de trypan (ver metodologia). As doses de noradrenalina (10-5 M), substância P (10-5 M), dopamina (5 x 10-5 M) e hidrocortisol (10-5 M) adicionados às culturas foram relacionadas as concentrações poduzidas durante situações de estresse. Cada ponto na curva representa a média desvio-padrão em diferentes tempos de cultura.
8. DISCUSSÃO
A psiconeuroimunologia constitui hoje um campo vasto a ser explorado e promissor no sentido de ampliação de nossos conhecimentos da atuação do corpo e da mente no processo saúde-doença. Nesse contexto, há muito se conhece a relação entre os diferentes transtornos psiquiátricos e deficiências do sistema imune, comprometendo a capacidade do paciente em controlar agentes infecciosos e tumores. Apesar do grande avanço nos últimos anos no conhecimento das bases moleculares da relação na psicoimunologia em modelos experimentais, esses ensaios nem sempre reproduzem o que é observado nos estudos clínicos que ainda são poucos, com amostras pequenas e resultados ainda muito controversos. Portanto, o objetivo de nosso trabalho foi investigar o impacto de alguns mediadores do estresse sobre a ativação dos linfócitos T em indivíduos normais e ansiosos.
Os transtornos psiquiátricos abrangem uma ampla faixa de afecções caracterizadas por padrões de comportamento anormal e sinais e sintomas psicológicos que resultam disfunção. Dentre eles encontramos a ansiedade, caracterizada por uma sensação de desconforto, temor ou pressentimento. Os distúrbios de ansiedade são considerados os mais prevalentes em termos de doença psiquiátrica, acometendo cerca de 15 a 20% de pacientes ambulatoriais. São classificados em transtorno do pânico, ansiedade generalizada, fobias e transtorno de estresse pós-traumático. Esses distúrbios afastam muitas vezes o indivíduo do convívio social, limitam sua capacidade produtiva e resultam em perdas importantes. Apesar da maioria dos pacientes recrutados para participar do nosso estudo ter o diagnóstico só de ansiedade, 06/14 (42%) também preencheram o critério de depressão. A depressão é definida como um transtorno de humor e é caracterizado pela anedonia, ou seja, a falta de prazer de forma global e o humor deprimido por mais de duas semanas. Apesar desses estados emocionais serem considerados normais e até esperados em determinadas situações, a persistência dos mesmos, e principalmente quando incapacitantes, são considerados patológicos. A Organização Mundial de Saúde acredita que cerca de 121 milhões de pessoas estejam acometidas. Entretanto, menos da metade tem acesso a um diagnóstico e tratamento adequados. Os indivíduos afetados, não raro, estão em idade produtiva, o que contribui para que a depressão seja considerada a quarta causa mundial de morbidade. De acordo com estatísticas mundiais e norte-americanas, a depressão é mais comum em idosos e mulheres. Em nosso estudo, apesar da amostra de sido muito pequena, a maioria dos pacientes era mulheres (71%).
Indivíduos ansiosos e/ou deprimidos são mais suscetíveis aos efeitos deletérios do estresse. Entretanto, os mecanismos moleculares envolvidos nessa maior sensibilidade são pouco conhecidos.
Durante uma situação de estresse psicossocial ou biológico, respostas orgânicas de adaptação são ativadas para se adquirir, o mais rápido possível, o retorno ao equilíbrio orgânico. Nesse contexto, a ativação do eixo Hipotálamo-pituitária-adrenal (HPA) é particularmente importante na gênese da resposta ao estresse.
Seguindo um estresse biológico, seja uma infecção ou trauma, citocinas inflamatórias como TNF-, IL-1, IL-2 ativam são somente o eixo HPA como também o sistema nervoso central, diretamente e através das vias monoaminérgicas. Uma ativação desses sistemas conduz a produção de grandes quantidades de aminas biogênicas, neuropeptídeos e dos glicocorticóides, particularmente o cortisol. Em alguns indivíduos, tais como os ansiosos e deprimidos, a ativação crônica desses circuitos está atrelada a inúmeros defeitos nos mecanismos de defesa. Portanto, nosso objetivo primário foi avaliar o impacto de diferentes mediadores da reposta do estresse sobre a ativção dos linfócitos T, as células mais importantes do sistema imune.
Nossos resultados iniciais revelaram que, diferente do grupo controle, culturas de células mononucleares do sangue periférico de indivíduos ansiosos apresentavam elevada ativação basal, isto é, uma considerável ativação sem adição de estímulos. Esse resultado pode estar relacionado ao tônus simpático elevado nesses pacientes, o que, garante uma produção importante de noradrenalina, insensibilidade celular ao cortisol e maior secreção de citocinas inflamatórias a pesquenos estresses psicossociais e biológicos.
Quando partimos para avaliar o impacto dos neurotransmissores na capacidade dos linfócitos T de responder a mitógenos, nós observamos que, no geral, os efeitos deletérios observados são mais acentaudos nos pacientes ansisos.
Os neurotransmissores são tradicionalmente vistos como moléculas secretadas pelos nervos que disparam ou bloqueiam funções neuronais. Entretato, as células T não apenas expressam muitos receptores para vários neurotransmissores como é capaz de responder a estes.
A expressão desses receptores é modulada pelo status de ativação desses linfócitos, pela via de ativação, pelo tipo de estímulo, pela presença de citocinas e pela presença de diferentes combinações de neuromediadores. Vários estudos revelam que dependendo do sistema de ativação e do subtipo de células T, os efeitos de um neuromediador podem, por exemplo, render efeitos totalmente antagônicos. Finalmente, a expressão de receptores para os diferentes neuromediadores pode ser inibida ou aumentada em algumas doenças humanas.
As células T podem ser expostas aos neurotransmissores nos órgãos linfóides primários e secundários, no sangue e/ou em qualquer outro órgão, inclusive cérebro, durante a vigilância imune. Ademais, o conhecimento da capacidade dos linfócitos T de produzirem uma grande variedade de neurohormônios, amplia as suas possibilidades de regular, de maneira multifuncional, a homeostasia de um indivíduo durante uma resposta ao estresse.
Nesse sentido, nossos resultados sugerem que a ativação dos linfócitos T, particularmente em pacientes ansiosos, foi inibida pela adição de doses relacionados ao estresse de noradrenalina. Esse resultado está de acordo com dados publicados na literatura. Dentre os tipos de receptores adrenérgicos (Ars) o 2-AR é o subtipo de receptor dominante na superfície das células T, e o PHA aumenta a sua expressão. Em PBMC, a estimulação do 2-AR por agonistas seletivos inibe a proliferação de células T por diminuir a síntese de Il-2. Interessantemente, em cultura de células do nosso grupo controle, essa inibição foi revertida pela adição da substância P (SP).
A SP é um peptídeo de 11 aminoácidos liberado a partir das fibras nervosas do sistema nervosos autônomo e entérico que se liga ao receptor chamado neurocinina (NK-R) (14). No cérebro, a SP regula as desordens de humor, ansiedade, estresse, neurogênese, ritmo respiratório, neurotoxicidade, dor, náuseas/vômitos. A SP um mediador importante da resposta inflamatória e, em modelos experimentais, a sua ausência aumenta a suscetibilidade a infecções. As células T expressam primariamente o tipo 1 do NKR (NK-1R). In vitro, a SP aumenta a capacidade proliferativa dos linfócitos T por elevar a síntese de IL-2. Além de prolongar a meia vida das células T, a IL-2 é fundamental para a indução da resposta imune envolvida no controle de doenças infecciosas e tumorais. Por exemplo, em modelo de infecções bacterianas a SP intensifica respostas imunes mediadas pelos linfócitos Th1. Por outro lado, a capacidade de exarcerbar resposta Th2 denucia a participação desse neuropeptídeo tanto na proteção contra helmintos mas também na fisiopatogenia das reações alérgicas mediadas pela IgE. Entretanto, diferentes do grupo controle, a adição da SP, sozinha ou em combinação com os outro mediadores, inibiu a ativação dos linfócitos T induzida pela PHA em culturas de células de pacientes ansiosos. A observação do fenômeno oposto em cultura de linfócitos T ativados de pacientes ansiosos pode ser explicada pelo evento imunológico conhecido como AICD (“activation induced cell death”) e é apoiodo por outros achados na literatura. Por exemplo, SP em altas doses parece estar envolvido na gênese da imunopatologia seguindo uma infecção bacteriana e viral. No sistema imunológico, uma ativação crônica das células T induz eventos bioquímicos intracelulares que aumentam a expressão de moléculas pro-apoptóticas enquanto inibem a síntese de mediadores anti-apoptóticos. Como as células mononucleares do sangue periférico de pacientes ansiosos apresentaram uma ativação elevada, a morte por exaustão pode ser uma via molecular responsável pela perda funcional das células T nesses indivíduos. Atrelado a esse fenômeno, provavelmente eventos relacionados a regulação imune, tal como a produção de IL-10 TFG-, devem estar comprometidos.
A dopamina é um dos principais neurotransmissores no sistema nervoso central (SNC) e está envolvido em algumas funções chaves, tais como comportamento, controle do movimento, regulação endócrina e função cardiovascular. Existem 5 tipos de receptores para a dopamina (DR1-DR5). As células T virgens/repouso expressam primariamente os tipo DR3 (TCD8+) e DR2 (TCD4+ e TCD8+), sendo a expressão de DR1/DR5 relevante quando essas células são ativadas. Apesar de ser considerado um neurotransmissor do SNC, a dopamina pode ser secretada pelas fibras nervosas simpáticas nos tecidos linfóides secundários, aonde ocorre todo o processo de ativação dos linfócitos T pelas APCs (29a). Ademais, as células T ativadas são também capazes de sintetizar e estocar dopamina. Interessantemente, uma expressão elevada de receptores para dopamina em linfócitos T tem sido documentada em pacientes esquizofrênicos ou portadores de tumores malignos.
Na esquizofrenia, doença mental caracterizada pela hiperativiadade do sistema dopaminérgico, anormalidades imunes têm sido descritas. Nesses pacientes um estado elevado de ativação imune, caracterizado pela produção anormal de citocinas e um aumento no número de células T CD4 ativadas, tem sido descrito. Em nosso sistema, doses elevadas de dopamina, sozinha ou e combinação com noradrenalina, não prejudica a ativação das células T induzida pela PHA em culturas de CMSP de indivíduos normais. Entretanto, em culturas de células de indivíduos ansiosos, a dopamina sozinha, ou em combinação com os diferentes neurohormônios, reduziu o nível de ativação dos linfócitos T induzida pela PHA. Enquanto a maioria dos estudos in vitro sugere uma ação inibidora sobre a função das células T, dados obtidos em modelos experimentais de infecção demonstram o oposto. Por exemplo, deficiência farmacológica seletiva dos neurônios dopaminárgicos em camundongos diminui a capacidade dos animais de controlar infecções bacterianas e de inibir o crescimento de células tumorais. Nesse sistema, níveis reduzidos de dopamina foram diretamente correlacionados a uma fraca atividade citotóxica das células NK e CTLs. Recentemente, alguns autores têm sugerido que o efeito imuno-estimulante da dopamina estaria principalmente relacionado à capacidade dessa catecolamina em aumentar o limiar de ativação das células T efetoras por inibir os linfócitos T reguladores naturais. Diferente de todos os trabalhos clínicos, nós tivemos a precaução de dividir nossos indivíduos em normais e ansiosos, algo não conduzido por nenhum outro grupo. Diante disso, nós observamos que o efeito inibidor da dopamina sobre a ativação dos linfócitos T foi restrito às culturas de células de indivíduos ansisos. Apesar de antagônicos, dados obtidos em cultura de células mononucleadas de pacientes ansiosos sem adição de PHA revelou que a dopamina aumenta a ativação celular (dados não mostrados). Portanto, acreditamos que, assim como visto nas culturas estimuladas com SP, a presença conjunta de PHA e dopamina devem conduzir a exaustão clonal em linfócitos T de pacientes ansiosos. Isso está de acordo com os estudos que mostram que a dopamina, em elevadas doses, pode ser tóxica para os linfócitos T ativados, conduzindo-os a apoptose.
Durante a resposta ao estresse um dos mais potentes imunossupressores produzidos na fase eferente do eixo HPA é o cortisol. Esse mediador lipídico possui fortes ações antinflamatórias sendo usado na clínica em diferentes imunopatologias. O cortisol é capaz de inibir a ativação e afunção dos linfócitos T tanto diretamente quanto indiretamente, por inibir as APCs. Pacientes sobre estresse crônico acumulam muitos efeitos deletérios do cortisol, principalmente em decorrência da dessensibilização dos seus receptores em nível hipotalâmico e hipofisário. Em nosso modelo, apesar da hidrocortisona ter reduzido a ativação dos linfócitos T induzida pela PHA em ambos os grupos, nós observamos que a capacidade dos linfócitos T de responder à PHA dentre as culturas de células obtidas de indivíduos ansiosos com elevado nível de ativação espontânea e pobre resposta à PHA, foi aumentada seguindo a adição do cortisol. Acreditamos que a hidrocortisona, por diminuir o nível da ativação patológica, deve reduzir a expressão de moléculas que desativariam ou induziriam a morte por apoptose em células T cronicamente ativadas. Essa observação reforça a questão do papel importante desse corticóide em aumentar a sobrevida dos linfócitos T por atenuar disfunção imune relacionada a ativação imune crônica.
Finalmente, efeito mais dramático na ativação dos linfócitos T em cultura de células obtidas de pacientes ansiosos foi observado quando a noradrenalina, substância P e dopamina foram adicionadas a cultuta. Nesse contexto, quando comparado ao grupo controle, a morte celular foi significativamente superior nas culturas de pacientes ansiosos.
9. CONCLUSÃO
Em resumo, apesar de preliminares, nossos resultados sugerem que apesar dos neurotransmissores serem moduladores da ativação das células T, as conseqüências mais severas na resposta imune deve depender do estado de ativação basal, fenômeno comum em pacientes ansiosos. Se não tratatados, acúmulo desses mediadores do estresse pode não apenas aumentar a suscetibilidade a doenças infecciosas como também levar o risco do desenvolvimento de desordens imunomediadas, tais como reações alérgicas e auto-imunidade.
10. REFERÊNCIAS
Abbas AK, Leichtman AH. Imunologia Celular e MOLECULAR. RIO DE JANEIRO, 2005.
Afonso D. A esquizofrenia. Sinais Vitais 2005
Alexopoulou L, Holt AC, Medzhitov R, Flavell RA. Recognition of double-stranded RNA and activation of NF-kB by Toll-like receptor 3. Nature 2001; 413: 732–738.
Andreoli SB, Mari JJ, Blay SL, et al. Estrutura fatorial do questionário de morbidade psiquiátrica de adultos aplicado em amostra populacionais de cidades brasileiras. Ver Saúde Pública, 28 (4): 249-60, 1994.
Armaiz-Pena GN, Lutgendorf SK, Cole SW, Sood AK. Neuroendocrine modulation of cancer progression. Brain Behav Immu 2009; 2: 10-15.
Avgustin B, Wraber B, Tavcar R. Increased Th1 and Th2 immune reactivity with relative Th2 dominance in patients with acute exacerbation of schizophrenia. Creat Med J 2005; 46 (2): 268-74.
Bacchetta R, Grgori S, Roncarolo MG. CD4+ regualtory T cells: mechanisms and effector function. Autoimmune Rev 2005;4: 491-6.
Barre-Sinnoussi F, Chermann JC, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immunedeficiency syndrome (AIDS). Science 1983; 220(4599): 868-871.
Basu S, Dasgupta PS. Dopamine, as neurotransmitter, influences the immune system. J Neuroimmunol 2003; 102: 113-124.
Ben-Eliyahu S, Page GG, Schleifer SJ. Stress, NK cells, and cancer: still a promissory note. Brain Behav Immu 2007; 21: 881-887.
Bento CAM. Imunomodulação Materna no Ciclo Gestatório Normal e Patológico. Femina 2006; 35: 315-28.
Besser MJ, Ganor Y, Levite M. Dopamine by itself activates either D2, D3 or D1/D5 dopaminergic receptors in normal human T-cells and triggers the selective secretion of either IL-10, TNFa or both. Journal of Neuroimmunology 169 (2005) 161 – 171.
Blum A. et al. IL-12 and IL-23 induction of substance P synthesis in murine T cells and macrophages is subject to IL-10 and TGF- regulation. Infect Immun 2008; 76 (8): 3651-66.
Bonasio R, von Adrian UH. Generation, migration and function of circulating dendritic cells. Cur Opin Immunol 2006; 18: 503-11.
Brett FM, Mizisin AP, Powell HC, Campbell IL. Evolution of neuropathologic abnormalities associated with bloodebrain barrier breakdown in transgenic mice expressing interleukin-6 in astrocytes. J Neuropathol Exp Neurol 1995;54:766-75.
Brown AS, Begg MD, Gravenstein S, et al. Serologic evidence ofprenatal inXuenza in the etiology of schizophrenia. Arch. Gen. Psychiatry 2004a; 61, 774–780.
Brown AS, Hooton J, Schaefer CA, et al. Elevated maternal interleukin-8 levels and risk of schizophrenia in adult oVspring. Am. J. Psychiatry 2004b; 161, 889–895.
Brown AS, Susser ES.: In utero infection and adult schizophrenia. Ment Retard Dev Disabil Res Rev 2002; 8:51–57.
Buka SL, Tsuang MT, Torrey EF, Klebanoff MA, Wagner RL, Yolken RH. Maternal cytokine levels during pregnancy and adult psychosis. BrainBehav Immun 2001; 15: 411– 420.
Cai Z, Pan ZL, Pang Y, et al. Cytokine induction in fetal rat brains and brain injury in neonatal rats after maternal lipopolysaccharide administration. Pediatr Res 2000; 47:64–72.
Cannon M, Clarke CM. Risk for schizophrenia — broadening the concepts, pushing back the boundaries Schizophrenia Research 2005; 79: 5-13.
Carmines EG, Zeller RA. The place of factor analysis and reliability and validity assessment. In:Reliability and validity assessment. Beverly Hills, Sage Publication, 1979. pp.59. (Sage University Papers Series on Quantitative applications in Social Sciences).
Chen W. Dendritic cells and (CD4+) CD25+ T regulatory cells: crosstalk between two professionals in immunity versus tolerance. Front Biosci 2006; 11: 1360-70.
Cohen OJ, Kinter A, Fauci AS. Host factors in the pathogenesis of HIV disease. Immunol. Rev. 1997; 159: 31-48.
Cosentino M, Fietta AM, Ferrari M, et al. Human CD4_CD25_ regulatory T cells selectively express tyrosine hydroxylase and contain endogenous catecholamines subserving an autocrine/paracrine inhibitory functional loop. Blood 2007;109:632-642.
Cotran RS, Kumar V, Collins T. 1999. Acute and chronic inflammation. In: Pathologic Basis of Disease. pp: 50-88. 6 ed. Saunders Company, Philadelphia, Pennsylvania.
Dhodapkar MV, Steinman RM, Krasovsky J, Munz C, Bhardwaj J. Antigen-specific inibition effector T cell function in human after injection of immature dendritic cells. J Exp Med 2001; 193: 233-38.
Dobashi H, Sato M, Tanaka T, Tokuda M, Ishida T. Growth hormone restores glucocoticoide induced T cell suppression. FASEB 2001; 15: 1861-1864.
Dorshkind K, Horseman ND. Anterior pituary hormones, stress and immune system homeostasis. Bioessays, 2001; 23(3):288-94.
Dustin ML, Tseng S-Y, Varma R, Campi G. T-cell-dendritic cell immunological synapses. Cur Opin Immunol 2006: 18:512-16.
Eklind S, Mallard C, Leverin AL, et al. Bacterial endotoxin sensitizes the immature brain to hypoxic–ischaemic injury. Eur J Neurosci 2001; 13:1101-1106.
Eskandari F, Sternberg EM. Neural-immune interations in health and disease. Ann NY Acad sci, 2002; 966: 20-7.
Fatemi SH, Earle J, Kanodia R, et al. Prenatal viral infection leads to pyramidal cell atrophy and macrocephaly in adulthood: implications for genesis of autism and schizophrenia. Cell Mol. Neurobiol. 2002; 22, 25–33.
Fatemi SH, Emamian ES, Kist D, et al. Defective corticogenesis and reduction in Reelin immunoreactivity in cortex and hippocampus of prenatally infected neonatal mice. Mol. Psychiatry 1999; 4: 145–154.
Fazilleau N, McHeyzer-Williams LJ, McHeyzer-Willams MG. Local development of effector and memory T helper cells. Cur Opin Immunol 2007; 19: 259-67.
Fortier ME, Joober R, Luheshi GN, Boksa P. Maternal exposure to bacterial endotoxin during pregnancy enhances amphetamine-induced locomotion and startle responses in adult rat oVspring. J. Psychiatr. Res. 2004a; 38: 335–345.
Fortier ME, Kent S, Ashdown H, Poole S, Boksa P, Luheshi GN. The viral mimic, polyinosinic:polycytidylic acid, induces fever in rats via an interleukin-1-dependent mechanism. Am. J. Physiol. Regul.Integr. Comp. Physiol. 2004b; 287: R759–R766.
Freitas EJD. Psicofarmacologia Aplicada à Clínica, 3ª edição. Editora EPUB, Rio e Janeiro, 2000.
Friedman EM, Irwin MR. A role for CRH and the sympathetic nervous system in stress-induced immunosuppression. Ann NY Acad Sci, 1995; 771: 396-418.
Friedman HS. The multiple linkages of personality and disease. Brain Behav Immu 2008; 22: 668-75.
Ganguli R, Yang Z, Shurin G, et al. Serum interleukin-6 concentration in schizophrenia: elevation associated with duration of illness. Psychiatry Res 1994;51:1-10.
Gaughran F, O’Neill E, Cole M, Collins K, Daly RJ, Shanahan F. Increased soluble interleukin 2 receptor levels in schizophrenia. Schizophr Res 1998; 29:263-7.
Gilmore JH, Fredrik Jarskog L, Vadlamudi S, Lauder J.M. Prenatal infection and risk for schizophrenia: IL-1, IL-6, and TNF inhibit cortical neuron dendrite development. Neuropsychopharmacology 2004; 29:1221–1229.
Glaser R, MacCallum RC, Laskowski BF, et al. Evidence for a shift in the Th1 to Th2 cytokine responses associated with chronic stress and aging. J Gerontol: Med Sci, 2001; 56A: M477-M482.
Godbout JP, Glaser R. Stress-induced immune dysregulation: implications for wound healing, infectious disease and cancer. J Neuroimmune Pharm 2006; 1: 421-27.
Golan HM, Lev V, Hallak M, Sorokin Y, Huleihel M. Specific neurodevelopmental damage in mice oVspring following maternal inXammation during pregnancy. Neuropharmacology 2005; 48: 903–917.
Graziosi C, Gantt KR, Vaccarezza M, et al. Kinetics of cytokine expression during primary human immunodeficiency virus type 1 infection. Proc. Natl. Acad. Sci. USA 1996; 93(9): 4386-4391.
Grissell TV, Chang AB, Gibson PG. Reduced toll-like receptor 4 and substance P gene expression is associated with airway bacterial colonization in children. Pediatr Pulmonol. 2007 Apr;42(4):380-5.
Gutcher I, Becher B. APC-derived cytokines and T cell polarization in autoimmune inflammation J Clin Invest 2007; 117:1119-27.
Hagberg H, Mallard C. Effect of inflammation on central nervous system development and vulnerability Curr Opin Neurol 2005; 18:117–123.
Halbreich U, Asnis G, Zumoff B, et al. Effect of age and sex on cortisol secretion in depressives and normals. Psychiatry Res, 1984; 13: 221-29.
Hall JE, Guyton AC.. Tratado de Fisiologia Médica. 10 ed. Elsevier, Rio de Janeiro, 2004.
Harizi H, Gualde N. Pivotal role of PGE2 and IL-10 in the cross-regulation of dentritic cell-derived inflammatory mediators. Cell Mol Immunol 2006; 3: 271-77.
Harrison PJ, Owen MJ. Genes for schizophrenia? Recent findings and their pathophysiological implications. Lancet 2003; 361:417– 419.
Harrison PJ, Weinberger DR. Schizophrenia genes, gene expression, and neuropathology:Onthe matter of their convergence. Mol Psychiatry 2005; 10(4):420.
Hawkley LC, Cacioppo JT. Stress and the aging immune system. Brain Behav Immun, 2004; 18: 114-119.
Heinz A, Saunders RC, Kolachana BS, et al. Striatal dopamine receptors and transporters in monkeys with neonatal temporal limbic damage. Synapse 1999; 32:71–79.
Henrickson SE, von Adrian UH. Single-cell dynamics of T-cell priming. Cur Opin Immunol 2007; 19: 249-58.
Hugues S, Boissonnas A, Amigorena S, Fetler L. The dynamics of dendritic cell-T cell interations in priming and tolerance. Cur Opin Immunol 2006; 18: 491-95.
Huster KM, Stemberg C, Bush GH. Protective immunity towards intracellular pathogens. Curr Opin Immunol 2006; 18: 458-64.
Jassoy C, Harrer T, Rosenthal T, et al. Human immunodeficiency virus type 1 specific cytotoxic T lymphocytes release gamma interferon, tumor necrosis factor alpha (TNF-alpha), and TNF-beta when they encounter their target antigens. J. Virol. 1993; 67(5): 2844-2852.
Joachim RA, Handjiski B, Blois SM , Hagen E, Paus R, Arck PC. Stress-Induced Neurogenic Inflammation in Murine Skin Skews Dendritic Cells Towards Maturation and Migration. Key Role of Intercellular Adhesion Molecule-1/Leukocyte Function-Associated Antigen Interactions. Am J Pathol 2008;173(5):1379-88.
Johnson R, Wichern DE. Applied multivariate statistical analysis. 2 ed. Englewood Cliffs, Prentice Hall, 1988. p. 380-437: factor analysis and inference for structured covariance matrices.
Kaise HF. The varimax criterion for analytic rotation in factor analysis. Psychometrika, 1958; 23:187-210.
Kaiser HF. The application of electronic computers to factor analysis. Educ. Psvchol. Measur 1960; 20:141-51.
Kidd P. Th1/Th2 balance: the hypothesis, its limitations, and implications for healthy and disease. Altern Med Rev 2003; 8: 223-247.
Kiecolt-Glaser JK, Glaser R, Graventum S, Malarkey WB. Chronic stress alters the immune response to Influenza virus vaccine in older adults. Proc Natl Acad Sci USA, 1996; 93:3043-3047.
Kiecolt-Glaser JK, Glaser R. Stress and immunity: age enhances the risks. Curr Dir Psychol Sci 2001; 10: 18-21.
Kimura M, Toth LA, Agostini H, Cady AB, Majde JA, Krueger JM. Comparison of acute phase responses induced in rabbits by lipopolysaccharide and double-stranded RNA. Am. J. Physiol. 1994; 267: R1596–R1605.
Kipnis J, Cardon M, Avidan H, et al. Dopamine, through the Extracellular Signal-Regulated Kinase Pathway, Downregulates CD4+CD25+ Regulatory T-Cell Activity: Implications for Neurodegeneration. The Journal of Neuroscience 2004;24(27):6133– 6143
Kohm AP, Sanders VM. Norepinephrine and 2-Adrenergic Receptor Stimulation Regulate CD4_ T and B Lymphocyte Function in Vitro and in Vivo. Pharmacol Rev 53:487–525, 2001.
Laflamme N, Rivest S. Toll-like receptor 4: the missing link of the cerebral innate immune response triggered by circulating gram-negative bacterial cell wall components. Faseb J 2001; 15:155–163.
Lang UE, Puls I, Muller DJ et al. Molecular mechanisms of schizophrenia. Cell Physiol Biochem 2007 ; 20 (6) : 687-702.
Laura R. El universo multivariado y su analisis. In: Analysis multivariado: método de componentes principales. Washington, D.C. Secretaría General de la Organización de los Estados Americanos, Programa Regional de Desarollo Cientifico y Tecnológico, 1986. p. 3-10.
Lent R. Cem bilhões de neurônios. ed. atheneu. são paulo, 2005
Levite M. Neurotransmitters active T-cell and elicit crucial functions via neurotransmitterds receptors. Curr Opin Pharmacol 2008; 8 (4): 460-71.
Macián F, Im S-H, García-Cózar FJ, Rao A. T-cell anergy. Cur Opin Immunol 2004; 16: 209-216.
Madden, K.S. Catecholamines, sympathetic innervation and immunity. Brain Behav immun, 2003; 17:S5-S10.
Maes M, Bosmans E, Calabrese J, Smith R, Meltzer HY. Interleukin-2 and interleukin-6 in schizophrenia and mania: effects of neuroleptics and mood stabilizers. J Psychiatr Res 1995; 29:141-52.
Majumder B, Biswas R, Chattopadhyay R. Prolactin regulates antitumor immune response through induction of tumoricidal macrophages and release of IL-12. Int J Cancer, 2002; 97 (4): 493-500.
Matera L, Mori M, Galetto A. Effect of prolactin on antigen presenting function of monocyte-derived dendritic cells. Lupus, 2001; 10 (10):728-734.
Matera L, Mori M. Cooperation of pituitary hormone prolactin wih interleukin 2 and interleukin 12 production of interferon gamma by natural killer and T cells. Ann N Y Acad Sci, 2000; 917: 505-513.
McClellan SA, Zhang Y, Barrett RP, Hazlett LD. Substance P promotes susceptibility to Pseudomonas aeruginosa keratitis in resistant mice: anti-inflammatory mediators downregulated. Invest Ophthalmol Vis Sci. 2008 Apr;49(4):1502-11.
Mednick, B. Breakdown in high-risk subjects: familial and early environmental factors. J. Abnorm. Psychology 1971; 82: 469.
Meyer U, Feldon J, Schedlowski M, Yee BK. Immunological stress at the maternal-foetal interface: A link between neurodevelopment and adult psychopathology Brain, Behavior, and Immunity 2006; 20: 378–388.
Meyer U, Feldon J, Schedlowski M, Yee BK. Towards an immuno-precipitated neurodevelopmental animal model of schizophrenia. Neurosci. Biobehav. Rev. 2005; 29: 913–947.
Miüller N, Schwartz MJ. The immunological basis of glutamatergic disturbance in schizophrenia: towards an integrated view. J Neural Transm Suppl 2008; 72: 269-79.
Mix E, Goertsches R, Zettl UK. Immunology and neurology. J Neuroimmunol 2007; suppl2: II/2-II/7.
Moreira, M.S. In Psiconeuroimunologia. Editora MEDSI, Rio de Janeiro, 2003; pp. 99.
Muller N, Riedel M, Hadjamu M, Schwarz MJ, Ackenheil M, Gruber R. Increase in expression of adhesion molecule receptors on T helper cells during antipsychotic treatment and relationship to bloodebrain barrier permeability in schizophrenia. Am J Psychiatry 1999;156:634-6.
Murphy WJ, Longo DL. Growth hormone, immunomodulating therapeutic agent. ImmunoToday, 2000; 21 (5): 211-213.
Murray RM, Jones P, O’Callaghan E, Takei N, Sham P. Genes, viruses and neurodevelopmental schizophrenia. J Psychiatr Res 1992; 26:225–235.
Nassau JH, Tien K, Fritz GK. Review of the literature: integrating psychoneuroimmunology into pediatric chronic illness interventions. J Pediatric Psychol 2008; 33(2): 195-207.
Neeb K. 1997. Fundamentos de Enfermagem de Saúde Mental, Loures, Lusociência.
Nguyen MD, Julien JP, Rivest S. Innate immunity: the missing link in neuroprotection and neurodegeneration? Nat Rev Neurosci 2002; 3:216–227.
O´Garra, A, Barret FJ. In vitro generation of IL-10-producing regulatory CD4 + T cells is induced by immunosuppressive drugs and inhibited by Th1 and Th2 inducing cytokines. Immunol. Lettres 2003; 85: 135-139.
Oberbeck R, Schmit ZD, Wilsenack K, et al. Prolactin modulates survival and cellular immune functions in septic mice. J Surg Res 2003; 113 (2): 248-56.
Pace TWW, HU F, Miller AH. Cytokine-effects on glucocorticoid receptor function: Relevance to glucocorticoid resistance and the pathophysiology and treatment of major depression. Brain, Behavior, and Immunity 21 (2007) 9–19
Pantaleo G, Fauci AS. New concepts in the immunopathogenesis of HIV infection. Annu. Rev. Immunol. 1995; 13:487-512.
Pauwels R, Balzarini J, Baba M et al. Rapid and automated tetrazolium-based colorimetric assay for the detection of anti-HIV compounds. J Virol Methods 1988; 20 (4): 309-21.
Pavlovic S, Daniltchenko M, Tobin DJ, et al. Further Exploring the Brain–Skin Connection: Stress Worsens Dermatitis via Substance P-dependent Neurogenic Inflammation in Mice. Journal of Investigative Dermatology (2008) 128, 434–446.
Pearce BD. Schizophrenia and viral infection during neurodevelopment: A focus on mechanisms. Mol Psychiatry 2001; 6:634–646.
Perry VH. The influence of systemic inflammation on inflammation in the brain: implications for chronic neurodegenerative disease. Brain Behav Immun 2004; 18:407–413.
Popovic M, Sarngadharan MG, Read E, Gallo RC. Detection, isolation and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS. Science 1984; 224(4648):497-500.
Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E. Inflammatory Cytokine Alterations in Schizophrenia: A Systematic Quantitative Review. Biol Psychiatry 2008;63:801–808.
Rapaport MH, Lohr JB. Serum-soluble interleukin-2 receptors in neuroleptic-na€ıve schizophrenic subjects and in medicated schizophrenic subjects with and without tardive dyskinesia. Acta Psychiatr Scand 1994; 90:311-5.
Rapaport MH, Torrey EF, McAllister CG, Nelson DL, Pickar D, Paul SM. Increased serum soluble interleukin-2 receptors in schizophrenic monozygotic twins. Eur Arch Psychiatry Clin Neurosci 1993; 243:7-10.
Riedel M, Spellmann I, Schwarz MJ, et al. Decreased T cellular immune response in schizophrenic patients. Journal of Psychiatric Research 2007; 41:3–7.
Santana, V. Estudo epidemiológico das doenças mentais em um bairro de Salvador. Salvador, Instituto de Saúde do estado da Bahia, 1982 (Série estudos em Saúde, 3).
Savino W, Samaniotto S, Binart N, Postel-Vinay MC, Dardenne M. In vivo effects of growth hormone on thymic cells. Ann. N.Y. Acad. Sci, 2003; 992:179-85.
Schuleck RD, Clereci M, Ilolan MJ, Shearer GM. Limiting dilution analysis of interleukin-2-producing T cells responsive to recall and alloantigens in human immunodeficiency virus-infected and uninfected individuals. Eur J Immunol 1993; 23: 412-417.
Sheehan D, Lecrubier Y, Sheehan KH, Amorim P, Janavs J, Weiller E et al. The Mini International Neuropsychiatric Interview (MINI): The Development and Validation of a Structured Diagnostic Psychiatric Interview for DSM-IV and ICD-10. J Clin Psychiatry 1998;59(suppl 20);22-33
Shevach EM, DiPaolo RA, Andersson J, Zhao D-M, Stephens GL, Thornton AM. The lifestyle of naturally occurring CD4+CD25+Foxp3+ regulatory T cells. Immunol Rev 2006; 212: 60–73.
Shi L, Fatemi SH, Sidwell RW, Patterson PH. Maternal inXuenza infection causes marked behavioral and pharmacological changes in the offspring. J. Neurosci. 2003; 23: 297–302.
Singh AK, Jiang Y. How does peripheral lipopolysaccharide induce gene expression in the brain of rats? Toxicology 2004; 201:197–207.
Souza JC, Guimarães LA, Ballone GJ.. Psicopatologia e psiquiatria básica. Ed Vector, São Paulo 2004.
Steptol A, Hamer M, Chida Y. The effects of acute psychological stress on circulating inflammatory factors in human: a review and meta-analysis. Brain Behav Immun 2007; 21: 901-912.
Strous RD, Shoenfeld Y. Schizophrenia, autoimmunity and immune system dysregulation: A comprehensive model updated and revisited, Journal of Autoimmunity 2006; 27:71-80.
Suvisaari J, Haukka J, Tanskanen A, Hovi T, Lonnqvist J. Association between prenatal exposure to poliovirus infection and adult schizophrenia. Am J Psychiatry 1999; 156:1100 –1102.
Swingler S, Mann A, Jacque J, et al. HIV-1 Nef mediates lymphocyte chemotaxis and activation by infected macrophages. Natl. Med. 1999; 5: 997-1003.
Torres KCL, Antonelli LVR, Souza ALS, et al. Norepinephrine, dopamine and dexamethasone modulate discret leukocyte subpopulations and cytokines profiles from human PBMC. J Neuroimmunol 2005; 166: 144-57.
Traynor TR, Majde JA, Bohnet SG, Krueger JM. Intratracheal double-stranded RNA plus interferon-gamma: a model for analysis of the acute phase response to respiratory viral infections. Life Sci. 2004; 74: 2563–2576.
Trenado A, Fisson S, Braunberger E, Klatzmann D. Salomon BL, Choen JL. Ex vivo selection of recipient-type alloantigen-specific CD4+ CD25+ immunoregulatory T cells for the control of graft-versus-host disease after allogenic hematipoietic stem-cell transplantation. Transplantation 2004; 77: S32-34.
Tsuang MT, Faraone S. The case for heterogeneity in the etiology of schizophrenia. Schizophr Res 1995; 17:161–175.
Villemain F, Chatenoud L, Galinowski A, et al. Aberrant T cell-mediated immunity in untreated schizophrenic patients: deficient interleukin-2 production. Am J Psychiatry 1989;146:609-16.
Waddington JL, Lane A, Scully PJ, Larkin C, O’Callaghan E. Neurodevelopmental and neuroprogressive processes in schizophrenia: Antithetical for complimentary, over a lifetime trajectory of disease? PsychiatrClin N Am 1998; 21:123–149.
Weinberger DR. From neuropathology to neurodevelopment. Lancet 1995.
Weinberger DR. Implications of normal brain development for the pathogenesis of schizophrenia. Arch Gen Psychiatry 1987; 44:660–669.
Weiss, DJ. Factor analysis and counseling research. J Counseling Psychol 7: 477-85, 1970.
Wong D, Dorovini-Zis K, Vincent SR. Cytokines, nitric oxide, and cGMP modulate the permeability of an in vitro model of the human blood–brain barrier. Exp Neurol 2004; 190:446–455.
Wyatt RJ. Neurodevelopmental abnormalities and schizophrenia. A family affair. Arch Gen Psychiatry 1996; 53:11–15.
Ziemssen T, Kern S. Psychoneuroimmunology_ Cross-talk between the immune and nerveous systems. J Neuroimmunol 2007, 254 (suppl 2): II/8-II/11.
Zuckerman L, Rehavi M, Nachman R, Weiner I. Immune activation during pregnancy in rats leads to a postpubertal emergence of disrupted latent inhibition, dopaminergic hyperfunction, and altered limbic morphology in the offspring: a novel neurodevelopmental model of schizophrenia. Neuropsychopharmacology 2003; 28:1778–1789.
Zuckerman L, Weiner I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research 2005; 39: 311–323.
11. ANEXO

Fonte: Sheehan D, Lecrubier Y, Sheehan KH, Amorim P, Janavs J, Weiller E et al. The Mini International Neuropsychiatric Interview (MINI): The Development and Validation of a Structured Diagnostic Psychiatric Interview for DSM-IV and ICD-10. J Clin Psychiatry 1998;59(suppl 20);22-33
Publicado por: Vinicius Viana Abreu Montanaro
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.