TRATAMENTOS PARA SUPERAÇÃO DE DORMÊNCIA EM SEMENTES FLORESTAIS DA MATA ATLÂNTICA
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. DORMÊNCIA EM SEMENTES FLORESTAIS
- 3.1 CATEGORIAS DA DORMÊNCIA
- 3.1.1 Dormência exógena
- 3.1.2 Dormência endógena
- 4. MECANISMOS DE DORMÊNCIA
- 5. METÓDOS PARA SUPERAÇÃO DE DORMÊNCIA
- 5.1 ESCARIFICAÇÃO QUÍMICA
- 5.2 ESCARIFICAÇÃO MECÂNICA
- 5.3 ESTRATIFICAÇÃO FRIO E QUENTE
- 5.4 CHOQUE DE TEMPERATURA
- 5.5 ÁGUA QUENTE OU FRIA
- 6. ESPÉCIES DA MATA ATLÂNTICA COM DORMÊNCIA
- 7. CONSIDERAÇÕES FINAIS
- 8. REFERÊNCIAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
O bioma Mata Atlântica é conhecido por sua biodiversidade única de espécies da fauna e em especial da flora que vem sendo devastado, como muitos outros biomas do nosso Brasil. Essa riqueza tem sido reproduzida por viveiros diariamente, com intuito de reflorestamento de áreas que sofreram degradação. Com essa vasta riqueza de espécies, ainda não se tem estudo das catalogadas, trazendo consigo empecilhos para germinação, como exemplo a dormência em sementes florestais. O objetivo da revisão bibliográfica é enfatizar a importância dos estudos da germinação das sementes florestais e os seus empecilhos, de forma que soluções são apresentadas para facilitar o processo de emergência das plântulas. A proposta do trabalho dividido em capítulos é apresentar os tipos de dormência nas sementes e onde ela é localizada, os métodos de tratamentos específicos para a superação da dormência a partir da identificação do tipo e a descrição das três espécies destacadas como exemplos, Schizolobium parahyba, Bowdichia virgilioides e Senna multijuga, todas possuem dormência tegumentar, uma característica da família Fabaceae, que são superadas com tratamentos específicos, como escarificação, choque térmico, desponte, são técnicas de superação abordadas a partir de comparação de trabalhos escritos sobre as espécies, trazendo resultados positivos para superação tegumentar que possuem. O trabalho bibliográfico apresenta caráter descritivo e qualitativo, com auxílio de sites renomados, livros e trabalhos acadêmicos, trazendo confiabilidade para o estudo.
Palavras-chave: Sementes; Dormência; Superação-de-dormência; Tratamentos; Germinação.
ABSTRACT
The Atlantic Forest biome is known regard its unique biodiversity of fauna species, especially the flora species that has been devastated, like many other biomes of our Brazil. This richness has been reproduced daily in nurseries, willing to reforest areas that suffered degradation. Even with this vast plenty of species, there is still no study of the cataloged ones, resulting in barriers for germination, as an example the dormancy in forest seeds. The aim of the literature review is to emphasize the relevance of forests seeds germination studies and their hindrances, in a way that answers are shown to facilitate the seedling emergence process. This work proposition, divided by chapters, is to show the types of seed dormancy and where it is located, the application methods used to overcome the dormancy is through the identification of the type and the description of the three species highlighted as samples, Schizolobium parahyba, Bowdichia virgilioides. and Senna multijuga. All of them have integumentary dormancy, a feature of the Fabaceae family, which they are surpassed by tests such as scarification, thermal shock and discouragement. These are surpassing techniques approached from the analysis of writing works about the species, showing positive outcomes to the tegumenrtary surpass treat that they have. The conclusion brings positive indicators about the controls, appointing that they are effective and the quoted species carry a high percentage of germination after the surpassing dormancy. The bibliographic work shows a qualitative and descriptive character, supported by renowned sites, books and academic works, consolidating the study.
Key-words: Seeds; Numbness; Overcoming of numbness; Treatments; Germination.
2. INTRODUÇÃO
Segundo dados do SOS Mata Atlântica (2019), a bioma Mata Atlântica ocupa cerca de 15% do total do território brasileiro, seguindo a costa do país, incluindo 17 estados brasileiros. Atualmente, apenas 12,4% de sua cobertura original existe, por conta da interferência humana, desses remanescentes 80% estão em área privada. Estima-se 20 mil espécies vegetais, entre ameaçadas de extinção e endêmicas. É considerada prioritária para conservação da biodiversidade mundial, por ter maior riqueza.
Diante o grande aumento de áreas degradadas ou desmatadas, estudos relacionados com recuperação, reposição da vegetação e restauração das matas ciliares são pontos de fundamental importância no quesito florestal e ambiental. Para obter resultados satisfatórios, aliados ao curto tempo, métodos que agilizem os processos são buscados com maior frequência.
A semeadura direta para recuperação de áreas é um processo pouco utilizado, apesar dos seus benefícios, o “plantio direto” é uma opção mais procurada e um método de agilizar o processo da restauração. Para a produção das mudas é necessário conhecer as características de cada espécie e os fatores que interferem o processo. Para uma produtividade em larga escala, métodos que agilizem a germinação das sementes e que diminuam a mão de obra são estudados diariamente.
A Mata Atlântica possui um vasto território, com espécies jamais estudadas, muitas delas com grande potencial econômico, extrativista, medicinal e ambiental, das quais uma grande gama pode possuir mecanismos que impedem ou atrasam a germinação de suas sementes. Melhorar os existentes e estabelecer novos métodos de superação de dormência é essencial tanto para o saber científico, como para o saber popular.
Diante da produtividade e particularidade das espécies, tratamos do processo evolutivo das sementes questionando da seguinte maneira: Qual a importância de detectar o tratamento específico para quebra de dormência e a influência da mesma na germinação das espécies Bowdichia virgilioides, Senna multijuga e Schizolobium parahyba?
Objetivou-se deste modo, através da revisão bibliográfica, compreender a importância do mecanismo de dormência em sementes de espécies florestais nativas da Mata Atlântica, bem como os efeitos dos tratamentos pré-germinativos para as espécies Bowdichia virgilioides, Senna multijuga e Schizolobium parahyba. Os objetivos específicos são traçados para estudar os tipos de dormência nas sementes das espécies florestais, descrevendo os métodos utilizados para a superação da dormência relatando seus usos e benefícios, e compreender como funciona os métodos da superação nas espécies escolhidas.
O trabalho foi baseado em uma revisão bibliográfica, visando a qualidade de uma pesquisa de elevado valor teórico. O trabalho de Revisão de Literatura, possibilita a explicação de um contexto com pontos de vistas de vários autores, chegando em um senso comum, tornando o trabalho rico em informações. As buscas dos assuntos abordados, realizou - se em base de dados, como exemplo Sites – Scielo e Portal Embrapa Sementes, Livros e Guias de Germinação de Sementes nativas e em Artigos científicos publicados. Os materiais escolhidos e estudados, para corroborar com o trabalho, estão disponíveis a cerca de 50 anos, contribuindo com os estudos atualmente. A elaboração do trabalho contou com palavras chaves ou “Keywords”, como: sementes, dormência, superação-de-dormência, tratamentos, germinação.
3. DORMÊNCIA EM SEMENTES FLORESTAIS
De acordo com Macedo (1993), para a produção de mudas de qualidade é necessária a escolha de boas sementes, que tenham sido beneficiadas e armazenadas de forma adequada, visando padrões corretos, e que apresentem boa qualidade fisiológica e genética.
A germinação ocorre na sequência de eventos fisiológicos, quando o local tem água e luz disponível, a semente absorve a água, hidratando o embrião e amolecendo o tegumento, de forma que esse envoltório venha a se romper, devido a embebição, ocorrendo assim a germinação (KRAMER; KOZLOWSKI, 1972).
Geralmente os autores consideram dormência o fato da semente não germinar, mas essa definição é um tanto inadequada, pois fatores externos como meio ambiente podem afetar o desenvolvimento da semente assim como fatores associados a mesma, diante esse fenômeno a explicação que se encaixa adequadamente é o fato das sementes estarem viáveis, com local favorável para sua propagação e não germinar (BASKIN; BASKIN, 1998).
Sendo um processo natural, a germinação é influenciada negativamente ou positivamente por fatores internos ou externos, sendo eles respectivamente: inibidores ou luz, temperatura e oxigênio. Cerca de 1/3 das sementes germinam em condições favoráveis, quando isso não ocorre é estabelecido algum grau de dormência (KRAMER; KOZLOWSKI, 1972).
Segundo Popinigis (1985), a semente fez da dormência um mecanismo de sobrevivência para determinadas condições climáticas, com objetivo de se manter viva e viável quando em contato com condições favoráveis. Ele associa que o melhor método para superar a dormência de cada espécie é quando ela se sentir ameaçada.
A dormência tem a influência no atraso da germinação, mas é de extrema importância para sobrevivência das espécies a longo prazo, fazendo com que as sementes venham a emergir em situações especiais. Para o silvicultor, a dormência pode ajudar ao ser armazenada e ao mesmo tempo ser um empecilho, tornando irregular e dificultando a sua produção (KRAMER; KOSLOWSKI, 1972).
Analisando a evolução, sementes com impermeabilidade tegumentar possuem essa característica para sobrevivência das espécies sob condições desfavoráveis ao clima, permanecendo no solo por um tempo maior e, sob melhores condições, se tornarão permeáveis à umidade atingindo assim a germinação, permitindo o estabelecimento de populações (CARNEIRO; ALMEIDA; KAGEYAMA; DIAS, 1982).
Segundo Chaves e Kageyama (1980), o estudo das características que afetam a produção de sementes tem aumentado com o tempo e surgimento de novas espécies. Analisaram que espécies com o tegumento mais resistente (Delonix regia) aumentava com a maturidade das sementes. Foi observado que à perda da umidade das sementes na planta está associada com sua impermeabilidade e também a desidratação que sofrem independente da planta (WILLIANS, 1960).
Cardoso (2004), diz que a dormência pode ser classificada de acordo sua origem ou de mecanismos que a provoquem. As modalidades são: dormência primária (quando dispersa da planta-mãe) ou secundária (quando instalada depois da dispersão); dormência exógena (tegumentar) ou endógena (embrionária).
3.1. CATEGORIAS DA DORMÊNCIA
Segundo Costa (2009), classificada de acordo com a origem e mecanismos que às desenvolvem, a dormência, seguindo a classificação “origem”, é dividida em dois tipos, primária e secundária. A dormência primária consiste no início do ciclo, quando as sementes são formadas e dispersas da planta-mãe já apresentando a dormência que se instala no processo de maturação. A dormência secundária, diferente da primária, ao ser dispersa não apresentam dormência, contudo, a desfavoráveis condições que essas sementes são instaladas para à germinação, provoca a ocorrência desse fator. Diante os casos abordados e os estudos realizados, ainda não se sabe até que ponto essas divisões diferem entre si.
Há duas maneiras de classificar a dormência em sementes, segundo Fowler e Bianchetti (2000), sendo elas exógena (tegumentar) ou endógena (embrionária), podendo ocorrer de forma paralela, sendo que as duas ocorrem na mesma espécie ou independente uma da outra. Caracterizada pela não germinação das sementes expostas a condições ambientais favoráveis, ocorrendo de forma primária, quando são dispersas da planta mãe já com esse empecilho (VIEIRA; FERNANDES, 1997).
3.1.1. Dormência exógena
A dormência exógena ou tegumentar possui a característica da impermeabilidade da “casca” ou tegumento à gases ou água, fazendo com que o embrião não se disponibilize dos nutrientes necessários para seu desenvolvimento. Em muitos casos, quando separado o embrião do tegumento que o reveste, a germinação ocorre normalmente. Considerada dormente, essas sementes possuem o tecido que as envolvem como um empecilho que não pode ser superado ou rompido. Os fungos e bactérias presentes no solo, fazem o papel de quebra de dormência nessas espécies ao degradarem seus tegumentos (FOWLER; BIANCHETTI, 2000).
Causada primariamente pelo tegumento, pelo endocarpo, pelo pericarpo ou por órgãos extraflorais, em geral por pouca ou nenhuma participação direta do embrião na sua superação. Os mecanismos responsáveis por essa modalidade de dormência estão relacionados à impermeabilidade, ao efeito mecânico, ou à presença de substâncias inibidoras dos tecidos. (CARDOSO, 2004).
A germinação nesse caso pode ser bloqueada por fatores como: - Interferência na absorção de água, característica de espécies das famílias Malvaceae, Fabaceae, Convolvulaceae e Chenopodiaceae; - Impedimento mecânico, tecidos ao redor do embrião são resistentes; - Impedimento de trocas gasosas, os tecidos limitam as trocas gasosas entre o embrião e o meio; e Presença de inibidores, impedimento químico presente na semente (FOWLER; BIANCHETTI, 2000).
3.1.2. Dormência endógena
Caracterizada pela não germinação das sementes, ocorrendo de forma secundária, causada por alterações fisiológicas quando expostas a condições ambientais desfavoráveis para à germinação após sua colheita (VIEIRA; FERNANDES, 1997).
A dormência endógena ou embrionária, possui relação direta com à imaturidade do embrião, ou inibição fisiológica, impedindo assim que o embrião venha a se desenvolver. Em casos especiais há a dormência dupla, ocorrendo os dois processos na mesma espécie, quando a radícula apresenta dormência, porém menos intensa que a do epicótilo. Quando o epicótilo não se desenvolve, denominamos de dormência epicotelial (FOWLER; BIANCHETTI, 2000).
Os cotilédones estão intimamente ligados a essa categoria, estudos foram feitos retirando o cotilédone do embrião dormente, permitindo assim o desenvolvimento do mesmo. Eles exercem efeito inibidor sobre o eixo embrionário fazendo com que atrase ou não ocorra a germina (BEWLEY; BLACK, 1994).
Segundo Costa (2009), a dormência endógena pode ser subdividida em morfofisiológica: junção da dormência fisiológica e morfológica; fisiológica: inibidores químicos no embrião, fazendo com que haja um desbalanço hormonal, dificultando sua germinação; e morfológica: embrião não completamente desenvolvido quando suas sementes são dispersadas.
4. MECANISMOS DE DORMÊNCIA
4.0.3. Dormência Fisiológica
A dormência fisiológica é causada por mecanismos que inibem o desenvolvimento metabólico, localizado não só no embrião, mas nos tecidos e estruturas do endosperma e tegumento (CARDOSO, 2004). Presença de substâncias inibidoras e ausência de substâncias que promovam a germinação (BASKIN; BASKIN, 2004).
A dormência fisiológica se caracteriza com a presença de empecilhos para a protrusão da raiz primária do embrião, se subdividindo em profunda, intermediária ou superficial. O que as difere é a ausência de maturação do embrião ou a quantidade de plântulas anormais, sendo a intermediária e superficial mais comum, necessitando o isolamento do embrião para uma melhor produção (VIVIAN et al, 2008).
As características que diferem os níveis intermediário e superficial são os tratamentos para quebra de dormência. A intermediária necessita de um tratamento maior que a superficial e menor que a profunda, variando de 2 (dois) a 6 (seis) meses de estratificação a frio. A superficial, varia de 5 (cinco) a 90 (noventa) dias, sendo o suficiente para realizar o processo requerido (BASKIN; BASKIN, 1998).
4.0.4. Dormência Morfológica
Caracterizada por sementes dispersas sem a formação completa ou diferenciação do embrião. Para melhores resultados, o embrião deverá ser separado da planta mãe, fazendo com que se desenvolva, atingindo um nível de maturação. Espécies tropicais possuí esse mecanismo contínuo, dificultando o processo de separação da dormência e germinação (CARDOSO, 2004).
Algumas espécies apresentam a característica de dispersar a semente com o embrião imaturo, sendo possível identificar no embrião os cotilédones e o eixo embrionário, sendo notado a diferença, mas o desenvolvimento geralmente não obtém sucesso. Em outros casos, mais extremos, o embrião não se diferencia, as células se tornam uma só sendo chamada de estágio globular (BORGHETTI, 2004). Para compreender o processo inicial da Formação da semente até o processo final de germinação, Bewley (1994) traz explicações em modelo de organograma, como se observa na figura 1:
Figura 1 – Sequência de fatores para germinação
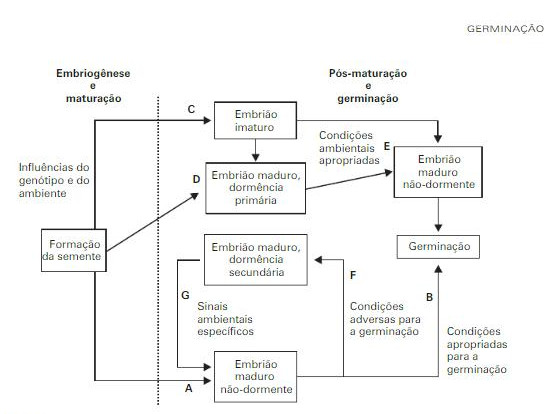
Fonte: Borghetti (2004, p. 111)
Durante a embriogênese, o embrião pode atingir sua maturidade morfofisiológica (A) e, eventualmente, germinar sob condições apropriadas (B). Caso se encontre imaturo (C) ou dormente (D), será necessário um período de pós-maturação para que o embrião atinja sua maturidade (E). Estando dormente ou não, o embrião pode adquirir dormência secundária (F) caso as condições para a germinação sejam inapropriadas. Sinais ambientais específicos são necessários para a superação da dormência secundária (G) e a promoção da germinação (BEWLEY; BLACK, 1994).
4.0.5. Dormência Morfofisológica
A imaturidade do embrião pode ser caracterizada como morfológica e também fisiológica, trazendo barreiras e inibições metabólicos que precisão da superação para ocorrer a germinação. Essa “combinação de bloqueios” tem sido denominada dormência morfofisiológica (BASKIN; BASKIN, 1998).
Diante os estudos, Baskin e Baskin (1998), dizem que, as diferenças entre as subdivisões da dormência fisiológica estão relacionadas nos métodos de quebra de dormência, utilizando-se tratamentos térmicos ou o ácido giberélico, dependendo do caso, o ácido giberélico substitui a estratificação que seria realizada. Os métodos para a quebra dessa dormência são por meio das estratificações térmicas (estratificação quente, fria, quente + fria, entre outras possibilidades).
Finch e Leubner (2006) citam que os embriões são fisiologicamente dormentes, e para a superação morfofisiológica deve se utilizar estratificação a frio ou moderada e aplicação de hormônios. Baskin e Baskin (2005), elencam cinco famílias de Floresta ombrófila densa que apresenta a dormência por terem o embrião pequeno, sendo elas Arecaceae, Canellaceae, Magnoliaceae, Myristicaceae e Podocarpaceae.
4.0.6. Dormência Física
A dormência física é caracterizada por sua barreira celular impermeável à água, localizada no tegumento das sementes. A hidratação dessas sementes, por muitas vezes, está localizada nas estruturas anatômicas presentes, chamadas se hilo, que são encontradas na parte superior das mesmas (BASKIN; BASKIN, 2004).
As curvas de embebição se dão ao fato de amostras de sementes serem dispostas a testes que as submetem escarificadas e não escarificadas, servindo com indicador do nível de dormência. Em casos específicos, os tegumentos restringem a disponibilidade do oxigênio ao embrião. É de suma importância determinar até que ponto o tegumento influencia na absorção dos nutrientes para se classificar quanto sua dormência e tratamentos a serem submetidos.
Como nos outros casos de dupla dormência anteriormente citados, a dormência física pode ocorrer combinada com a dormência fisiológica não profunda. A estratificação só obterá sucesso, quando a escarificação para a ruptura do tegumento ocorrer, facilitando assim o efeito para hidratação do embrião e maior sucesso na estratificação (BASKIN; BASKIN, 2004).
4.0.7. Dormência Química e Mecânica
A dormência química já foi identificada como sendo substância presentes no pericarpo que impediam o desenvolvimento do embrião, mas os estudos que sequenciaram afirmam que é causada por substâncias inibidoras que se encontram dentro e fora das sementes que, quando em contato com o embrião, dificultem seu crescimento e germinação (BASKIN; BASKIN, 1998)
A dormência mecânica se caracteriza por ter uma rigidez no endocarpo ou mesocarpo, impedindo à germinação (CARDOSO, 2004). Essa dormência foi estabelecida por Nikolaeva (1969), por possuir frutos duros ou com parede lenhosa (endocarpo estendida ao mesocarpo) como fator de inibição do embrião a germinação, ela também cita que não há evidências claras da ação do endocarpo como empecilho.
Muitos pesquisadores não determinam a química e mecânica como dormência, Baskin e Baskin (2004), veem a dormência mecânica como uma subdivisão da dormência fisiológica, observando que a camada restringe a germinação do embrião devido seu baixo potencial de desenvolvimento em estado inativo. A quebra de dormência do embrião foi suficiente para fazer romper através do endocarpo, segundo Vivian et al. (2008), assimilando a d. química com a d. fisiológica.
Para Zaidan e Barbedo (2004), diante da falta de homogeneidade da germinação, a rapidez do desenvolvimento em campo e a mortalidade, é imprescindível estudar os diferentes graus de dormência das espécies até um determinado momento e sob suas condições ambientais.
5. METÓDOS PARA SUPERAÇÃO DE DORMÊNCIA
Há diversas causas para explicar a dormência de sementes. Embriões imaturos ou rudimentares, tegumentos impermeáveis, restrições mecânicas ou combinação de causas, pela presença de substâncias químicas inibidoras da germinação (POPINIGIS, 1985).
A água é o fator de influência significativa sobre o processo de germinação, com a hidratação do embrião ocorre a intensificação da respiração de a retomada da atividade metabólica, gerando energia e nutrientes para germinação (FLORIANO, 2004). A luz é o fator decisivo para controlar a dormência nas sementes, controlando o tempo de germinação no campo e fator decisivo para sobrevivência das plântulas (MORI et al., 2012). A temperatura afeta nas reações bioquímicas que determina todo o processo germinativo de cada espécie (FLORIANO, 2004).
A presença de dormência reduz o metabolismo germinativo das sementes podem promovendo o retardamento da germinação durante o armazenamento, aumentando a longevidade das sementes (CALVIN, 2015). Mas não é vantajoso em viveiros, onde se deseja que grandes quantidades de sementes germinem em curto espaço de tempo, permitindo a produção de mudas uniformes (MEDEIROS FILHO et al., 2002).
De acordo com Kramer e Kozlowski (1972), a dormência é caracterizada por tipos, que são direcionados para o local do impedimento, sendo eles: Fisiológica, Morfológica, Física, Mecânica e Química. Para cada tipo, há um método de superação da dormência, possibilitando o contato do embrião com o elemento que falta para a sua germinação.
Métodos para superar as dormências são aplicados, por exemplo, a dormência tegumentar, a superação pode ocorrer através da escarificação com ácido sulfúrico; imersão em água quente imersão em água fria; escarificação mecânica; eficiente para leguminosas, trincando o tegumento, permitindo acesso à água, entre outros métodos, que possui influência direta na aceleração da germinação das sementes (FOWLER; BIANCHETTI, 2000).
Na dormência embrionária o método indicado para superá-la é o de estratificação a frio, ocorre entre 2 a 4 ºC, em recipientes com areia lavada, por longos períodos variando de 15 dias a 6 meses, dependendo da necessidade da espécie. Alguns casos trazem as duas dormências (tegumentar e embrionária) em uma só espécie, rompendo primeiramente a tegumentar para depois tratar a embrionária (FOWLER; BIANCHETTI, 2000).
5.1. ESCARIFICAÇÃO QUÍMICA
Segundo o IPEF (Instituto de Pesquisas e Estudos Florestais) (1997), o método de escarificação química consiste na quebra da dormência por meio de ácidos, geralmente é utilizado o ácido sulfúrico ou clorídrico, que permite a semente executar trocas com o meio, água e/ou gases. Algumas espécies como Pterogyne nitens, Trema micrantha, Guazuma ulmifolia e Ormosia arborea, são exemplos que necessitam desse tratamento.
Fowler e Bianchetti (2000), recomenda para escarificação química, que as sementes sejam imersas em ácido sulfúrico em tempo determinado, que varia para cada espécie, à temperatura alternada de 19ºC e 25°C, logo após estas são lavadas em água corrente e dispostas para germinar.
5.2. ESCARIFICAÇÃO MECÂNICA
Segundo o IPEF (Instituto de Pesquisas e Estudos Florestais) (1997), a escarificação mecânica é a abrasão das sementes sobre superfície áspera, podendo ser lixa, piso áspero, entre outros, que faça com que o tegumento seja rompido facilitando a absorção de água pelo embrião. A escarificação deve ocorrer ao lado oposto do hilo, evitando que a radícula seja danificada. Algumas espécies como Adenanthera pavonina, Ormosia arborea, Copaifera languisdorffii e Schizolobium parahyba, são exemplos que necessitam desse tratamento.
A dormência pode ser superada realizando incisões superficiais no tegumento, que é o método de escarificação, ela ocorre na natureza através da ingestão da semente por animais passando pelo trato intestinal, por queimadas, acidez do solo ou por ação de microorganimos (SANTOS et al., 2004).
Segundo Fowler e Bianchetti (2000), este método tem sido significativamente eficaz para a quebra de dormência nas espécies florestais, com destaque para as leguminosas. Fazendo a abrasão das sementes nas lixas, faz com que o tegumento seja desgastado, proporcionando que absova água e o processo de germinação inicie.
Figura 2 – Morfologia externa e interna
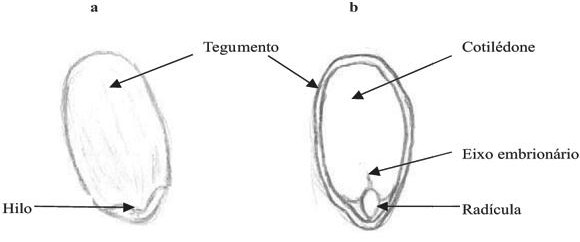
Fonte: Vauaden; Albuquerque; Coelho; Mendonça (2005, p. 09)
Na figura A, se tem a visão externa da semente, onde se localiza o Hilo (que é a cicatriz deixada pelo funículo mio por qual se conecta a placenta) e o tegumento. Na figura B, a visão interna, temos o cotilédone, eixo embrionário e a radícula, que internamente, fica localizada próxima ao hilo, por esse o fato de escarificar o lado oposto, para não danificar a radícula.
5.3. ESTRATIFICAÇÃO FRIO E QUENTE
Segundo o IPEF (Instituto de Pesquisas e Estudos Florestais) (1997), a estratificação é comumente utilizada para a auxiliar da maturação do embrião, consiste no tratamento úmido à baixa temperatura, permitindo com que o embrião faça trocas gasosas e absorva água. Algumas espécies como Ocotea puberula, Ocotea porosa, Ilex paraguariensis, Copaifera langsdorffii e Calophyllum brasiliense, são exemplos que necessitam desse tratamento.
Algumas espécies florestais manifestam imaturidade no embrião, fazendo com que não germine em condições ambientalmente favoráveis. O método de estratificação consiste no meio em que as sementes são colocadas, sendo um local úmido e isento de fungos. Geralmente, utiliza-se de areia lavada que apresente grão de 2,0mm de diâmetro, para facilitar a separação das sementes por peneiragem. O recipiente deverá permitir uma boa drenagem, evitando acumulação de água, causando o apodrecimento das sementes. A temperatura recomendada para estratificação a frio varia entre 2ºC e 4ºC. A maturação de algumas espécies ocorre no final do verão e início de outono, a estratificação quente e fria visa reproduzir as condições ambientais favoráveis ocorridas na maturação dessas espécies. A temperatura varia entre alta e baixa, sendo elas, 25ºC por 16 horas e 15ºC por oito horas, por um período (FOWLER; BIANCHETTI, 2000).
5.4. CHOQUE DE TEMPERATURA
Segundo o IPEF (Instituto de Pesquisas e Estudos Florestais) (1997), o método de choque é realizado com a variação da temperatura, alternando aproximadamente aos 20ºC, em períodos de oito a doze horas.
Em espécies como o dendê e a palmeira, apresentam dormência que necessitam de tratamento para ser superada, e o choque térmico é o recomendado, estimulando a germinação das espécies. O buriti, quando exposto às temperaturas de 30 a 40 ºC, por determinado período, é quebrado a dormência, ocorrendo a germinação (HUSSEY, 1956; REES, 1961; ADDAE-KAGYAH et al., 1998).
5.5. ÁGUA QUENTE OU FRIA
Segundo o IPEF (Instituto de Pesquisas e Estudos Florestais) (1997), o método de água quente é utilizado em sementes que apresentam tegumento impermeável, consiste na imersão das sementes na água, com temperatura de 76 a 100°C, dependendo da necessidade de cada espécie. Algumas espécies como Peltophorum dubium, Trema micranta, Schizolobium parahyba e Colubrina glandulosa, são exemplos que necessitam desse tratamento.
A imersão em água quente é eficaz para superar a dormência tegumentar das sementes de algumas espécies florestais. A água aquecida até uma temperatura inicial, a alternância de temperatura varia de espécie, e coloca-se as sementes imersas, permanecendo por período também variável. A imersão em água fria faz o papel de hidratação das sementes, que por vez quando armazenada fica excessivamente seca, impedindo o início do processo germinativo. (FOWLER; BIANCHETTI, 2000).
6. ESPÉCIES DA MATA ATLÂNTICA COM DORMÊNCIA
Os recursos florestais têm sofrido com desmatamento para fins agropecuários, industriais, entre outros. Nas áreas que os recursos já foram explorados, a solução para reverter o quadro são os plantios florestais, e, nesse caso, as sementes constituem o ponto de partida na produção das mudas (IBAMA, 1998).
A dificuldade em relação as espécies estão ligadas a falta de disponibilidade de sementes para produção de mudas em larga escala, o interesse em descobrir a biologia das espécies nativas tendo em vista a domesticação e o domínio de sua reprodução tem se tornado constante (MONTEIRO; RAMOS, 1997).
Espécies que produzem sementes duras representam um sério problema para os viveiristas, pois, o tegumento impermeável restringe a entrada de água e oxigênio, oferecendo resistência física ao crescimento do embrião, o que retarda a germinação, sendo prejudicial à produção de mudas (MOUSSA; MARGOLIS; DUBÉ; ODONGO, 1998).
Para muitas espécies, a escarificação química tem sido necessária na superação da dormência, enquanto, para outras, a imersão em água quente tem resolvido o problema. Contudo, a aplicação e eficiência desses tratamentos depende da causa e do grau de dormência, o que é bastante variável entre as espécies. (RIBAS; FOSSATI; NOGUEIRA, 1996).
A família Fabaceae é uma das mais representativas em que a ocorrência de dormência tegumentar nas sementes é recorrente, a impermeabilidade é uma característica da família, impedindo a embebição e o início da germinação (ROLSTON, 1978)
De acordo Lorenzi (1992), as sementes de Bowdichia virgilioides, quando semeadas sem nenhum tratamento emergem em 60 dias, a Senna multijuga emerge em 30 dias. Ao se realizar um tratamento adequado, esse índice pode reduzir pela metade. A Schizolobium parahyba, quando escarificada, emerge em 5 dias.
6.1. Bowdichia virgilioides
Bowdichia virgilioides, conhecida vulgarmente com sucupira-preta é uma espécie arbórea pertencente à família Fabaceae com ampla dispersão pelo Brasil. Árvore de casca grossa atinge 20 metros de altura, apresentando tronco com diâmetro máximo de 60 centímetros. Possuem folhas compostas, pinadas, com folíolos pubescentes, as flores são de cor lilás, e floresce nos meses de outubro e dezembro. É considerada uma planta pioneira e adaptada a terrenos secos e pobres, espécie de forte interesse de recuperação de áreas. (BRANDÃO; FERREIRA, 1991; LORENZI, 1992).
Figura 3 – Germinação da semente da Bowdichia virgilioides
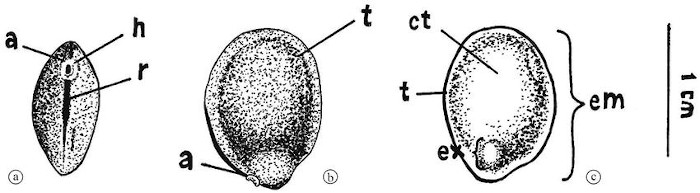
Fonte: Albuquerque et al., (2009)
Morfologia externa (a e b) e interna (c) da semente de Bowdichia virgilioides Kunth. Legenda: a - arilo; h - hilo; r - rafe; t - tegumento; ct - cotilédone; ex - eixo embrionário; em – embrião.
Seus frutos são leguminosos, indeiscentes, amarronzados com tons de vermelho, contendo pequenas sementes com 3 a 5 mm de comprimento. As suas sementes são abundantes em proteínas resistentes ao calor, mantendo-se presentes durante todo o processo germinativo (ALBUQUERQUE, 2006).
Os estudos de germinação auxiliam na produção de mudas para restauração de áreas onde ocorreu exploração intensa, podendo fomentar o uso dessa árvore em programas de arborização urbana, em locais de solo pobre e sujeitos a severas deficiências hídricas anuais, as sementes germinam de 1 a 2 meses (SMIDERLE; SOUSA, 2003).
As sementes apresentam dormência tegumentar, comum da família Fabaceae. Os métodos para superar a impermeabilidade do tegumento são vastos, mas sendo poucos com eficácia, podendo citar a escarificação química com ácido sulfúrico ou choque térmico, imersão em água de temperatura ambiente (30º) e água quente (80º) (MAYER; POLJAKOF-MAYBER, 1989).
Smiderle e Sousa (2003), aprofundaram os estudos sobre a B. virgilioides, trazendo o método de escarificação química como o melhor tratamento para a espécie, utilizando ácido sulfúrico por cinco minutos, aumentando a porcentagem de germinação, chegando a 90%.
6.2. Schizolobium parahyba
Schizolobium parahyba, conhecido como Guapuruvu é uma espécie da família das Fabaceaes, é uma espécie heliófila, pioneira, ocorre na Mata atlântica, comum em vegetação secundária e com bom potencial para uso na recuperação de matas ciliares e sua madeira com bom potencial para usos medicinais. (CARVALHO, 2003). Grande potencial de celulose, sua madeira vem sendo mais explorada para usos futuros. (LORENZI, 1992).
A demora na germinação também contribui para o aumento dos custos de produção de mudas no viveiro, necessitando de mão de obra, irrigação e cuidados por mais tempo. Além da intensidade de dormência, a velocidade de germinação também pode ser influenciada pelo vigor da semente, temperatura, umidade, textura do substrato, profundidade e posição da semente no substrato, dentre outros fatores (CARVALHO; NAKAGAWA, 2000; NASCIMENTO, 2002)
As sementes de guapuruvu são relativamente grandes, contabilizando-se aproximadamente 500 unidades por quilo e apresentam dormência devido à impermeabilidade do tegumento à água. A escarificação mecânica pode ser utilizada para a promoção da germinação que ocorre de 8 a 15 dias após a semeadura em sementes com a dormência superada (BIANCHETTI; RAMOS, 1981).
Bianchetti e Ramos (1981), retrata que as sementes de Guapuruvu imersas de quatro a dez minutos em água fervente (95ºC), por 48 horas fora do aquecimento, é suficiente para a quebra da dormência presente na espécie, chegando a 85% de germinação. Por ser um método de baixo custo e eficaz, é o indicado para a produção de mudas em larga escala.
A escarificação mecânica com tesoura e lixa é o método com mais apropriado para superar a dormência, os resultados se mostram superiores quando comparadas a escarificação química. A escarificação mecânica faz com que a absorção da água e a hidratação do embrião ocorra (PEREIRA; LEAL; LAGAZZI; MORAES, 2011).
Figura 4 – Germinação da semente de Schizolobium amazonicum
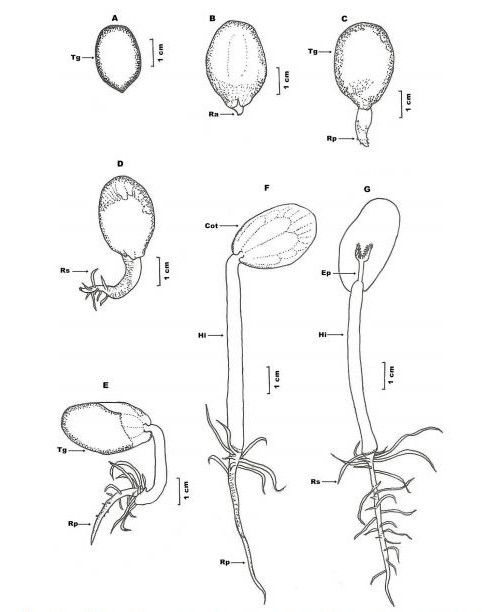
Fonte: Braga; Oliveira e Sousa (2013, p.06)
A. Semente em vista frontal; B-G. 1a Fase do desenvolvimento – germinação; Cot – Cotilédone; Ep – Epicótilo; Hi – Hipocótilo; Ra – Raiz primária; Rp – Alongamento da raiz primária; Rs – Raiz secundária; Tg – Tegumento da semente (BRAGA; OLIVEIRA; SOUSA, 2013).
6.3. Senna multijuga
Carvalho (2004), diz que O Pau-Cigarra, da família das Fabaceaes, é uma espécie que atinge até 10 m de altura, atingindo cerca de 60 cm de DAP. Com incidência no bioma Mata Atlântica, é uma espécie de interesse florestal, por ser pioneira e ter exigência de luz. Possui dormência tegumentar.
Cresce em solos úmidos com drenagem regular, espécie comum em solos arenosos (KAGEYAMA et al., 1991). Semente com dormência tegumentar, recomendado a imersão em água temperatura ambiente por 12 horas para embebição (MARCHETTI, 1984). Ulhôa e Botelho (1993), recomendam escarificação química, com ácido sulfúrico, de 5 a 35 minutos; ou imersão em água quente a 100ºC fora do aquecimento, seguido de embebição por 24 a 48 horas.
Lorenzi (1992) diz que em condições de armazenamento corretas, em relação a umidade, temperatura, ventilação, secagem e beneficiamento, as sementes mantem sua viabilidade por cerca de 6 meses, podendo assim, germinar ao ser dispostas em condições favoráveis.
S. multijuga verifica-se que a escarificação mecânica promove uma rápida germinação com valores próximos a 90% a partir do terceiro dia. Apesar de um aumento marcante na germinação em relação ao controle, a exposição ao ácido por 3 ou 12 minutos apresenta uma eficiência muito baixa na quebra da dormência tegumentar, em comparação com a escarificação mecânica. (FILHO; GUERRA; LOVATO; SCOTTI, 1997).
7. CONSIDERAÇÕES FINAIS
Com base nos estudos bibliográficos realizados, conclui-se que os desmatamentos se agravam ao passar dos anos e há real interesse de reflorestamentos das áreas degradadas por parte de órgão ambientais, empresas e populações que sobrevivem dessas áreas. Os plantios de mudas e semeaduras diretas vem crescendo devido a demanda das restaurações e as empresas tem sido cobradas da participação nesse quesito florestal. O foco em áreas biodiversas tem aumentado, por parte de desmatadores, pesquisadores e projetos envolvendo participação de viveiros para produção intensiva de mudas.
Os empecilhos para germinação das sementes são estudados, o que traz agilidade e maior produção de mudas. Para o viveiro que produz em larga escala, necessita da quebra de dormência das sementes, de maneira que não ocupe a mão de obra e seja eficaz, como muitas sementes da família da Fabaceae, traz consigo essa dificuldade de germinação, dificultando sua produção.
Há uma real importância em detectar se espécies com interesse de produção possuem dormência, para ser tratada de maneira correta, auxiliando seu desenvolvimento para superação da dormência. Esse assunto deve ser priorizado na área de sementes e deve ser mais aprofundado, sendo realizado pesquisas técnicas e acompanhamentos de testes com espécies que possuem dificuldade para germinar, apresentando novas soluções e novos métodos.
Os tratamentos para auxiliar o rompimento dessas barreiras da germinação são aprimorados e se iniciam com saberes empíricos sobre o assunto, se tornando de confiabilidade quando testados cientificamente e comparados com os outros testes de superação de dormência, variando para cada espécie. Ao citar as espécies Schizolobium Parahyba, Bowdichia virgilioides e Senna multijuga, é trazido para a realidade sementes da Mata Atlântica, da família Fabaceae e de interesse econômico e ambiental, após análises de estudos realizados com as espécies, todas reagiram de forma positiva aos estímulos de escarificação, superando a impermeabilidade tegumentar que possuem. Os métodos estudados e comparados são de caráter qualitativo e funcionam.
8. REFERÊNCIAS
ADDAE-KAGYAH, K. A.; OSAFO, D. M.; OLYMPIO, N. S.; ATUBRA, O. K. Effect of seed storage, heat pretreatment and its duration on germination and growth of nursery stock of the idolatrica palm, Elaeis guineensis var. idolatrica (Chevalier). Tropical Agriculture, St. Augustine, v. 65, n. 1, p. 77-83, 1998.
ALBUQUERQUE, K.S. Aspectos fisiológicos da germinação de sementes de sucupira-preta (Bowdichia virgilioides Kunth.). 2006. 90f. Dissertação (Mestrado em Agronomia) - Universidade Federal de Lavras, Lavras, 2006.
ALBUQUERQUE, K. S.; GUIMARÃES, R. M.; ALMEIDA, I. A.; CLEMENTE, A. C. S. Alterações fisiológicas e bioquímicas durante a embebição de sementes de sucupira-preta (Bowdichia virgilioides Kunth.). Revista Brasileira de Sementes, v. 31, n. 1, p. 12-19, 2009.
BASKIN, Carol C., BASKIN, Jerry M. Seeds: ecology, biogeography, and evolution of dormancy and germination. San Diego: Academic Press, 666 p, 1998.
BASKIN, Carol C.; BASKIN, Jerry M. 2004. A classification system for seed dormancy. Seed Science Research, 14: 1-16.
BASKIN, C.C. & BASKIN, J.M. 2005. Seed dormancy in trees of climax tropical vegetation types. Tropical Ecology 46 (1):17-28.
BEWLEY, J.D.; BLACK, M. Dormancy and the control of germination. In: BEWLEY, J.D.; BLACK, M. Seeds: physiology of development and germination. New York: Plenum Press, 1994. p.199-214.
BIANCHETTI, A.; RAMOS, A. Quebra de dormência de sementes de canafístula Peltophorum dubium (Spreng.) Taubert resultados preliminares. Boletim de Pesquisa Florestal, n. 3, p. 87-95, 1981.
BRAGA, Lúcia Filgueiras; OLIVEIRA, Ady Corrêa da Costa; SOUSA, Marcílio Pereira. Morfometria de sementes e desenvolvimento pós-seminal de Shizolobium amazonicum Huber (Ducke) – Fabaceae. Revista Científica, Jaboticabal, v. 41, n. 1, p. 1-10, 2013.
BRANDÃO, M.; FERREIRA, P. B. D. Flora apícola do cerrado. Informe Agropecuário, Belo Horizonte, v. 15, n. 168, p. 4-8, 1991.
CALVIN, G. P. Armazenamento das sementes recalcitrantes de Eugenia stipitata McVaugh: aspectos tecnológicos e fisiológicos. (Tese de Doutorado, Programa de Pós-Graduação em Ciências de Florestas Tropicais – PPG-CFT, Manaus – Amazonas). 2015.
CARDOSO, V.J.M. Dormência: estabelecimento do processo. In: A.G.Ferreira & F. Borghetti (orgs). Germinação: do básico ao aplicado. Artmed, Porto Alegre. 323p, 2004.
CARDOSO, Vitor José Mendes. Conceito e classificação da dormência em sementes. Oecologia Brasiliensis, São Paulo, 323p, 2009.
CARNEIRO, Regina Maria; ALMEIDA, Antonio Ribeiro de; KAGEYAMA, Paulo Yoshio; DIAS, Inês de Souza. Importância da dormência em sementes na regeneração da Bracaatinga – Mimosa scabrella Benth. Circular técnica, Piracicaba, n.149, p. 1-9, set 1982.
CARVALHO, Paulo E. R. de. Circular Técnica: Pau Cigarra. Paraná: Colombo, 2004.
CARVALHO, P.E.R. Espécies arbóreas brasileiras: recomendações silviculturais de espécies florestais. Brasília: EMBRAPA Informação Tecnológica; Colombo: EMBRAPA/ CNPF, 2003. v.1, 1039p.
CARVALHO, N. M.; NAKAGAWA, J. Sementes: Ciência, Tecnologia e Produção. 4. ed. Jaboticabal: FUNEP, 2000. p. 588.
COSTA, Caroline Jácome. Dormência em sementes. Revista Cultivar, Rio Grande do Sul, n. esp. p. 01, 2009. Disponível: Acessado em 13.set.2019.
CHAVES, R.; KAGEYAMA, P.Y. Determinação do início de dormência no desenvolvimento da semente de Delonix regia. Boletim informativo do PIPEF. (no prelo). Piracicaba. 1980.
FINCH-SAVAGE, W.E.; LEUBNER-METZGER, G. 2006. Seed dormancy and the control of germination. New Phytologist 171(3):501-523.
FLORIANO E. P. Germinação e dormência de sementes florestais. Santa Rosa. Caderno Didático n. 2 (1), p. 19, 2004.
FOWLER, João A. P.; BIANCHETTI, Arnaldo. Dormência em Sementes Florestais. Colombo: Embrapa Florestas, 2000. 27p.
HUSSEY, G. An analysis of the factors controlling the germination of the seed of Elaeis guineensis (Jacq.). Annals of Botany, London, v. 22, p. 259284, 1956.
Ibama. Instituto Brasileiro do Meio Ambiente. 1998. Sementes Florestais: Colheita, Beneficiamento e Armazenamento. Programa Florestal, Projeto Ibama/PNUD/BRA, 27 p.
Instituto de Pesquisas e Estudos Florestais. Métodos de Quebra de dormência de Sementes. Disponível: < https://www.ipef.br/tecsementes/dormencia.asp > Acessado em 15.out.2019.
KAGEYAMA, P.Y.; CARPANEZZI, A.A.; COSTA, L.G. da S. Diretrizes para a reconstituição da vegetação florestal ripária de uma área piloto da Bacia de Guarapiranga. Piracicaba, 1991. 40p. Mimeografado. Relatório apresentado à Coordenadoria de Planejamento Ambiental da Secretaria de Estado do Meio Ambiente.
KRAMER, Paul J.; KOZLOWSKI, T. Fisiologia das árvores. Lisboa: Fundação Calouste Gulbenkian, 1972. 745 p.
LABOURIAU, L.G. 1983. A germinação das sementes. Secretaria Geral da OEA, Washington. 174p.
LEMOS FILHO, J. P. de; GUERRA, S. T. M.; LOVATO, M. B.; SCOTTI, M. R. M. M. L. Germinação de sementes de Senna macranthera, Senna multijuga e Stryphnodendron polyphyllum. Pesquisa Agropecuária Brasileira, v.32, n.4, p.357-361, 1997.
LORENZI, H. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas no Brasil. Nova Odessa: Plantarum, 1992. 368 p.
MACEDO, Antônio C.de; KAGEYAMA, Paulo Y.; COSTA, Luiz G. S. da. Produção de Mudas em viveiros florestais. São Paulo: Fundação Florestal, 1993. 18p.
MALAVASI, M.M. Germinação de sementes. In: Pinã-Rodrigues, F.C.M. Manual de análise de sementes florestais. Campinas: Fundação Cargill, 1988. p.25-40.
MARCHETTI, E.R. Época de coleta, semeadura, tratamento pré-germinativo e métodos de semeadura de espécies florestais cultivadas no Rio Grande do Sul. In: CONGRESSO FLORESTAL ESTADUAL, 5., 1984, Nova Prata. Anais. Nova Prata: Prefeitura Municipal de Nova Prata, 1984. v.2, p.524-532.
MAYER, A. M.; POLJAKOFF-MAYBER, A. The germination of seeds. Oxford: Pergamon, 1989. 270 p.
MEDEIROS FILHO, S., FRANÇA, E. A., INNECCO, R. Germinação de sementes de Operculina macrocarpa (L.) Farwel e Operculina alata (Ham.) Urban. Revista Brasileira de Sementes, v. 24, n. 2, p.102-10, 2002.
MONTEIRO, P.P.M.; RAMOS, F.A. Beneficiamento e quebra de dormência de aquênios em cinco espécies florestais do cerrado. Revista Árvore 21: 169-174, 1997.
MORI, E. S.; PIÑA-RODRIGUES, F. C. M.; Freitas, N. P. Sementes florestais Guia para germinação de 100 espécies nativas. São Paulo: Instituto Refloresta, n.1, 2012.
MOUSSA, H.; MARGOLIS, H. A.; DUBÉ, P. A.; ODONGO, J. Factores affecting the germination of doum palm (Hyphaene thebaica Mart.) seeds from the semi-arid of Nger, West Africa. Forest Ecology and Management, Amsterdam, v. 104, n. 1/3, p. 27-34, May 1998.
NASCIMENTO, W. M. O. Influência da posição de semeadura na germinação, vigor e crescimento inicial de plântulas de bacabinha (Oenocarpus mapora Karsten – Arecaceae). Revista Brasileira de Sementes, v. 24, n. 1, p. 179-182, 2002.
NIKOLAEVA, M.G. Fisiologia da dormência profunda em sementes. Leningrado, Rússia, Izdatel'stvo 'Nauka'. (Traduzido do russo por Z. Shapiro, Ciência Nacional Fundação, WAshington, DC.), 1969.
PEREIRA, Mariana de Oliveira; LEAL, Thiago de Souza; LAGAZZI, Guilherme; MORAES, Cristiano Pedroso de. Avaliação de métodos de escarificação na superação de dormência de Shizolobium parahyba (Vell.) Blake (Fabaceae: Caesalpinoideae). Revista em Agronegócio e Meio Ambiente, v.4, n.1, p.119-129, 2011.
POPINIGIS, E. Fisiologia da semente. 2ed Brasília: ABRATES, 1985. 298p.
RIBAS, L. L. F.; FOSSATI, L. C.; NOGUEIRA, A.C. Superação da dormência de sementes de Mimosa bimucronata (DC.) O. Kuntze (maricá). Revista Brasileira de Sementes, 18 (1): 98-101, 1996.
REES, A. R. Effect of high-temperature pre-treatment on the germination of palm oil seed. Nature, London, v. 189, n. 1, p. 74-75, 1961.
ROLSTON, M.P. Water impermeable seed dormancy. The Botanical Review, Austrália, v. 44, n. 33, p. 365-396, 1978.
SANTOS, T.O.; MORAIS, T.G.O.; MATOS, V.P. Escarificação mecânica em sementes de chichá (Sterculia foetida L.). Revista Árvore, v.28, n.1, p.1-6, 2004. < http://www.scielo.br/scielo.php?pid=S010067622004000100001&script=sci_arttext>. Acessado em 16.out.2019.
SMIDERLE, O.J.; SOUSA R. de C.P. Dormência em sementes de paricarana (Bowdichia virgiliodes Kunth-Fabaceae - Papilionidae). Revista Brasileira de Sementes, v.25, n.2, p.48-52, 2003.
SOS Mata Atlântica. Nove dos 17 estados da Mata Atlântica estão no nível do desmatamento zero. Disponível: < https://www.sosma.org.br/projeto/atlas-da-mata-atlantica/dados-mais-recentes/ > Acessado em 15.out.2019.
ULHÔA, M.L.; BOTELHO, S.A. Quebra de dormência em sementes de cássia-verrugosa (Senna multijuga L.C.Rich - Caesalpiniaceae). Informativo ABRATES, Brasília, v.3, n.3, p.116, 1993.
VEGIS, A. 1964. Dormancy in higher plants. Annual Review of Plant Physiology, 15: 185-224.
VIEIRA, Israel G.; FERNADES, Gelson D. Métodos de Quebra de Dormência de Sementes. Piracicaba: IPEF-LCF/ESALQ/USP, Informativo Sementes IPEF, nov-1997.
VIVIAN, R.; SILVA, A.A.; GIMENES, Jr., M.; FAGAN, E.B.; RUIZ, S.T.; LABONIA, V. Dormência em sementes de plantas daninhas como mecanismo de sobrevivência. Revista Planta Daninha, Viçosa, v. 26 n. esp. p. 01, 2008. Disponível: < http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-83582008000300026> Acessado em 14 set. 2019.
VUADEN, Epifania Rita; ALBUQUERQUE, Maria C. de Figueiredo e; COELHO, Maria de Fátima Barbosa; MENDONÇA, Elisabeth A. Furtado. Germinação e Morfologia de sementes e de plântulas de hortelã-do-campo Hypis cana Pohl. (Lamiaceae) Revista Brasileira de Sementes, Pelotas, v. 27 n.2 esp. p. 01, 2005. Disponível: < http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0101-31222005000200001>. Acessado em 15.out. 2019.
WILLIANS, W.A.; ELLIOT, J.R. Ecological significance of seed coat impermeability to moisture in crimson, suterreanean and rose clovers in a Mediterranean type climate. Ecology. Durham. USA. 41: 733-742. 1960.
ZAIDAN, L.B.P.; BARBEDO, C.J. Quebra de dormência em sementes. In: FERREIRA, A. G.; BORGHETTI, F. (Org.). Germinação: do básico ao aplicado. Porto Alegre: Artmed, 2004. p.135-146.
SOUZA, Marina Rosa de. Tratamentos para superação de dormência em sementes florestais da mata atlântica. 2019. 40. Trabalho de Conclusão de Curso (Graduação em Engenharia Florestal) – Faculdade Pitágoras, Teixeira de Freitas, 2019.
Publicado por: Marina Rosa de Souza
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.