Avaliação do efeito protetor da farinha da casca de maracujá (Passiflora edulis Var. flavicarpa) na esteatose hepática não alcoólica induzida por frutose
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. MATERIAIS E MÉTODOS
- 4. Obtenção da farinha
- 5. Preparo da ração suplementada com farinha da casca de P.edulis
- 6. Animais
- 7. Tratamento (dieta)
- 8. Consumo de ração, hídrico e peso
- 9. Medida da circunferência da cintura
- 10. Consumo calórico
- 11. Coleta de sangue circulante
- 12. Parâmetros bioquímicos
- 13. Histologia
- 14. Lipídios totais no fígado
- 15. Análise estatística
- 16. RESULTADO E DISCUSSÃO
- 17. REFERÊNCIAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
A doença hepática gordurosa não alcoólica (DHGNA) é caracterizada por excesso de lipídios nos hepatócitos, podendo ser induzida pelo consumo excessivo de carboidratos, especialmente frutose. Diante disto, o presente estudo teve como objetivo avaliar o efeito protetor da farinha de casca de maracujá amarelo (P. edulis) na esteatose hepática não alcoólica induzida por frutose. Foram utilizados 19 ratos Wistar distribuídos em três grupos: controle; frutose e frutose + farinha de maracujá (FCM). Semanalmente foram verificados o consumo de ração, hídrico e peso corporal dos animais. Ao final do estudo, realizou-se eutanásia por punção da aorta abdominal. A partir do sangue coletado foram realizadas determinações bioquímicas. O fígado foi extraído para avaliação histológica e para mensuração de colesterol e triglicerídeos. Os resultados demonstram que 10% de frutose na água de beber induz esteatose hepática sem alterar significativamente os valores das enzimas hepáticas AST, ALT e FAL. Adicionalmente, as concentrações de colesterol e triglicerídeos hepáticos, embora sem resultado estatístico, mostram que o grupo frutose apresenta concentrações acima de 5% na deposição de lipídeos quando comparado com o grupo controle. A esteatose hepática foi confirmada por meio de análise histológica, onde foi possível verificar que o grupo tratado com frutose apresentou alteração característica de esteatose hepática focal e macrogoticular. O tratamento com farinha de casca de maracujá foi capaz de proteger contra os danos hepáticos. Juntos, os dados aqui obtidos demostram que a suplementação com farinha de casca de maracujá é capaz de atenuar os malefícios provocados pela frutose.
Palavras-chave: fígado gorduroso, frutose, Passiflora.
ABSTRACT
The nonalcoholic fatty liver disease (NAFLD) is characterized by excess lipids in hepatocytes that could be induced by excessive consumption of carbohydrates especially fructose. In view of this, the present study had as an aim evaluating the protective effect of yellow passion fruit peel flour (P. edulis) in nonacoholic hepatic steatosis induced by fructose. 19 Wistar rats were divided into three groups: control; fructose and fructose + passion fruit peel flour (PFPF). It was observed feed and water intake and body weight of the animals weekly. At the end of the study, it was performed euthanasia by puncturing the abdominal aorta. Biochemical determinations were performed by collecting blood. The liver was extracted for histologic evaluation and measurement of cholesterol and triglycerides. The results show that 10% of fructose in drinking water induces hepatic steatosis without significantly changing the values of liver enzymes AST, ALT and FAL. In addition, the concentrations of cholesterol and hepatic triglycerides, although no statistical results, show that fructose group presents concentrations above 5% in the lipid deposition compared with the control group. Hepatic steatosis was confirmed by histological analysis, where the group treated with fructose showed characteristic changes of focal and macrogoticular hepatic steatosis. The treatment with passion fruit peel flour was able to prevent liver damage. Together, the data obtained here demonstrate that supplementation with passion fruit peel flour is able to attenuate the damage caused by fructose.
Keywords: fatty liver, fructose, Passiflora.
2. INTRODUÇÃO
Os açúcares de adição (monossacarídeos, dissacarídeos e alguns oligossacarídeos) podem conferir aos alimentos paladar agradável, melhor viscosidade, textura, cor e durabilidade. Com essa função, a frutose pode ser incorporada em muitos produtos alimentícios, como: frutas enlatadas, geleias, doces em pasta, bolos, pudins, tabletes, pó para bebidas, refrigerantes, entre outros, visto, também, que essa molécula confere um sabor 1,5 vezes mais doce do que a sacarose (1,2).
Estudos experimentais em animais e humanos evidenciam que o excesso na ingestão de frutose pode provocar o desenvolvimento de síndrome metabólica e das complicações associadas como a doença hepática gordurosa não alcoólica (DHGNA), caracterizada como um acúmulo lipídico nos hepatócitos, principalmente na forma de triglicerídeos, sem ingestão de quantidades significativas de álcool e com a isenção de outras razões conhecidas, como algumas drogas e toxinas (3-8).
A DHGNA possui amplo espectro clínico-histológico abrangendo a esteatose, a esteatohepatite que inclui esteatose juntamente com inflamação e fibrose, e, por fim, em estágio terminal, a cirrose (9). A fisiopatologia da esteatose hepática não alcoólica ainda não está completamente elucidada. No entanto, sabe-se que o acúmulo de lipídios pode ser proveniente do transporte dos ácidos graxos ao fígado em quantidade acima da capacidade de oxidação mitocondrial para produção de energia associado à redução na síntese de apoproteínas e diminuição na produção e exportação de lipoproteínas pelo hepatócito (10-12).
No que se refere a enfermidades, o tratamento com o uso de produtos naturais é prática milenar, sendo o maracujá um exemplo muito popular no Brasil, já que este país é o maior produtor do mundo deste fruto (13,14). O maracujá amarelo (Passiflora edulis Var. Flavicarpa) é o mais cultivado no território brasileiro, resultando em quantidades exorbitantes de sementes e cascas (15). Já que em média 52% do peso total do fruto é composto por casca, a reutilização na forma de farinha através do enriquecimento de vários produtos alimentícios torna-se uma alternativa sustentável, econômica e nutricionalmente interessante (14).
A casca do maracujá é abundante em fibras solúveis, sendo notória a pectina, presente no albedo (parte branca) que auxilia na diminuição da taxa de glicose e colesterol no sangue. É também rica em niacina (vitamina B3), ferro, cálcio e fósforo (14,16). Adicionalmente, estudos demonstram que a casca do maracujá apresenta compostos fenólicos com ação antioxidante e anti-inflamatória (17,18).
Desta forma, diante da escassa quantidade de publicações frente aos benefícios da farinha da casca de P. edulis e perante o aumento no consumo de alimentos enriquecidos com frutose, o presente artigo teve como objetivo avaliar o efeito protetor da farinha de casca de P. edulis na esteatose hepática não alcoólica induzida por frutose em ratos.
3. MATERIAIS E MÉTODOS
4. Obtenção da farinha
A farinha da casca de maracujá (P. edulis) foi disponibilizada pela empresa Vitalin® de Jaraguá do Sul (SC), juntamente com o laudo da análise microbiológica (Material complementar).
5. Preparo da ração suplementada com farinha da casca de P.edulis
A ração Biotec ratos e camundongos®, comercializada pela empresa Biobase® foi moída e então foram adicionados 30% de farinha da casca de maracujá. Após a homogeneização foi umedecida com água purificada para confecção da nova ração contendo farinha da casca do maracujá (19). Então, foi mantida em estufa com ventilação a 50ºC por 24 horas (20). Permaneceu acondicionada em recipiente e temperatura ambiente durante todo o período experimental (21). Abaixo informações obtidas dos fornecedores:
|
INFORMAÇÃO NUTRICIONAL |
|
|
FARINHA DE MARACUJÁ |
|
|
Porção de 30g (3 colheres de sopa) |
|
|
Quantidade por porção |
|
|
Valor energético |
33 kcal = 140 kJ |
|
Carboidratos |
6,2g |
|
Proteínas |
1,6g |
|
Gorduras totais |
0g |
|
Gorduras saturadas |
0g |
|
Gorduras trans |
0g |
|
Fibra alimentar |
18g |
|
Sódio |
30g |
|
INFORMAÇÃO NUTRICIONAL |
|
|
RAÇÃO BIOBASE ROEDORES |
|
|
Porção de 1000g |
|
|
Proteína bruta (mín.) |
220,0g |
|
Cálcio (mín.) |
10,0g |
|
Cálcio (máx.) |
14,0g |
|
Fósforo (min.) |
8.000,0g |
|
Extrato etéreo (mín.) |
40,0g |
|
Matéria fibrosa (máx.) |
80,0g |
|
Matéria mineral (máx.) |
100,0g |
|
Umidade (máx.) |
120,0g |
6. Animais
Para a realização dos experimentos foram utilizados ratos Wistar (Rattus novergicus albinus) machos com 21 dias após o período de desmame. Os animais foram fornecidos pelo Biotério da Universidade do Vale do Itajaí e foram mantidos em ambiente enriquecido, com ciclo de luz, em cama de maravalha, temperatura e umidade controlados, bem como acesso a alimento e água ad libitum (21). Todos os experimentos foram realizados de acordo com os princípios éticos de experimentação animal recomendados pelo Conselho Nacional de Controle de Experimentação Animal (CONCEA). Os animais foram submetidos a processos cirúrgicos para retirada do fígado e coleta de sangue. Receberam como agente anestésico quetamina (90 mg/kg, i.p.) e xilazina (10 mg/kg, i.p.) (22). O trabalho foi aprovado pelo Comitê de Ética no Uso de Animais da Universidade do Vale do Itajaí (Protocolo número CEUA 014/15).
7. Tratamento (dieta)
Ratos Wistar foram separados em grupos (n = 6-7), os quais receberam: 1) ração e água normais (grupo controle), 2) ração normal e água com 10% de frutose (grupo frutose) e 3) ração suplementada com farinha de casca de P. edulis e água com 10% de frutose (grupo frutose + farinha de casca de maracujá [FCM]). Cada grupo continha 6 ratos, com exceção do grupo frutose + FCM que tinha 7. A reposição de ração foi realizada a cada dois dias. A frutose foi adicionada a água de beber dos animais, sendo trocada a cada 2 dias juntamente com a ração (23).
8. Consumo de ração, hídrico e peso
Durante o período da dieta os animais foram avaliados com relação ao consumo de ração e hídrico a cada 2 dias. O peso era aferido uma única vez semanalmente (23).
9. Medida da circunferência da cintura
Antes do início do experimento e ao final das oito semanas foi mensurada a circunferência abdominal dos animais. A medida foi realizada com o animal em decúbito ventral com auxilio de fita métrica na região correspondente a linha acima da crista ilíaca. O ganho de circunferência em centímetros foi calculado com base na circunferência final e inicial (23).
10. Consumo calórico
Foi mensurada a quantidade média de calorias consumida pelos animais ao final do experimento com base nas informações nutricionais fornecidas pelos fabricantes dos produtos (ração animal Biobase® e farinha da casca de maracujá Vitalin®).
11. Coleta de sangue circulante
Ao final das oito semanas de tratamento os animais foram colocados em jejum por 8 horas e após este período foram anestesiados. O sangue circulante foi obtido a partir da punção da aorta abdominal. Para as análises bioquímicas foi utilizado tubo seco, para obtenção de soro. Após a retirada do sangue dos animais, os mesmos foram eutanasiados (24,25).
12. Parâmetros bioquímicos
No sangue circulante dos animais foram determinados os parâmetros bioquímicos: colesterol total (CT), lipoproteína de alta densidade (HDL), fosfatase alcalina (FAL), alanina aminotransferase (ALT), aspartato aminotransferase (AST) e triglicerídeos (TG) de acordo com as instruções dos fabricantes. Adicionalmente foi determinado o índice de aterosclerose através do cálculo (colesterol total – HDL) ÷ HDL (24,26).
13. Histologia
O fígado foi fixado em solução de formol 10% onde ficou imerso por 48 horas e após este período foi imerso em uma solução de álcool 70%. Posteriormente, o órgão foi emblocado e cortado (7 μm de espessura) em micrótomo de maneira semi-seriada. As lâminas obtidas segundo esse processo foram submetidas à coloração por hematoxilina-eosina para análise morfológica (22).
14. Lipídios totais no fígado
Foi utilizado o método de extração proposto por Folch et al. (1957) para extração do colesterol e triacilgliceróis hepáticos. Neste método, 100 mg de fígado foram triturados durante 3 minutos com 1900 L de solução clorofórmio-metanol 2:1. Depois deste procedimento, o material triturado foi adicionado de 400 L de metanol. Este material foi então centrifugado a 3.000 rotações por minuto (rpm), durante 10 minutos. O sobrenadante foi transferido para outro tubo e adicionado de 800 L de clorofórmio e 640 L de solução NaCl a 0,73%. Após este procedimento, houve nova centrifugação a 3.000 rpm durante 10 minutos. Desta vez, descartou-se o sobrenadante e o precipitado foi lavado por três vezes com a solução de Folch (3% de clorofórmio, 48% de metanol, 47% de água, 2% de NaCl a 0,2%). Os extratos lipídicos foram secos em estufa a 37ºC. O extrato lipídico seco foi ressuspenso com 1 mL de isopropanol e procedeu-se da mesma forma utilizando kit enzimático para as análises de triglicerídeos e colesterol (27).
15. Análise estatística
Os resultados obtidos nos experimentos foram expressos em média ± erro padrão da média (e.p.m.) e analisados estatisticamente pela análise de variância com comparações múltiplas (ANOVA) e, quando necessário, foi utilizado como pós-teste o teste de Tukey-Kramer. Para comparação entre apenas dois grupos foi utilizado o t test. Os dados foram analisados no programa GraphPad Prism 6, admitindo como significativamente estatístico p < 0,05 (28).
16. RESULTADO E DISCUSSÃO
A DHGNA é determinada como um excesso de triglicerídeos e ácidos graxos no hepatócito, sem associação ao uso de bebidas que contém álcool, porém, com características histológicas semelhantes à hepatopatia alcoólica (29-31).
Pode ser classificada como uma esteatose simples, mas também como esteato-hepatite que além de apresentar grande concentração de lipídios no parênquima hepático também manifesta inflamação intralobular, balonismo hepatocelular e pode estar acompanhada por fibrose progressiva. Este quadro pode evoluir para outras complicações hepáticas como cirrose e carcinoma (32-37).
Os dados obtidos no presente trabalho demonstram que animais submetidos ao consumo de frutose (10%) na água de beber durante oito semanas apresentam sinais característicos de DHGNA. Os ratos do grupo frutose apresentaram tendência de aumento de colesterol e triglicerídeo hepático (Figura 1). É importante ressaltar que um aumento de 5% no colesterol e triglicerídeos hepáticos com relação ao controle já é considerado indício de esteatose hepática (38,39). No presente estudo com relação ao colesterol houve um aumento de 143,0437% e de triglicerídeos 280,948% do grupo frutose em relação ao grupo controle (Figura 1).
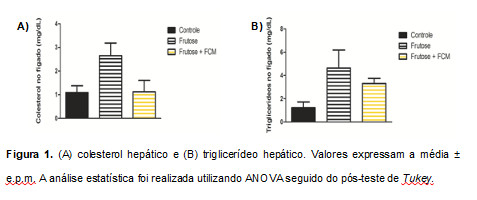
Figura 1. (A) colesterol hepático e (B) triglicerídeo hepático. Valores expressam a média ± e.p.m. A análise estatística foi realizada utilizando ANOVA seguido do pós-teste de Tukey.
Os dados obtidos na análise bioquímica de colesterol e triglicerídeos hepáticos corroboram com os dados obtidos na análise histológica, onde pode-se observar alterações nas células hepáticas no grupo frutose. A alteração é característica de esteatose hepática focal e macrogoticular (Figura 2).
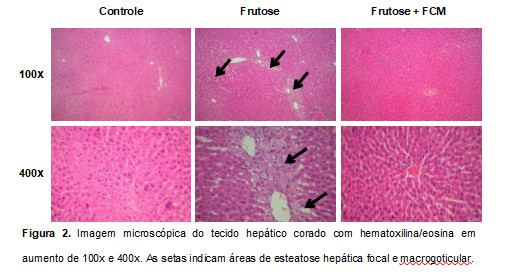
Figura 2. Imagem microscópica do tecido hepático corado com hematoxilina/eosina em aumento de 100x e 400x. As setas indicam áreas de esteatose hepática focal e macrogoticular.
Adicionalmente foram avaliadas as enzimas hepáticas transaminases (ALT e AST) e FAL, as quais são importantes indicadores de lesões nas células hepáticas e as análises das mesmas são muito importantes (40). Os dados obtidos demonstram que o consumo de frutose 10% não induziu alterações significativas nos níveis de ALT, AST e FAL (Figura 3).
De fato, dados da literatura reportam que a dosagem das concentrações de enzimas hepáticas não é um bom parâmetro para avaliar a presença de DHGNA, visto que, há a possibilidade do individuo apresentar alterações no tecido hepático sem apresentar alterações no perfil enzimático (41). Em dois estudos controlados, ao avaliarem as enzimas hepáticas, os autores encontraram aumento apenas de ALT em indivíduos com dieta rica em frutose comparado a indivíduos que tinham dieta para a manutenção de peso. Todavia, em um outro ensaio clínico randomizado, os autores não observaram diferença significativa neste parâmetro utilizando o mesmo modelo experimental. Pesquisas realizadas com o objetivo de avaliar os efeitos de dietas ricas em frutose associadas com dietas ricas em gordura em homens sem doença, como a obesidade, verificaram que a dieta apenas com alto teor de frutose não altera os valores séricos de ALT, contudo, esta mesma dieta associada à dieta rica em lipídios aumentou os níveis desta enzima (42-47).
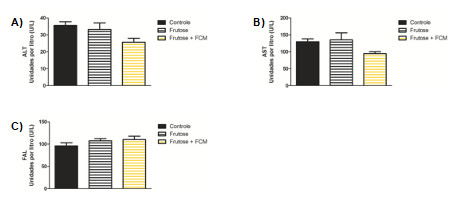
Figura 3. Valores de dosagens séricas de enzimas hepáticas após oito semanas de experimento. (A) alanina aminotransferase (ALT); (B) aspartato aminotransferase (AST); (C) fosfatase alcalina (FAL). Valores expressam a média ± e.p.m. A análise estatística foi realizada utilizando ANOVA seguido do pós-teste de Tukey.
Ao avaliar o consumo alimentar, foi possível verificar que o grupo frutose + FCM teve o menor consumo de ração. Uma possível explicação para esse efeito pode estar relacionada à presença de fibras, especialmente a pectina, a qual aumenta a saciedade (48).
Em uma pesquisa onde uma população de várias etnias recebeu fibras em forma de tabletes demonstrou que as fibras mais viscosas como a pectina reduziram o apetite quando comparadas às fibras com menor viscosidade (49).
Quando os grupos foram avaliados quanto ao consumo hídrico, o grupo controle apresentou menor ingestão comparado aos outros grupos. A literatura não traz informações sobre a influência de dieta com frutose na ingestão hídrica de animais. Ratos Wistar que receberam dieta rica em frutose (60%) não tiveram resultado significativo de ingestão hídrica ao serem comparados com o grupo controle que recebia dieta semipurificada balanceada – AIN93G (50).
Comparado com o grupo tratado com frutose e farinha de casca de maracujá, o grupo frutose obteve aumento significativo de peso. Isto pode estar relacionado ao fato de que as fibras substituem as calorias da dieta e reduzem a absorção de alguns alimentos no intestino delgado (49). Adicionalmente, pode ter relação com o fato de o grupo frutose + FCM ter o menor consumo calórico e o menor aumento de circunferência de cintura dentre os grupos. O consumo calórico de frutose não teve diferença estatística entre os grupos.
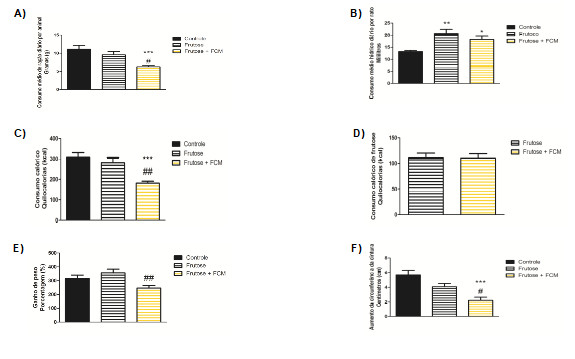
Figura 4. Dados obtidos durante a execução do experimento. (A) consumo alimentar; (B) consumo hídrico; (C) consumo energético (D) consumo calórico a partir da frutose (E) ganho de peso e (F) aumento da circunferência da cintura. Valores expressam a média ± e.p.m. A análise estatística foi realizada utilizando ANOVA seguido do pós-teste de Tukey. *p<0,05 vs. grupo controle; **p<0,01 vs. grupo controle; ***p<0,001 vs. grupo controle; #p<0,05 vs. grupo frutose; ##p<0,01 vs. grupo frutose; ###p<0,001 vs. grupo frutose. Para análise do consumo calórico de frutose foi utilizado o t test.
Com relação ao perfil bioquímico o grupo frutose apresentou aumento significativo de triglicerídeos séricos comparado ao grupo controle. Esta característica não foi observada no grupo controle + FCM (Figura 5). Com relação ao demais parâmetros não foram verificadas alterações significativas.
Sabe-se que a pectina é capaz de diminuir os níveis de triglicerídeo no sangue a partir da formação de um gel que impede a absorção de nutrientes oriundos da dieta. Em um estudo pré-clínico em 2005 utilizando hamsters tratados com a fibra da farinha da semente do maracujá amarelo, observou-se diminuição nos triglicerídeos, colesterol sérico e hepático (51-53).
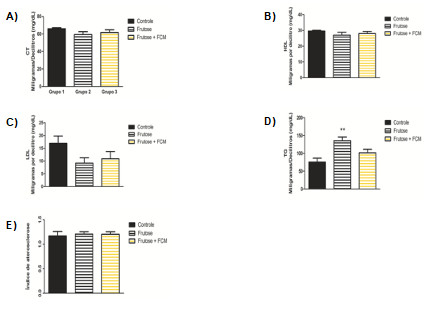
Figura 5. Lipidograma dos animais a partir do sangue coletado da aorta abdominal. (A) colesterol total (CT); (B) lipoproteínas de alta densidade (HDL); (C) lipoproteínas de baixa densidade (LDL); (D) triglicerídeos (TG); (E) índice de aterosclerose. Valores expressam a média ± e.p.m. A análise estatística foi realizada utilizando ANOVA seguido do pós-teste de Tukey. **p < 0,01 vs. grupo controle. **p<0,01 vs. grupo controle.
Juntos, os dados obtidos demonstram que a frutose adicionada à água de beber dos animais mesmo em concentração inferior às que geralmente são encontradas na literatura é capaz de gerar danos ao fígado por meio do acúmulo de gordura nos hepatócitos, o que é caracterizado como esteatose hepática não alcoólica.
A suplementação com farinha de casca de maracujá amarelo pode atenuar os malefícios provocados pela frutose. Uma das possíveis explicações seria a presença da pectina, fibra solúvel presente na casca do maracujá, que é capaz de substituir calorias da ração, promover saciedade e diminuir a absorção de nutrientes como lipídios e carboidratos.
Mais estudos precisam ser realizados a fim de elucidar o mecanismo no qual a farinha da casca de maracujá pode prevenir a DHGNA. Para tal, os metabólitos secundários da casca deste fruto precisam ser considerados.
17. REFERÊNCIAS
1 - Ferreira VF, da Rocha DR, da Silva FC. Potencialidades e oportunidades na química da sacarose e outros açúcares. Quím. Nova, v. 32, n. 3. 2009.
2 - Gaino NM, da Silva MV. Consumo de frutose e impacto na saúde humana. Segur. Aliment. Nutr. v. 18, n. 2. 2011.
3 - Hwang IS, Ho H, Hoffman BB, Reaven GM. Fructose-induced insulin resistance and hypertension in rats. Hyperten., v. 10, n. 5. 1987.
4 - Ackerman Z, Oron-Herman M, Rosenthal MGT, Pappo O, Link G, Sela BA. Fructose-Induced Fatty Liver Disease: Hepatic effects of blood pressure and plasma triglyceride reduction. Hyperten., v. 45, n. 5. 2005.
5 - Miller A, Adeli K. Dietary fructose and the metabolic syndrome. Curr Opin Gastroenterol, v. 24, n. 2. 2008
6 - Ferreira SS. Frutose e Síndrome Metabólica. 2010. Trabalho de Iniciação Científica (Monografia). Faculdade de Ciências da Nutrição e Alimentação. Universidade do Porto. Porto. 2010.
7 - Castro GS, Cardoso JF, Vannucchini H, Zucoloto S, Jordão AA. Fructose and NAFLD: metabolic implications and models of induction in rats. Acta Cir Bras. v. 26. n. 2. 2011.
8 - Souza MR de A, DINIZ M de FF de M, de Medeiros-Filho JEM, de Araújo MST. Metabolic syndrome and risk factors for non-alcoholic fatty liver disease. Arq Gastroenterol., v. 49, n. 1. 2012
9 - Vos MB. Nutrition, nonalcoholic fatty liver disease and the microbiome: recente progress in the field. Curr Opin Lipidol. v. 5, n. 1. 2014.
10 - Evia JRB. Esteatosis hepatica, esteatohepatitis y marcadores de lesión hepática. Rev Mex Patol Clin. v. 55, n. 4. 2008
11 - Castro GSF, Mialich MS, Anjos EM, Almeida LP, Arroyo, PF, Portari GV, Jordão Jr AA. Caracterização da esteatose hepática não alcoólica induzida por dieta hipoproteica em ratos. Rev Med, v. 42, n.1. 2009.
12 - Gomes ACS, Jardim BG, Alves MAR. Doença hepática gordurosa não alcoólica e síndrome metabólica: aspectos nutricionais. Alm multidis pesq, v. 1, n. 2. 2014.
13 - Gomes CS, Campos ACL, Torres OJM, de Vasconcelos PRL, Moreira ATR, Tenório SB, Tâmbara EM, Sakata K, Moraes Júnior H, Ferrer ALS Efeito do extrato de Passiflora edulis na cicatrização da parede abdominal de ratos: estudo morfológico e tensiométrico. Acta Cir Bras, v. 21, n. 2. 2006.
14 – da Silva ECO, da Silva WP, da Silva ET, Lopes JD, de Gusmão RP. Obtenção e caracterização da farinha do albedo de maracujá (Passiflora edulis f. Flavicarpa) para uso alimentício. Rev Verde, v. 11, n. 3. 2016.
15 – Coelho EM, de Azevêdo LC,Umza-Guez MA. Fruto do maracujá: importância econômica e industrial, produção, subprodutos e prospecção tecnológica. Cad. Prospec., v. 9, n. 3. 2016.
16 – Zeraik ML, Pereira CAM, Zuin VG, Yariwake JH. Maracujá: um alimento funcional? Rev. bras. farmacogn., v. 20, n. 3. 2010
17 - Zeraik ML, Yariwake JH, Wauters JN, Tits M, Angenot L.. Analysis of passion fruit rinds (Passifl ora edulis): isoorientin quantifi cation by HPTLC and evaluation of antioxidant (radical scavenging) capacity. Quím. Nova, v. 35, n.3. 2012.
18 – Cazarin CBB, da Silva JK, Colomeu TC, Zollner R de L, Maróstica Junior MR. Capacidade antioxidante e composição química da casca de maracujá (Passiflora edulis). Cien Rural, v. 44, n. 9. 2014.
19 – Santos JPS de O. Dieta de cafeteria: produção, composição nutricional e influência na glicemia de jejum em modelo animal. 2016. Trabalho de Iniciação Científica (Monografia). Natal. 2016.
20 – Marinelli PS. Farinhas de moringa (Moringa Oleifera Lam.) e ora-pro-nóbis (Pereskia aculeata Mill.): Biomateriais funcionais. 2016. Tese (Doutorado em Ciência e Tecnologia de Materiais). Bauru. 2016.
21 – Alencar AM da S, da Silva RV, Oliveira VXA, Brutti CEQ. Influência do enriquecimento ambiental e da cenoura como fontes alternativas na dieta e reprodução de ratos Wistar. Caderno cien biol saúde, n. 5. 2014.
22– Beltrão FE de L. Alopurinol na prevenção da esteato-hepatite não alcoólica e hiperglicemia induzida por dieta rica em frutose em ratos Wistar. 2012. Dissertação (Mestrado). Mestre em Ciência da Nutrição. João Pessoa. 2012.
23 – Mamikutty N, Thent ZC, Sapri SR, Sahruddin NN, Yusof MRM, Suhaimi FH. The establishment of metabolic syndrome model by induction of fructose drinking water in male Wistar rats. BioMed Res Inter. 2014.
24 – Melo MGD, Doria GAA, Serafini MR, Araujo AAS. Valores de referência hematológicos e bioquímicos de ratos (Rattus novergicus linhagem Wistar) provenientes do biotério central da Universidade Federal de Sergipe. Sci Plena, v. 8, n. 4. 2012
25 – dos Reis SA. Efeito do consumo de kefir de leite integral sobre o desenvolvimento de lesões pré-neoplásicas intestinais em ratos Wistar. 2015. Dissertação (Mestrado). Minas Gerais. 2015
26 – Petersen KE, Lykkesfeldt J, Raun K, Rakipovski G. Plasma lipid oxidation predicts atherosclerotic status better than cholesterol in diabetic apolipoprotein E deficient mice. Exp Biol Med, 2016.
27 – Folch J, Lees M, Stanley GHS. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem., v. 226, n. 1. 1957.
28 – Marques A de CR, Gabbiatti GC, Gravena AAF, do Amaral V. Influência das dietas hipercalóricas sobre os parâmetros de obesidade, dislipidemia e hiperglicemia em ratos. Saud Pesq, v. 8, n.1. 2012.
29 – Cuadrado A, Orive A, García-Suárez C, Domínguez A, Fernandéz-Escalante JC, Crespo J, Pons-Romero F. Non-alcoholic steatohepatitis (NASH) and hepatocellular carcinoma. Obes Surg., v. 15, n. 3. 2005.
30 – Zhou YJ, Li YY, Nie YQ, Ma JX, Lu LG, Shi SL, Chen MH, Hu PJ. Prevalence of fatty liver disease and its risk factors in the population of South China. World J Gastroenterol, v. 13, n. 47. 2007.
31 - Schulz PO. Associação de Doença Hepática Gordurosa Não Alcoólica com Neoplasias Malignas do Fígado. 2013. Dissertação (Mestrado). São Paulo, 2013.
32 – Powell EE, Cooksley WGE, Hanson R, Searle J, Halliday JW, Powell LW. The natural history of nonalcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology, v. 11, n. 1. 1990.
33 – Harrison AS, Torgerson S, Hayashi PH. The natural history of nonalcoholic fatty liver disease: a clinical histopathological study. Am J Gastroenterol, v. 9, n. 98. 2003.
34 - Takahashi Y, Fukusato T. Pathology of nonalcoholic steatohepatitis. Hepatol Res, v. 2, n. 33. 2008.
35 - Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights. Science., v. 332, n. 6037. 2011.
36 - Takahashi Y, Soejima Y, Fukusato T. Animal models of nonalcoholic fatty liver disease/ nonalcoholic steatohepatitis. World J Gastroenterol., v. 18, n. 19. p. 2300-2308. 2012.
37 - Elitok, B. Efficacy of herbal remedies in the treatment of nonalcoholic fatty liver disease/ hepatic steatosis in human and animals. Kocatepe Vet J, v. 5, n. 2, p. 49-53. 2012.
38 – Gaemers IC, Groen AK. New insights in the pathogenesis of non-alcoholic fatty liver disease. Curr Opin Lipidol, v. 3, n. 17.. 2006.
17.1. 39 – Softic S, Cohen DE, Kahn CR. Role of dietary fructose and hepatic de novo lipogenesis in fatty liver disease. Dig Dis Sci., v. 5, n. 61. 2016.
40 - Costa JP, Lourenço NV, Santos CC de MP, Tomé A da R, de Sousa GF,
de Sousa DP, de Almeida RN, de Freitas RM. Avaliação da toxicidade aguda e
das alterações histopatológicas em camundongos tratados com fitol. Rev
Ciênc Farm Básica Apl., v. 33, n.3. 2012.
41 - Pinto CG de S, Marega M, Carmona FG, D’aurea C, de Carvalho JAM, Figueira Junior A. Esteatose hepática e estilo de vida ativo: Revisão de literatura. Rev bras Ci e Mov., v. 20, n. 3. 2012.
42 – Couchepin C, Lê K-A, Bortolotti M, da Encarnação JA, Oboni J-B, Tran C, Schneiter P, Tappy L. Markedly blunted metabolic effects of fructose in healthy Young female subjects compared with male subjects. Diabetes Care, v. 31, n. 6. 2008
43 - Lê K-A, Ith M, Kreis R, Faeh D, Bortolotti M, Tran C, Boesch C, Tappy L. Fructose overconsumption causes dyslipidemia and ectopic lipid deposition in healthy subjects with and without a family history of type 2 diabetes. Am J Clin Nutr., v. 6, n. 89. 2009.
44 – Sock ETN, Lê K-A, Ith M, Kreis R, Boesch C. Effects of a short-term overfeeding with fructose or glucose in healthy young males. Br J Nutr., v. 7, n. 103. 2010.
45 – Sobrecases H, Lê K-A, Bortolotti M, Schneiter P, Ith M, Kreis R, Boesch C, Tappy L. Effects of short-term overfeeding with fructose, fat and fructose plus fato on plasma and hepatic lipids in healthy men. Diabetes Metab., v. 3, n. 26. 2010.
46 – Perez-Pozo SE, Schold J, Nakagawa T, Sánchez-Lozada LG, Johnson RJ, Lillo JL. Excessive fructose intake induces the features of metabolic syndrome in healthy adult men: role of uric acid in the hypertensive response. Int J Obes., v. 34, n. 3. 2010.
47 – Ferolla SM, Silva LC, Ferrari M de LA, da Cunha AS, Martins F dos S, Couto CA, Ferrari TCA. Dietary approach in the treatment of nonalcoholic fatty liver disease. World J Hepatol, v. 7, n. 24. 2015.
48 - 48 - Salles GF, Bloch KV, Cardoso CRL. Mortality and predictors of mortality in a cohort of brazilian type 2 diabetic patients. Diabetes Care, v. 6, n. 27. 2004.
49 – Bernaud FSR, Rodrigues TC. Fibra alimentar – Ingestão adequada e efeitos sobre a saúde do metabolismo. Arq. Bras. Endocrinol. Metab., v. 57, n. 6. 2013.
50 - de Moura RF, Cambri LT, de Quadros Junior AC, Nascimento CMC, Arantes LM, Sebastião E, Tanaka K, Papini CB, Oliani MM, Mota CS de A, Ribeiro C, Melo MAR. Capacidade aeróbica de ratos alimentados com dieta rica em frutose. Rev. Bras. Med. Esporte, v. 14, n. 5. 2008.
51 - Fietz VR, Salgado JM. Efeito da pectina e da celulose nos níveis séricos de colesterol e triglicerídeos em ratos hiperlipidêmicos. Ciênc. Tecnol. Aliment., v. 19, n. 3. 1999.
52 - D’Addosio R, Páez G, Marín M, Mármol Z, Ferror J. Obtención y caracterización de pectina a partir de la cáscara de parchita (Passiflora edulis f. flavicarpa Degener). R. Fac. Agron., v. 22, n. 3. 2005.
53 – Santos HV, Fonseca JM, Freitas RF, Royo V de A. Caracterização laboratorial das dislipidemias e o uso de fitoterápicos. Multitexto, v. 3, n. 1. 2015.
Publicado por: Ana Paula De Martini Weber
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.