MACRÓFITAS AQUÁTICAS COMO FONTE DE NUTRIENTES
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. OBJETIVO
- 4. METODOLOGIA
- 5. Revisão de literatura
- 5.1 Eutrofização de reservatórios
- 5.2 NECESSIDADE DE REVEGETAÇÃO DE ÁREAS NO ENTORNO DE RESERVATÓRIOS
- 5.3 Comunidades de Macrófitas Aquáticas
- 5.4 Características benéficas para a comunidade aquática
- 5.5 Crescimento de Macrófitas Aquáticas em reservatórios eutrofizados
- 5.6 Monitoramento e manejo de macrófitas aquáticas
- 5.7 Estudos relacionados ao APROVEITAMENTO DE macrófitas aquáticas como fontes de nutrientes
- 6. Considerações finais
- 7. REFERÊNCIAS BIBLIOGRÁFICAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
O aumento da produtividade primária da comunidade fitoplanctônica e de biomassa de macrófitas aquáticas são algumas das principais consequências da eutrofização dos reservatórios d’água artificiais, decorrentes das mudanças no uso e ocupação do solo e carreamento excessivo de nutrientes a montante dos reservatórios. Por outro lado, as macrófitas aquáticas absorvem grande quantidade dos nutrientes responsáveis pelo processo de eutrofização, contribuindo assim para a fitorremediação dos reservatórios. O monitoramento do crescimento das plantas e o manejo, com a remoção das mesmas, são práticas necessárias para a manutenção da qualidade da água nos reservatórios. A grande quantidade de biomassa produzida torna essas plantas como fontes potenciais de matéria orgânica e nutrientes. Vários estudos corroboram com o uso de macrófitas aquáticas na recuperação do solo, ou como fonte de nutrientes que contribuem para o desenvolvimento de espécies arbóreas em áreas degradadas adjacentes aos reservatórios. Esta revisão bibliográfica aborda o papel das macrófitas aquáticas, como insumo adicional para a melhoria do solo e crescimento vegetal nas Áreas de Preservação Permanente formadas nos entornos dos reservatórios, contribuindo para a destinação ecologicamente adequada dessas plantas.
Palavras-chave: Reservatórios d’água artificiais. Eichhornia crassipes. Recuperação de Áreas de Preservação Permanente.
ABSTRACT
The increase in the primary productivity of the phytoplankton community and the biomass of aquatic macrophytes are some of the main consequences of the eutrophication of artificial water reservoirs, resulting from changes in the use and occupation of the soil and excessive nutrient loading upstream of the reservoirs. On the other hand, aquatic macrophytes absorb a large amount of nutrients responsible for the eutrophication process, thus contributing to the phytoremediation of reservoirs. The monitoring of plant growth and management, with their removal, are necessary practices to maintain the quality of water in the reservoirs. The large amount of biomass produced makes these plants potential sources of organic matter and nutrients. Several studies corroborate the use of aquatic macrophytes in soil recovery, or as a source of nutrients that contribute to the development of tree species in degraded areas adjacent to reservoirs. This literature review addresses the role of aquatic macrophytes, as an additional input for soil improvement and plant growth in Permanent Preservation Areas formed around the reservoirs, contributing to the ecologically appropriate destination of these plants.
Keywords: Artificial water reservoirs. Eichhornia crassipes. Recovery of Permanent Preservation Areas.
2. INTRODUÇÃO
Pesquisa do Projeto de Mapeamento Anual do Uso e Cobertura da Terra no Brasil indicou que, a dinâmica de uso da terra, baseada na substituição da floresta, para implantação de pecuária, agricultura e construção de represas, vem contribuindo para a diminuição do fluxo hídrico. Observou-se que, desde o início dos anos 90, a retração da superfície coberta com água no Brasil foi de 15,7%, significando um decréscimo de entorno 3,6 milhões de hectares em 2020. Para Souza Jr. (2021) [1] a dinâmica de uso da terra interfere no aumento da temperatura local e, muitas vezes, altera cabeceiras de rios e de nascentes, podendo também levar ao assoreamento de rios e lagos (MAPBIOMAS, 2021).
O interesse em armazenar água para atender aos usos múltiplos, tais como abastecimento humano, dessedentação de animais, geração de energia, navegação, preservação das comunidades aquáticas, irrigação, controle de cheias, entre outros, levou o homem a barrar os cursos d’água criando os reservatórios artificiais (INÁCIO, 2012; SANTOS & SOUZA, 2015).
A formação de reservatórios artificiais produz diferentes alterações nos ambientes aquático e terrestre que podem ser tanto benéficas como prejudiciais. Por isso, estudos sobre os impactos ambientais advindos dessas construções são indispensáveis para tomada de decisão antes do represamento de um rio. Dentro do contexto das bacias hidrográficas o represamento de rios, para formação de reservatórios de produção de energia, gera consideráveis impactos ambientais nos meios físico, biológico e antrópico (ESTEVES, 1988; NAIME, 2012).
A exploração dos recursos hídricos demanda uma forte articulação entre a base de pesquisa e conhecimento científico acumulado e as ações de gerenciamento e engenharia. Sem essa articulação que leve em conta a qualidade e a quantidade de água, poucos avanços conceituais podem ser realizados. Além disso, é preciso levar em conta não somente o sistema aquático, mas a bacia hidrográfica na qual ele se insere e os usos dessa unidade bacia hidrográfica-rio-lago ou reservatório. Sem esse conceito, há pouca probabilidade de um gerenciamento efetivo do sistema (TUNDISI, 2008).
Os distúrbios ambientais provocados em uma evolução pela exploração antrópica dos recursos naturais podem levar ao desequilíbrio dos ecossistemas aquáticos e, consequentemente, ao surgimento de ambientes favoráveis ao desenvolvimento da comunidade de macrófitas aquáticas (CEMIG, 2021).
Para Tucci & Mendes (2006), deve-se considerar que a intensificação dos usos das bacias hidrográficas aumenta o potencial de eutrofização e acelera o ciclo de aumento de biomassa, anoxia próxima do sedimento e incremento do fósforo e nitrogênio dissolvido e particulado. Também, consideram que a alteração da superfície da bacia tem impactos significativos sobre o escoamento, caracterizados pelos efeitos que provoca no comportamento das enchentes, nas vazões mínimas e na vazão média, além das condições ambientais locais e a jusante.
Para Pompeo (2008), embora o intenso e descontrolado crescimento da vegetação aquática possa se tornar um problema em muitos reservatórios, não é pertinente considerar apenas os aspectos negativos desse fato. É preciso reconhecer a importância biológica das macrófitas na dinâmica dos ecossistemas aquáticos e sua relevância como indicadoras do estado de conservação do ambiente e a condição do ecossistema.
Assim como a criação de reservatórios possui importância social e econômica, muitas vezes está acompanhada de problemas ecológicos devido à utilização desses sistemas como receptores de efluentes urbanos, agrícolas e industriais.
Os adensamentos urbano-industriais e pecuários, assim como as culturas agrícolas altamente dependentes de fertilizantes químicos, constituem fatores de poluição dos mananciais hídricos superficiais, ampliando os riscos de contaminação do ambiente subterrâneo. Esse fato compromete os usos múltiplos dos reservatórios, prejudicando desde o abastecimento público até a navegação e geração de energia (SCHEIBE et al., 2012).
A utilização de fertilizantes químicos e agrotóxicos na agricultura tem modificado drasticamente as características dos ecossistemas aquáticos continentais, esses eventos acabam introduzindo substâncias tóxicas na água, inviabilizando a utilização desse recurso, ou causando o fenômeno da eutrofização artificial, que além de reduzir a qualidade da água, produz alterações em todo o ecossistema (ESTEVES, 1998).
Pompêo (2017) se refere aos reservatórios como sistemas ecológicos de transição, com mecanismos de funcionamento específicos, dependentes da bacia de captação e de seus múltiplos usos. Suas características morfométricas e sua posição na bacia hidrográfica fazem com que funcionem como um acumulador de informações, as quais são decodificadas pelas comunidades biológicas ocasionando alterações na composição fitoplanctônica e zooplanctônica.
Os corpos hídricos, geralmente, possuem capacidade de responder ao aporte de nutrientes e matéria orgânica através do processo de autodepuração. No entanto, o lançamento excessivo de nutrientes à montante, pode alterar o metabolismo natural dos ecossistemas, que passam a receber e produzir uma quantidade de matéria orgânica além da sua capacidade de decomposição e assimilação, desequilibrando os processos de fotossíntese e decomposição. Este cenário caracteriza o processo de eutrofização artificial dos reservatórios (POMPÊO, 2017; ALMADA, 2018).
Segundo a ANA (2020), o fósforo encontrado nos corpos d’água tem como principais fontes os solos da bacia hidrográfica[2], os fertilizantes utilizados na agricultura, dejetos de criações animais e efluentes domésticos ou industriais. A erosão dos solos, sobretudo nas margens de rios, lagos e reservatórios representa uma importante fonte de poluição hídrica para estes corpos d’água, portanto o manejo adequado do solo é importante para o controle da poluição das águas por fósforo. O aumento do fósforo em ambientes lênticos pode ocasionar o crescimento excessivo de algas e plantas aquáticas e a consequente redução do oxigênio dissolvido na água, caracterizando o processo de eutrofização[3]. O enriquecimento das águas por fósforo também pode provocar a floração de algas com potencial de produzir toxinas perigosas para a saúde humana e animal.
O aumento da biomassa vegetal em função da alta concentração de nutrientes, principalmente fósforo e nitrogênio, provoca o aumento de decompositores aeróbios da matéria orgânica que se acumula nos açudes, aumentando a Demanda Bioquímica de Oxigênio (DBO).
O desenvolvimento das atividades humanas nas bacias hidrográficas tem aumentado as funções de transferência de sistemas terrestres para sistemas aquáticos e acelerado os coeficientes de exportação. O resultado das inúmeras descargas de água contaminada, poluída, com alta concentração de nitrogênio e fósforo é um processo acelerado de eutrofização cultural. A eutrofização pode ter consequências negativas, como, por exemplo, aumenta o teor de matéria orgânica nos sistemas, ocasionando concentrações indesejáveis de fitoplâncton (excesso de algas Cianofíceas) e macrófitas aquáticas (geralmente Eichhornia crassipes (Mart) Solms, Salvinia auriculata Aubl. e Pistia stratiotes L.), promove aumento de doenças de veiculação hídrica, queda na concentração de oxigênio dissolvido (COD) e prejudica a qualidade da água (TUNDISI et al. 1999; CETESB, 2021).
Almada (2018), entre outros, consideram que, em geral, a principal causa da eutrofização artificial dos corpos hídricos é o acréscimo nas concentrações de nitrogênio (N) e fósforo (P), já que estes estão entre os principais macronutrientes que limitam a produtividade primária[4] e suas disponibilidades influenciam a variedade e abundância dos organismos aquáticos.
O nitrogênio é um elemento de importância fundamental à vida dos organismos, uma vez que é parte integrante da molécula de proteína, e consequentemente, do protoplasma. Ao lado do fósforo, é considerado um dos mais importantes e limitantes à vida dos organismos de água doce (BOLLMANN et al, 2005).
O nitrogênio está presente nos ambientes aquáticos sob várias formas, por exemplo: nitrato (NO3-), nitrito (NO2-), amônia (NH3), íon amônio (NH4+), óxido nitroso (N2O), nitrogênio molecular (N2), nitrogênio orgânico dissolvido (peptídeos, purinas, aminas, aminoácidos, etc.), nitrogênio orgânico particulado (bactérias, fitoplâncton, zooplâncton e detritos). Dentre as diferentes formas, o nitrato, juntamente com o íon amônio assumem grande importância nos ecossistemas aquáticos, uma vez que representam as principais fontes de nitrogênio para os produtores primários. A eficiência de utilização do N pelas plantas é baixa, o que substanciaria as perdas para o ambiente relacionadas à volatilização da amônia, à lixiviação de nitrato e à emissão de óxido nitroso[5] (ESTEVES, 2011; VIEIRA, 2017).
O fósforo encontrado nos corpos d’água tem como principais fontes os solos da bacia hidrográfica, os fertilizantes utilizados na agricultura, dejetos de criações animais e efluentes domésticos ou industriais. A erosão dos solos, sobretudo nas margens de rios, lagos e reservatórios representa uma importante fonte de poluição hídrica para estes corpos d’água, portanto o manejo adequado do solo é importante para o controle da poluição das águas por fósforo (ANA, 2020 - 32/129p).
O uso e manejo do solo em bacias hidrográficas representam também alterações à semelhança dos registrados nas bacias. Dentre elas, destaca-se o desmatamento, que tende a aumentar a vazão média em função da diminuição da evapotranspiração, com aumento das vazões máximas e redução das vazões mínimas. Dessa forma, fica clara a necessidade de restabelecer a cobertura vegetal, principalmente as matas ciliares[6].
A cobertura vegetal, proporcionada pela preservação das matas ciliares, protege o solo, dissipando a energia da gota de chuva antes de atingir a sua superfície. Todavia, o valor da energia depende do tipo de vegetação, estágio de crescimento e cobertura percentual. Assim, a perda de solo é muito sensível à cobertura vegetal nas Áreas de Preservação Permanente (APP) (ZAKIA, 1998; SANTOS, 2013).
Segundo Naime (2012) a interação permanente entre o meio físico e os ecossistemas terrestre e aquático precisa ser analisada através de um enfoque interdisciplinar. As bacias hidrográficas representam a primeira expressão mais visível do meio físico.
O grande descontrole no aporte de nutrientes favorece a colonização de macrófitas aquáticas em extensas áreas ocasionando prejuízos a seus múltiplos usos. No entanto, com a adoção de um adequado programa de gestão e monitoramento é possível minimizar as consequências negativas da proliferação desenfreada. A ampla distribuição e a capacidade de colonizar novos ambientes, associadas às altas taxas de crescimento e à elevada capacidade de estocarem nutrientes, tornam esses vegetais potencialmente atrativos do ponto de vista econômico (HENRY-SILVA & CAMARGO, 2006).
Na maior parte das vezes, as novas áreas no entorno de reservatórios formados para produção de energia, passaram a ser legalmente consideradas Áreas de Preservação Permanente (APP) e precisam ser recuperadas visando à criação de um ambiente o mais próximo possível do original[7]. Nesse caso, está sendo considerada a recuperação das funções ecológicas e não a recuperação ambiental[8] Dessa forma têm-se serviços relacionados com características físicas, químicas e biológicas de solo.
Segundo Dias (2019), ao se considerar alguma das inúmeras inter-relações entre as características do substrato remanescente e o processo de revegetação torna-se evidente a importância dos procedimentos que envolvem o conhecimento real do material existente na área a ser recuperada. A visualização prévia das potenciais dificuldades reflete-se em economia de recursos e menor risco de dano ambiental.
As áreas marginais aos reservatórios, devido aos usos e manejo inadequados, geralmente apresentam solos compactados, ácidos e deficientes de nutrientes, atributos que representam uma barreira física e química à expansão do sistema radicular e estabelecimento das espécies nativas que deverão ser plantadas (DIAS et al., 2007)[9].
Aspecto igualmente importante do papel de raízes na recuperação de um solo refere-se à formação de agregados. Ao crescerem, as raízes aproximam as partículas minerais pelas pressões exercidas no seu avanço através dos poros do solo, extraem água e liberam substâncias orgânicas para a rizosfera, facilitando a formação de agregados e protegendo a matéria orgânica. Os produtos oriundos da senescência e raízes, fungos micorrízicos, principalmente, também atuam na estabilização de macro agregados (HAYNES & BEARE, 1996 cit. por DIAS, 2019).
Segundo Dieckow (s/d), uma forma de tentar reverter o grau de compactação do solo pode ser a adição de matéria orgânica sobre o solo. A matéria orgânica melhora a friabilidade do solo, aumentando seu limite de plasticidade. Isso significa que quanto maior o teor de matéria orgânica, menos plástico é o solo, e com isso menor a probabilidade de sofrer deformação plástica de compactação. Essa maior friabilidade, além de ajudar a minimizar problemas de compactação, possibilita melhores índices de germinação e emergência devido ao maior contato solo-semente[10].
Segundo Dias et al. (2007), o aumento da matéria orgânica em solos degradados também é responsável pela melhora de atributos físicos do solo, pois cria condições favoráveis à atividade biológica e estruturação de suas partículas de maneira a restabelecer a micro e macroporosidade e retenção de água no substrato.
A matéria orgânica é o principal reservatório de energia, carbono e nutrientes para sustentação da atividade biológica da maioria dos organismos heterotróficos do solo. Também, desempenha importante papel na resiliência dos ecossistemas, ou seja, à capacidade do sistema se autorecuperar de uma perturbação, retornando ao seu estado original (DIECKOW, s/d).
Inúmeras experiências e propostas de uso da massa vegetal das macrófitas aquáticas em excesso removidas dos reservatórios têm sido relatadas e comprovadas. No entanto, observa-se que o manejo da vegetação aquática é um dos grandes desafios a ser enfrentado pelos pesquisadores, visto que, ainda não existem técnicas padronizadas que podem ser utilizadas em todos os ecossistemas. Além disso, as necessidades de manejo, quando as macrófitas aquáticas causam prejuízos, e as diferentes funções ecológicas que esses vegetais desempenham, representam um paradoxo.
Nesse contexto, a aplicação das macrófitas como fonte de nutrientes na recuperação de solos alterados poderá ser uma alternativa estratégica para mitigar os efeitos da eutrofização no reservatório, assim como do risco de prejudicar seu uso prioritário de geração de energia. Por outro lado, a contribuição com matéria orgânica e riqueza de nutrientes deverá ser um insumo de crescimento de relevante importância para o estabelecimento das espécies nativas na recuperação florestal das margens do reservatório.
Há que se convir que, o aproveitamento do excedente de macrófitas aquáticas poderá conferir status de atividade econômica, social e ambiental ao processo de remoção mecânica da biomassa de macrófitas aquáticas dos reservatórios ao incentivar sua utilização como substrato orgânico para produção de mudas nativas de qualidade, como insumo para recuperação de áreas degradadas que, com a formação dos reservatórios, passaram legalmente ser consideradas Áreas de Preservação Permanente (APP).
3. OBJETIVO
O objetivo dessa pesquisa foi reunir informações quanto ao uso das macrófitas aquáticas, acumuladas em reservatórios de produção de energia, como fonte de matéria orgânica e nutrientes para plantios florestais em APPs do entorno de reservatórios.
4. METODOLOGIA
Seguindo as orientações de Lima (2020) a ‘revisão bibliográfica deve priorizar artigos científicos recentes publicados em revistas científicas com alto impacto, evitando, ao máximo possível, citações de livros, apostilas, revistas técnicas, e similares’.
Com o objetivo formar uma pasta de arquivos contendo investigações técnico-científicas relacionadas à destinação adequada de macrófitas aquáticas (recuperação de solos alterados e como insumo na fertilização de plantios de recuperação de matas ciliares), foi construída uma biblioteca multidisciplinar.
As bases de dados utilizadas foram disponibilizadas no Suporte físico: Internet na qual se pôde ter acesso aos periódicos disponibilizados no Scientific Electronic Library Online (Scielo-Brasil); Red de Revistas Científicas de América Latina y el Caribe, España y Portugal: Redalyc; Portal de Periódicos CAPES-MEC, Google Acadêmico; Artigos de revistas especializadas, Apresentações em Simpósios e Congressos, Teses de doutorado; Processos; Dissertações de Mestrado, http://www.portal.ufpr.br, entre outros. No total a biblioteca foi formada por 164 publicações.
A maioria dos conteúdos foi extraída de Artigos (42), seguido de Dissertações de Mestrado (24), E-Book (17), Publicações (14), Apostilas (13), Apresentações em Congressos, Seminários e Simpósios (11), Teses de Doutorado (10), Manuais (9), Relatórios (8), Relatórios Institucionais (8) Trabalho de Conclusão de Curso de Graduação e Especialização (5), Processos (4), Boletim técnico (1) e Cartilha (1).
5. Revisão de literatura
5.1. Eutrofização de reservatórios
Sobre a eutrofização, Langanke (2010) relata ser o processo de poluição de corpos hídricos, principalmente por elementos nutritivos, entre os quais se destaca o fósforo.
Para Favareto & Pauletti (s/d), eutrofização significa excessiva concentração de nutrientes, principalmente nitrogênio e fósforo, resultando em elevada proliferação de algas e macrófitas aquáticas. Mesmo que o nitrogênio esteja associado à eutrofização, o elemento considerado controlador da eutrofização é o fósforo. Devido ao processo de decomposição ocasionado pelo crescimento excessivo da biota aquática, a eutrofização causa a redução do oxigênio dissolvido[11], causando problemas para o abastecimento doméstico pela presença de toxinas decorrentes do processo de anaerobiose, as quais são prejudicais a saúde humana.
Os mecanismos de retenção de fósforo no solo, assim como adsorção na superfície dos minerais ou formação de precipitados com Al, Fe e Ca, na maioria dos solos reduz seu potencial de perda pelo processo de lixiviação. Muitos trabalhos têm sido desenvolvidos enfatizando perdas de fósforo devido ao processo de erosão laminar, assim como outros têm mostrado que perdas de fósforo por lixiviação podem ocorrer em solos com alta concentração desse elemento (CHADWICK, D.R. & CHEN, 2012 cit. por FAVARETO & PAULETTI, s/d).
Assim, o fósforo transportado do solo para a água pode ser de duas formas: solúvel e particulado. A forma solúvel é constituída principalmente de fósforo inorgânico, o qual é imediatamente disponível para absorção da biota aquática, ao passo que, o fósforo particulado está relacionado ao elemento presente na fração mineral e orgânica do solo, sendo uma fonte de fósforo em longo prazo[12]. A quantidade de fósforo transportada do solo para o sistema aquático em áreas não cultivadas e não fertilizadas representa o valor mínimo de perda, o qual não pode ser reduzido. Esta perda determina o estado natural de um curso de água, porém dados mostram que a concentração de fósforo perdido superficialmente, mesmo em área não cultivada está acima dos valores máximos sugeridos para controlar a eutrofização.
O transporte de nitrogênio do solo para o sistema aquático está principalmente associado ao processo de lixiviação e, portanto, a grande preocupação refere-se à poluição por nitrato em águas subterrâneas, mais evidente em solos de textura arenosa, os quais apresentam elevada macroporosidade (FAVARETO & PAULETTI, s/d)[13].
Os corpos hídricos submetidos à eutrofização artificial propiciam o crescimento e a proliferação das macrófitas aquáticas. Como exemplos, podem ser citados os extensos bancos de Eichhornia crassipes e Pistia stratiotes na represa Billings, situada na região metropolitana de São Paulo e as grandes áreas colonizadas por Pistia stratiotes na represa de Americana (SP), um ecossistema hipereutrófico localizado em uma região com alta densidade populacional e com uma intensa atividade agrícola e industrial (THOMAZ &BINI. 2003)[14].
Entre as macrófitas aquáticas se destaca o Aguapé (Eichhornia crassipes), caracterizada por ter sua proliferação favorecida em corpos hídricos eutrofizados. Por outro lado, visto que essa espécie absorve grande quantidade de nutrientes, sua remoção mecânica e aproveitamento desses nutrientes pode ser uma alternativa para a mitigação de sistemas eutrofizados (POMPÊO, 2017; ALMADA, 2018) [15].
A Figura 1 ilustra descarga pontual de efluentes urbanos. A Figura 2 ilustra ambientes aquáticos: um antes e outro depois da eutrofização.
FIGURA 1: A PROLIFERAÇÃO DESCONTROLADA DAS MACRÓFITAS AQUÁTICAS É RESULTADO DO CONSTANTE AUMENTO DA POLUIÇÃO, COM DESPEJO DE ESGOTO DOMÉSTICO, FERTILIZANTES AGRÍCOLAS E EFLUENTES INDUSTRIAIS DIRETAMENTE NOS CORPOS HÍDRICOS.

FONTE: CEMIG, 26/96p. 2021.
FIGURA 2 - COMPARAÇÃO ENTRE UM LAGO SAUDÁVEL COM OUTRO EUTROFIZADO.
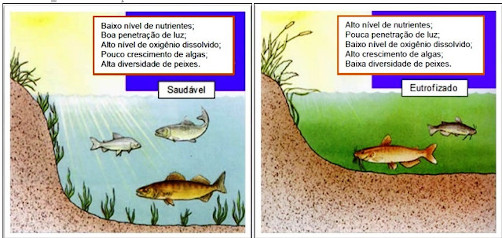
FONTE: Adaptado. Disponível em: http://ecologia.ib.usp.br/lepac/conservacao/ensino/es_eutrofizacao.htm >. Acesso em 15 set. 2021.
5.2. NECESSIDADE DE REVEGETAÇÃO DE ÁREAS NO ENTORNO DE RESERVATÓRIOS
Segundo a Lei 12.651/2012, também conhecida por Lei de Proteção da Vegetação Nativa, ao se criar um reservatório artificial a área ao seu redor passa a ser considerada Área de Preservação Permanente (APP), definida no Art.3º, II: “área protegida, coberta ou não por vegetação nativa, com a função ambiental de preservar os recursos hídricos, a paisagem, a estabilidade geológica e a biodiversidade, facilitar o fluxo gênico de fauna e flora, proteger o solo e assegurar o bem-estar das populações humanas” (BRASIL, 2012)
Já em seu Art. 4º, III: “considera-se APP, em zonas rurais ou urbanas as áreas no entorno dos reservatórios d'água artificiais, decorrentes de barramento ou represamento de cursos d'água naturais, na faixa definida na licença ambiental do empreendimento”.
Segundo o Art. 5º da referida Lei, “na implantação de reservatório d’água artificial destinado a geração de energia ou abastecimento público, é obrigatória a aquisição, desapropriação ou instituição de servidão administrativa pelo empreendedor da APP criada em seu entorno, conforme estabelecido no licenciamento ambiental, observando-se a faixa mínima de 30 (trinta) metros e máxima de 100 (cem) metros em área rural, e a faixa mínima de 15 (quinze) metros e máxima de 30 (trinta) metros em área urbana”. (Redação dada pela Lei nº 12.727, de 2012) (BRASIL, 2012).
Em outras palavras, as APPs são áreas de proteção integral não passível de exploração que se destinam, principalmente, à proteção das águas, dos solos e fluxo gênico entre fauna e flora. ‘A modificação dessas áreas só é admitida quando se tornam necessárias à execução de obras, planos, atividades ou projetos de utilidade pública ou interesse social após prévia autorização do Poder Executivo Federal’ (OLIVEIRA & LINHARES, 2012).
Para Oliveira (2012), a recuperação da Área de Preservação Permanente (APP) legalmente estabelecida com a formação do reservatório, é responsabilidade objetiva do empreendedor. Dessa forma, deverão ser evitados futuros transtornos para os proprietários de terras lindeiras, para a operadora da usina e para a sociedade de forma geral, que usufrui da bacia hidrográfica. Aos proprietários que poderão sofrer com perdas de terras devido ao acelerado processo erosivo, ao operador da usina que poderá ter problemas na operação e manutenção do reservatório e à sociedade em geral que com a recuperação da APP desfrutará de uma água com melhor qualidade[16].
A formação do reservatório promove a inundação da APP original, ou seja, a mata ciliar do rio represado; e o nível da água atinge cotas mais elevadas da paisagem que antes eram áreas de pastagem, culturas agrícolas, fragmentos florestais, ou solos degradados. Portanto, ocorre um deslocamento da APP que, obrigatoriamente, precisa ser recuperada. Os reservatórios acabam sendo um retentor da maior parte das descargas sólidas transportadas na rede fluvial, não obstante a isso, a composição de uma APP de acordo com as normas legais ao redor do reservatório, faz com que o volume de sedimentos depositados no reservatório não seja ainda maior (OLIVEIRA, 2012)[17].
Na maioria das vezes a APP no entorno de reservatórios artificiais passa por alguma intervenção antrópica e pode ser considerada área degradada. Cassiolato et al. (2014) sintetizam a definição de área degradada como aquela que sofreu alteração de suas características originais, em decorrência de causas naturais ou oriundas de ação antrópica. Em algumas dessas áreas ocorre a eliminação dos meios bióticos, e estas passam a apresentar baixa resiliência.
A supressão da vegetação expõe o solo aos agentes de erosão, que promovem a desagregação das partículas do solo. A cobertura vegetal atua como impedimento físico ao aumento da energia cinética do escoamento superficial, que dificulta a desagregação das partículas do solo, além de manter a umidade do solo, que faz com que as partículas fiquem mais fortemente agregadas. A cobertura vegetal apresenta ainda caráter facilitador da infiltração, que aumenta a capacidade do solo em absorver água e dificulta sua saturação. O escoamento superficial promove juntamente com o carregamento das partículas do solo a remoção de nutrientes e matéria orgânica. É possível observar por meio de estudo do sedimento carregado pelo escoamento superficial a remoção de nitrogênio, fósforo, carbono orgânico e até coliformes fecais presentes em solos tratados com dejetos animais (YAMAUCHI 2014).
Para Rodrigues et al. (2017) a retirada da cobertura vegetal propicia a exposição da superfície do solo ao sol e à chuva, provocando mudança nas condições da estrutura do solo, o que resulta na compactação da superfície ou mesmo na exposição da subsuperfície adensada, dando origem a barreiras para a correta circulação de água, nutrientes e ar, impedindo o livre desenvolvimento radicular, o que implica na perda de qualidade dos solos para o suporte da vida vegetal.
Práticas inadequadas de manejo do solo e tráfego de máquinas e animais promovem a compactação ao longo dos horizontes do solo. A compactação dos solos altera de forma negativa o armazenamento, transporte e disponibilidade de água, pela alteração na dinâmica da porosidade do solo (SEQUINATTO et al., 2014; YAMAUCHI, 2014).
A reduzida movimentação da água no perfil solo pode ser explicada pela presença de uma estrutura quase maciça e ausência de poros de drenagem. Torna-se evidente a necessidade de práticas conservacionistas que aumentem a resistência do solo (redução da erodibilidade) ou diminuam as forças do processo erosivo (erosividade das chuvas), por meio de práticas corretivas e preventivas visando principalmente a uma maior cobertura do solo contra o impacto direto da gota de chuva (RODRIGUES et al. 2017).
A recuperação de áreas degradadas depende da intensidade e duração do impacto e da resiliência do sistema, e pode ocorrer de forma natural. Neste caso, espécies heliófitas de rápido crescimento e com baixa necessidade nutricional se estabelecem e iniciam o processo de recuperação. Em contrapartida, quando a degradação ocorre pela perda da camada superficial do solo, a intervenção antrópica é necessária para restabelecer os níveis de nutrientes e a quantidade de matéria orgânica (DIAS et al., 2007; YAMAUCHI, 2014).
A restituição da matéria orgânica ao solo é essencial para a recuperação de áreas degradadas, visto que, apresenta importância significativa em vários atributos do solo, como por exemplo, o aumento da capacidade de troca catiônica (CTC). O aumento da matéria orgânica em solos degradados também é responsável pela melhora de atributos físicos do solo, pois cria condições favoráveis à atividade biológica e estruturação de suas partículas de maneira a restabelecer a micro e macroporosidade e retenção de água no substrato (DIAS et al., 2007; BONINI et al., 2011).
A recuperação de áreas envolvendo o plantio de mudas de espécies nativas é uma das técnicas utilizadas para proteger, recuperar e promover o uso sustentável dos ecossistemas terrestres, gerir de forma sustentável as florestas, combater a desertificação, deter e reverter a degradação da terra e deter a perda de biodiversidade; e assim contribuir para alcançar os “Objetivos do desenvolvimento Sustentável “(ODS 17)[18].
De acordo com Cassiolato et al. (2014) a reimplantação da vegetação é muito importante por possibilitar o aporte de matéria orgânica no solo bem como recuperação da comunidade edáfica. A biomassa microbiana do solo é a parte viva e mais ativa da matéria orgânica, essencial na regulação da ciclagem de nutrientes no solo sendo um componente que controla a decomposição e seu acúmulo, assim como as transformações envolvendo os nutrientes minerais. Por atuarem nos processos de mineralização/imobilização, os microrganismos do solo são considerados fonte e dreno de nutrientes (REIS & MENDES, 2007).
Conforme Cassiolato et al. (2014), para o estabelecimento de plantas em solos degradados é necessária a utilização de insumos químicos e orgânicos. Considerando os trabalhos de recuperação em áreas onde os horizontes superficiais do solo foram removidos, a necessidade de adição de matéria orgânica é ainda maior; portanto é necessário buscar alternativas para introdução de insumos orgânicos que melhorem as condições mencionadas. Tais pesquisadores corroboram com a premissa de que as macrófitas aquáticas têm atraído o interesse de diversos pesquisadores, devido à sua capacidade de retenção de nutrientes.
Como mencionado anteriormente, considerando que a excessiva proliferação de macrófitas aquáticas tem sido um grande desafio na administração de reservatórios para uso prioritário de geração de energia, precisando de remoção e destinação ambiental adequada, essa biomassa (rica em nutrientes e compostos orgânicos), pode, neste caso, ser adicionada como fonte de material orgânico em solos intensamente degradados, danificados ou destruídos (CASSIOLATO et al. 2014).
Para Antunes (2004) a biomassa de macrófitas aquáticas também pode ser utilizada para recuperar áreas de solo degradado, visto que, em seu estudo foram observadas alterações positivas nos teores de fósforo, matéria orgânica, cálcio, magnésio, potássio, pH, soma de base, saturação por bases e CTC com a incorporação de Eicchornia crassipes. Também, Macedo (2004) cit. por Yamauchi (2014) observou o aumento na atividade microbiana do solo e nos teores de fósforo, potássio, cálcio, magnésio, soma de bases, CTC, manganês e níquel, com a incorporação de Brachiaria arrecta e Egeria densa em um solo degradado.
A ciclagem de nutrientes é regida através dos ciclos biogeoquímicos que permitem florestas exuberantes em solos tão inférteis. Áreas em recuperação, devido ao uso anterior, não possuem camadas de serapilheira, então, parte do ciclo biogeoquímico se encontra em ruptura na sua dinâmica. Dessa forma, devem ser disponibilizados nutrientes pela via da adubação químico-orgânica para essas espécies se estabelecerem.
As espécies florestais nativas e as plantadas são adaptadas a baixos níveis de fertilidade do solo. Essas espécies são pouco sensíveis à acidez do solo e toleram altos níveis de Al. No entanto, recomenda-se a calagem por melhorar a disponibilidade dos nutrientes pelo aumento do pH e por fornecer Ca e Mg, elevando a saturação de bases do solo, com consequências positivas sobre o pH e a CTC do solo (RODRIGUES et al., 2017).
Em médio e longo prazo, as técnicas de correção da fertilidade de solos degradados não apresentam sustentabilidade. Os nutrientes nativos ou adicionados ao solo (mesmo que estejam em condições propícias de disponibilidade em função da faixa de pH do solo), para serem absorvidos pelas plantas, precisam ser mineralizados por microrganismos e transformados via reações químicas na presença de condições adequadas de oxigênio. Essa situação ocorre apenas se o solo for bem suprido de matéria orgânica (LOPES & ALVES, 2005).
Dessa forma, segundo estudos mencionados, a fertilização do solo e produção de substrato alternativo, proveniente do aproveitamento da biomassa de macrófitas aquáticas, pode ser fonte de matéria orgânica e nutrientes necessários para recomposição da vegetação das áreas alteradas no entorno dos reservatórios de produção de energia.
5.3. Comunidades de Macrófitas Aquáticas
Weaner & Clements (1938) cit. por Esteves (1998) foram os primeiros a definirem as comunidades de macrófitas aquáticas como um conjunto de espécies herbáceas que se desenvolvem em água, em solos cobertos por água ou saturados por esta. Para Vilela (2016), esse grupo de plantas é representado por vegetais terrestres que, ao longo do processo evolutivo, se adaptaram ao ambiente aquático[19]. Como são vegetais que retornaram do ambiente terrestre para o aquático, as macrófitas apresentam ainda várias características de vegetais terrestres, como cutícula e estômato não funcionais nas maiorias das espécies, além de grande capacidade de adaptação e amplitude ecológica, possibilitando que a mesma espécie colonize os mais diferentes tipos de ambientes (PEDRALLI et al. 1993).
De acordo com Thomaz & Bini (2003), as macrófitas aquáticas são plantas aquáticas vasculares ou "vegetais visíveis a olho nu, cujas partes fotossintetizantes ativas estão permanentemente ou por diversos meses, ou todos os anos, total ou parcialmente submersas em água doces ou salobras, ou ainda, flutuantes”. Segundo esses autores, desde o nascimento da Limnologia até a década de 1960 poucas pesquisas foram desenvolvidas e nem mesmo os botânicos demonstravam interesse pelas macrófitas aquáticas.
Segundo o Programa Internacional de Biologia (PIB), o termo “macrófitas aquáticas” é a denominação mais adequada para caracterizar vegetais que habitam desde brejos até ambientes verdadeiramente aquáticos, sendo uma denominação genérica, independente de aspectos taxonômicos. Com a criação do PIB as pesquisas sobre ecologia de macrófitas aquáticas receberam grande impulso e foi resolvido um problema que se arrastava por décadas: a nomenclatura[20]. Uma das decorrências do PIB foi a proposição do termo macrófitas aquáticas, o qual passou a ser aceito internacionalmente. Em síntese, o PIB chamou a atenção dos limnólogos para a importância das macrófitas aquáticas na estrutura, funcionamento dos lagos, assim como contribuiu para a padronização de métodos de avaliação da biomassa e produtividade (THOMAZ & BINI, 17/342p. 2003).
Quanto às comunidades de macrófitas aquáticas, Esteves (1998), menciona que, dada a heterogeneidade filogenética e taxonômica, estes vegetais são preferencialmente classificados quanto ao seu biótopo[21]. Este fenômeno pode ser observado, de um lado, nos vegetais anfíbios, ou seja, ora emersas, ora submersas e, de outro lado, naqueles verdadeiramente aquáticos, as macrófitas submersas e flutuantes. O mesmo autor relaciona os principais grupos de macrófitas aquáticas quanto ao seu biótopo, denominados genericamente de grupos ecológicos:
-
Emersas: plantas enraizadas no sedimento com folhas acima da lâmina de água, como Echinochloa, Typha, etc.;
-
Flutuantes: plantas que se desenvolvem flutuando livremente no espelho de água, como Limnobium, Lemna, etc.;
-
Submersas enraizadas: plantas enraizadas crescendo submersas, como Vallisneria, Nitella, etc.;
-
Submersas livre: plantas com raízes pouco desenvolvidas, flutuando submersas em águas tranquilas, como Utricularia;
-
Com folhas flutuantes: plantas enraizadas com folhas flutuando na lâmina d’água, como Nymphoides, etc..
5.4. Características benéficas para a comunidade aquática
As macrófitas aquáticas estão tão intimamente relacionadas ao funcionamento dos ambientes aquáticos que a preocupação com sua preservação é fundamental para a manutenção da biodiversidade desses ambientes. De acordo com Rodrigues et al. (2017), ambientes aquáticos apresentam heterogeneidade ambiental no tempo e espaço, ocasionando variadas respostas fenotípicas nessas espécies, as quais desempenham um papel extremamente importante no funcionamento dos ecossistemas em que ocorrem, sendo capazes de estabelecer uma forte ligação entre o sistema aquático e o ambiente terrestre que o circunda.
Entre as características benéficas das macrófitas, podem ser citadas: fonte de alimento para muitos tipos de peixes e algumas espécies de aves e mamíferos; atuam como liberadores de nutrientes, absorvendo-os do sedimento (fixadas no fundo dos reservatórios) e liberando-os na coluna d’água (por excreção ou decomposição); são fornecedoras de habitats e abrigo para peixes (alevinos) e pequenos animais; proporciona sombreamento, fundamental para muitas formas de vida sensíveis às altas intensidades de radiação solar; fornecem materiais de importância econômica para a sociedade (alimento para o homem e para o gado); indicadas por muitos pesquisadores como fonte de matéria orgânica e fertilizante para solos degradados; fornecem matéria prima para fármacos; são insumos para fabricação de utensílios domésticos, artesanatos (juta/taboa); são constituintes de tijolos (adobe); muito utilizadas como plantas ornamentais, etc..
Algumas macrófitas aquáticas são hospedeiras de algas e bactérias fixadoras de nitrogênio e proporcionam ambiente adequado para o desenvolvimento de microrganismos, pois suas raízes servem de substrato para a deposição de ovos de diversos animais e abrigo para o zooplâncton (principal alimentação de muitos peixes pequenos).
Para Esteves (1998), "nenhuma comunidade límnica foi tão negligenciada no âmbito das pesquisas limnológicas quanto à formada pelas macrófitas aquáticas". Esses vegetais participam da produção de matéria orgânica e da ciclagem de nutrientes na água; protegem as margens de rios, lagoas e lagos contra o processo erosivo; servem no abrigo e proteção para organismos aquáticos e/ou anfíbios e constituem a base da cadeia trófica, servindo como fonte primária de energia (ESTEVES 1998, THOMAZ & CUNHA, 2010).
Por necessitarem de altas concentrações de nutrientes para seu desenvolvimento, as macrófitas aquáticas também podem ser utilizadas como fitorremediadoras ou indicadoras da qualidade das águas. São utilizadas com sucesso na recuperação de rios e lagos, pois suas raízes podem absorver grandes quantidades de substâncias tóxicas, além de formarem uma densa rede capaz de reter as mais finas partículas em suspensão. Portanto, podem funcionar como indicadores da qualidade da água, pois são responsáveis por importantes funções nos ecossistemas aquáticos como a ciclagem e estocagem de elementos, controlando a poluição e a eutrofização artificial das águas, além de funcionarem como fonte de matéria orgânica, enquanto vivas ou mesmo mortas na forma de detritos.
A maioria dos lagos pouco profundo possibilita a formação de extensas regiões amplamente colonizadas por macrófitas. Essas regiões são consideradas as principais responsáveis pela produtividade biológica dos sistemas aquáticos e são extremamente vulneráveis aos impactos causados pelo homem, como a poluição e a turbidez da água ocasionada pelo material inorgânico proveniente da erosão dos solos e carregada pelas chuvas (TAVARES, 2003, 113/138).
Ecologicamente, as macrófitas aquáticas podem se constituir no principal produtor de matéria orgânica, atingindo cerca de 100 t de peso seco/ha/ano (Barbosa & Gentil, 2009), valor superior ao da cana de açúcar, mesmo mediante a aplicação de grandes quantidades de insumos agrícolas. Também apresentam importante papel na troca de nutrientes, podendo tornar-se as principais controladoras da dinâmica de nutrientes nos ecossistemas aquáticos (POMPÊO, 1996).
Portanto, quando em regiões de baixíssima ação antrópica, as macrófitas são importantes fontes de energia e de matéria orgânica para as cadeias alimentares em ecossistemas aquáticos e promovem vários benefícios, se destacando o abrigo para reprodução e proteção de organismos aquáticos e pássaros, remoção do excesso de substâncias tóxicas na água e promoção da heterogeneidade espacial e temporal no corpo hídrico, que favorece a biodiversidade biológica e de outros organismos aquáticos, além de proteger as margens contra o processo erosivo. Desempenham importantes papéis para a manutenção da biodiversidade, para o metabolismo e para a estrutura dos ambientes aquáticos, além de funcionarem como indicadoras da qualidade da água, sendo responsáveis por importantes funções (CEMIG, 2021; FLORES, 2017).
Na figura 3 estão imagens que ilustram a sinergia entre fauna e flora aquática.
FIGURA 3: NITIFICAÇÃO EM EPÍFITOS, REFÚGIO PARA MAMÍFEROS E AMBIENTES PARA REPRODUÇÃO DE ANFÍBIOS.

FONTE: MOHEDANO, 2017, 38/45/45p. (2017); CEMIG: Fotos iStock, 2021, 16/17/96p.
No quadro 1 estão representadas as macrófitas aquáticas mais referenciadas devido suas características tanto de fitorremediadoras quanto de fertilização de solo.
QUADRO 1: MACRÓFITAS AQUÁTICAS MAIS REFERENCIADAS DEVIDO SUAS CARACTERÍSTICAS BENÉFICAS
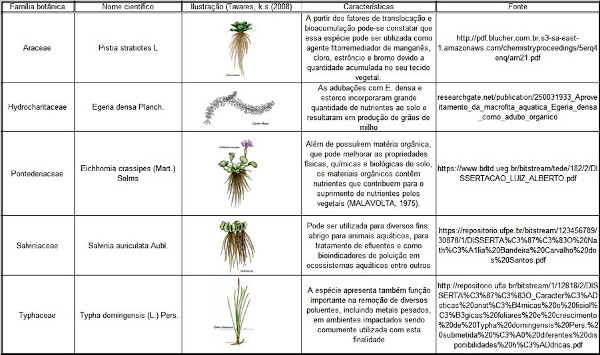
FONTE: Adaptação do autor com Ilustrações de Tavares (2003), Cartilha: Macrófitas Aquáticas (107/138p.).
5.5. Crescimento de Macrófitas Aquáticas em reservatórios eutrofizados
Em decorrência das alterações antropogênicas do último século, principalmente as relacionadas às variações climáticas e à poluição das águas, as condições abióticas dos lagos vêm sendo alteradas pelo incremento de nutrientes, acarretando impactos significativos nas comunidades aquáticas. Por isso, os estudos de produção primária desse grupo de vegetais[22], em lagos e reservatórios, são muito importantes, pois permitem conhecer o metabolismo do sistema aquático, bem como a entrada de energia e as influências nos ciclos de carbono e demais nutrientes. Um organismo consegue viver somente dentro de seus limites de tolerância (temperatura, luminosidade e nutrientes) e em condições muito próximas pode realizar os processos fotossintéticos apenas o suficiente para sua sobrevivência (ESTEVES, 1998).
Segundo Biudes & Camargo (2008), as alterações antrópicas nos ecossistemas aquáticos interferem no crescimento e na produção primária de macrófitas (emersas e submersas). A construção de represas altera a velocidade de corrente e o padrão de variação de nível de água, dois importantes fatores controladores da produção primária destes vegetais.
A comunidade fitoplanctônica foi considerada por muito tempo a maior responsável pelo incremento de matéria orgânica em sistemas aquáticos, principalmente nas regiões temperadas. Mais tarde, ficou comprovado que, em alguns ecossistemas as macrófitas aquáticas eram mais produtivas que o fitoplâncton (ESTEVES, 1998).
Como referenciado anteriormente, o crescimento excessivo das macrófitas aquáticas é resultante das atividades humanas que aumentam a disponibilidade de nutrientes nos corpos d’água, propiciando condições favoráveis ao seu desenvolvimento. Algumas dessas espécies de plantas possuem características biológicas e fisiológicas capazes de explorar os ecossistemas aquáticos de maneira oportunista, crescendo e reproduzindo-se em condições desfavoráveis ou até mesmo quando em competição com outras espécies (HENRY-SILVA & CAMARGO, 2006).
Por outro lado, se as características ambientais são favoráveis, pode ocorrer um acréscimo da produtividade e um consequente aumento da reprodução vegetativa e sexuada. Nessas condições ótimas, determinadas espécies podem se tornar daninhas, prejudicando os usos múltiplos dos ecossistemas aquáticos (THOMAZ & BINI, 2003).
O acréscimo excessivo de indivíduos de uma população de macrófitas deve-se, geralmente, a dois fatores principais: à falta de herbívoros e ao nível elevado de eutrofização. As aduções de nutrientes, através de lançamentos de efluentes (domésticos e industriais), ou por drenagens de áreas agrícolas (fontes difusas), permitem o aumento de substâncias (fosfato, amônio e nitrato) que, em geral, são encontradas em baixas concentrações nos ambientes aquáticos (ESTEVES, 1998; THOMAZ & BINI, 2003).
De acordo com Thomaz e Bini (2003), a intensa proliferação de macrófitas aquáticas, produz elevada quantidade de matéria orgânica, que ao se decompor libera nutrientes para o ambiente, aumentando, consequentemente, a velocidade do processo de fertilização das águas. Em reservatórios, particularmente, outros efeitos decorrentes da presença excessiva de macrófitas podem ser relacionados, e dentre os mais relevantes podem ser mencionados:
-
O aumento da demanda bioquímica de oxigênio (DBO), em consequência da morte e decomposição das plantas;
-
A redução das taxas de trocas gasosas entre o ambiente aquático e a atmosfera;
-
A interferência na produção primária fitoplanctônica e nos demais níveis tróficos;
-
A formação de ambiente favorável para o crescimento de insetos e moluscos com implicação médico sanitária;
-
O incremento da evapotranspiração;
-
A interferência na operação dos sistemas geradores de energia das usinas hidrelétricas;
-
A redução do potencial de usos múltiplos;
-
A retenção de elementos minerais, tais como o nitrogênio e o fósforo.
Nesse contexto, para se efetuar adequadamente o controle das macrófitas aquáticas, é importante conhecer as condições ambientais ótimas para o seu crescimento, além dos aspectos biológicos e autoecológicos das espécies.
5.6. Monitoramento e manejo de macrófitas aquáticas
Lima Abreu (2019) relata que, legalmente, com a conclusão da construção de usinas hidrelétricas, fica estabelecida a necessidade de Licença de Operação (LO); e com isso um conjunto de condicionantes ambientais é requerido. É neste cenário em que geralmente está presente a obrigatoriedade do monitoramento e plano de manejo de macrófitas aquáticas, em razão dos graves problemas ocasionados pelas infestações registradas em um considerável número de reservatórios brasileiros.
A Política Nacional do Meio Ambiente (PNMA)[23] tem por objetivo a preservação, melhoria e recuperação da qualidade ambiental propícia à vida, visando assegurar condições ao desenvolvimento socioeconômico, aos interesses da segurança nacional e à proteção da dignidade da vida humana, sendo aplicado neste espaço o princípio de recuperação de áreas degradadas. É neste princípio em que está presente o Plano de Recuperação de Áreas Degradadas (PRAD), sendo este solicitado pelos órgãos ambientais como parte inseparável do processo de licenciamento de atividades degradadoras ou modificadoras do meio ambiente. Para pequenos corpos de água, visando o controle do crescimento agudo das macrófitas, o plantio de árvores nas margens, em consonância ao Plano de Recuperação de Área Degradada (PRAD) para mata ciliar, se apresenta como uma alternativa interessante, uma vez que estas árvores causam sombra, interferindo na produção da biomassa das plantas aquáticas.
A proposta de manejo de organismos aquáticos é atualmente disciplinada pela Resolução CONAMA n° 467, de 17 de julho de 2015 (CONAMA, 2015). Esta resolução dispõe de orientações quanto aos critérios para a autorização de uso de produtos ou agentes de processos físicos, químicos ou biológicos em corpos hídricos superficiais para controle da poluição e do crescimento desordenado ou indesejável de organismos da flora e da fauna, além de outras providências.
A identificação das macrófitas aquáticas que ocorrem em um reservatório é de relevante importância no estabelecimento de estratégias de manejo do corpo hídrico e identificação precoce de espécies que potencialmente poderiam causar danos aos usos múltiplos ou à qualidade da água do reservatório. Com o conhecimento das espécies que colonizam o reservatório, é possível inferir os efeitos da presença de determinada espécie para o meio ambiente, as atividades operacionais e de geração do corpo hídrico e as técnicas de manejo para contenção de sua expansão populacional (PITELLI et al., 2014).
Segundo Thomaz e Bini (2003), a elaboração de um plano de manejo de plantas aquáticas é um componente importante do gerenciamento dos reservatórios. Esse plano irá constituir-se em uma ferramenta essencial para a tomada de decisões relativas ao manejo de plantas aquáticas por permitir a identificação das áreas alvo de monitoramento, definir os níveis desejados de controle de plantas aquáticas, assim como os métodos a serem utilizados.
Assim, na maioria das situações em que as plantas aquáticas representam problemas, a integração de métodos de controle é geralmente recomendada. Utilizando várias práticas, benefícios a curto, médio e longo prazo podem ser alcançados e essas plantas podem ser manejadas de forma segura e eficiente. As diferenças entre sucesso e insucesso ou entre extermínio e controle de plantas dependem da elaboração de um plano de manejo integrado de plantas aquáticas, o qual se baseia em seis princípios:
1. Identificar os usos da água e determinar se algum desses usos é beneficiado ou prejudicado pela vegetação aquática;
2. Compreender a ecologia das plantas aquáticas no corpo hídrico. As informações necessárias incluem mapas das infestações de plantas aquáticas e dos usos da água, e informações sobre a fauna, qualidade da água e entorno do reservatório;
3. Estabelecer metas do manejo;
4. Considerar todos os métodos de controle e selecionar aqueles mais adequados para cada situação;
5. Desenvolver um plano de ação e um programa de monitoramento com o objetivo de avaliar a eficiência das atividades de manejo e os efeitos dessas atividades;
6. Estabelecer um programa de manejo de longo prazo incluindo subprogramas.
Segundo Pompêo (2016), a aplicação de programas de monitoramento e manejo é fundamental para atingir bons padrões de qualidade e a sustentabilidade dos reservatórios, principalmente daqueles mais impactados, geralmente localizados próximos aos grandes centros urbanos.
Estes programas deverão permitir a manutenção de um ambiente saudável, sem significativas reduções na qualidade das águas e sedimentos, com seus níveis sempre dentro de aceitáveis padrões de qualidade, além de manter a seus inúmeros usos múltiplos.
Na tentativa da manutenção da sustentabilidade ambiental, o monitoramento e manejo devem direcionar ações que permitam manter ou não os usos atuais e futuros, readequando os rumos sempre que ocorrer perda de qualidade nos serviços ecossistêmicos oferecidos pelo reservatório.
Dentre os principais métodos de controle estão o biológico, o mecânico, o físico e o químico, sendo que, o mais utilizado tem sido o mecânico, pois atua de forma pontual nas áreas de infestação e não introduz produtos químicos no ambiente (POMPÊO, 2017).
De acordo com Yamauchi (2014), no Brasil, o controle químico de macrófitas em corpos hídricos, apesar de regulamentado, não é autorizado. A ausência de autorização para o uso de herbicidas é consequência da existência de poucos trabalhos e pesquisas que evidenciem a eficácia e a segurança ambiental destes produtos químicos em ambientes aquáticos.
Como mencionado anteriormente, a total eliminação das macrófitas aquáticas não é recomendável. Estas plantas têm importante papel na regulação do metabolismo de lagos e reservatórios, podem ser empregadas na recuperação de ecossistemas eutrofizados, contribuem na redução da turbidez e promovem também maior abundância de pássaros e riqueza de diversos grupos animais. Assim, o programa de monitoramento e manejo deve incorporar a manutenção do reservatório vegetado, no entanto, evitando os efeitos negativos associados ao intenso e descontrolado crescimento das macrófitas aquáticas (POMPÊO, 2008).
As macrófitas não devem ser extirpadas do reservatório como pragas. Pelo contrário, a manutenção dessas plantas garante ao corpo hídrico maior diversidade e a possibilidade de auxiliar como amortecedor de eventuais impactos, conferindo melhor qualidade ao ecossistema como um todo; e refletindo na melhoria da qualidade da água para múltiplas finalidades.
Há que se considerar que em reservatórios onde as macrófitas aquáticas são importantes componentes de sua estrutura e função, devem ser despendidos esforços para que permaneçam no ecossistema, que tenham seu crescimento controlado, evitando os efeitos danosos do crescimento explosivo e que não haja abruptas reduções de sua área de colonização e biomassa.
O problema existe apenas quando há sobressaltos no crescimento de sua biomassa ou área de colonização com grande descontrole no aporte de nutrientes. Com adequado programa de gestão é possível monitorar, antecipando-se aos problemas, e manejar as plantas aquáticas, se necessário, minimizando as consequências do grande crescimento potencial (POMPÊO, 2008; POMPÊO, 2017).
A remoção mecânica de macrófitas aquáticas deve estar associada a uma destinação adequada, visto que, quando simplesmente disposta às margens dos reservatórios ou corpos d’água, a biomassa coletada, rapidamente, tem seus nutrientes devolvidos ao sistema, agravando ainda mais o processo de eutrofização (FARIA & ESPÍNDULA, 2005).
Para a Light Energia S.A., os resultados do Projeto de Pesquisa & Desenvolvimento (P&D) proporcionaram subsídios ao setor de geração para programação da colheita das macrófitas aquáticas e fortes subsídios para licenciamento da colheita mecânica mostrando que este processo reduz a contaminação da água por elementos químicos e fornece biofertilizante para a recuperação de áreas degradadas. Assim, corroborou com a premissa de que a remoção mecânica de macrófitas aquáticas não constitui um passivo ambiental a ser transferido e sim um substrato para utilização no crescimento de plantas em recuperação de áreas degradadas.
A P&D mostrou que neste reservatório ocorre variação sazonal da quantidade de biomassa colhida em função de variáveis climáticas e operacionais, diferenças entre as composições químicas entre as espécies e entre os efeitos de suas incorporações sobre as características químicas, físicas e biológicas de solos degradados e nas respostas das espécies arbóreas nativas. Também indicou que as preocupações ambientais de alguns órgãos reguladores de meio ambiente com a biomassa removida, deverão ser menores com a colheita mecânica de macrófitas e a partir daí poderão encará-la como aliada ambientalmente favorável (INÁCIO, 2012) [24].
Segundo Yamauchi (2014) alguns autores propõem outros usos para a biomassa de macrófitas, como por exemplo, para alimentação animal a Pistia stratiotes (fonte de aminoácidos), Eichhornia crassipes como fertilizante do solo, pelo elevado teor de cálcio, magnésio, zinco, ferro e cobre quando comparado com espécies forrageiras, como catalizadora da atividade microbiana e incremento de matéria orgânica ao solo[25]. Também podem ser citadas a utilização da Salvinia auriculata como bioindicador de poluição por cromo e a Azolla caroliniana em estudos ecotoxicológicos de herbicidas a base de (HENRY-SILVA e CAMARGO, 2006).
Segundo Pitelli et al. (2006), não há dúvidas de que a colheita mecânica e a disposição final da biomassa devem receber pareceres favoráveis no licenciamento dos reservatórios de produção de energia, desde que o destino da biomassa colhida seja bem definido. Para isso, são necessários estudos das formas de utilização desta biomassa e da sua influência no ambiente, além da avaliação das características específicas de cada macrófita quanto à sua absorção e liberação de nutrientes; e de produtos químicos acumulados durante seu ciclo de vida (YAMAUCHI, 2014).
5.7. Estudos relacionados ao APROVEITAMENTO DE macrófitas aquáticas como fontes de nutrientes
Uma das alternativas de aproveitamento das macrófitas aquáticas removidas dos reservatórios seria a sua utilização como fonte de matéria orgânica e os nutrientes para áreas degradadas em processo de recuperação, devido à grande quantidade de biomassa produzida e também à composição química das plantas.
Thomaz & Bini (2003), ao compararem a composição química de diferentes espécies de macrófitas aquáticas, constataram maiores estoques de nitrogênio e fósforo na biomassa total das espécies Pistia stratiotes, Salvínia molesta (flutuantes) e Eichhornia azurea (emersa) do que na biomassa total de Utricularia foliosa (submersa livre).
A composição mineral do aguapé (Tabela 1), avaliada em diferentes partes da planta, (raiz, caule e folhas) mostra o potencial de fornecimento de nutrientes de sua biomassa. MALAVOLTA et al. (1989), ao compararem o aguapé com esterco bovino (Tabela 2) concluíram que seria válido o uso do aguapé seco e moído como adubo verde e fonte de nutrientes.
TABELA 1: CONCENTRAÇÃO DE MACRO E MICRONUTRIENTES NAS DIFERENTES PARTES DA Eichhornia crassipes (2 AMOSTRAS).
|
Elemento |
Folhas |
Caule |
Raízes |
Total |
|
Gramas |
||||
|
N |
2,67 |
5,15 |
2,50 |
10,30 |
|
P |
0,31 |
1,00 |
0,31 |
1,60 |
|
K |
5,45 |
40,44 |
3,13 |
49,00 |
|
Ca |
8,17 |
13,85 |
3,75 |
25,80 |
|
Mg |
0,24 |
9,97 |
0,31 |
10,50 |
|
S |
0,20 |
1,05 |
2,08 |
3,30 |
|
Miligramas |
||||
|
B |
3,00 |
13,00 |
9,00 |
25,00 |
|
Cl |
758,00 |
7894,00 |
1784,00 |
10436,00 |
|
Co |
0,12 |
0,78 |
1,00 |
1,90 |
|
Cu |
0,93 |
2,80 |
6,50 |
10,20 |
|
Fe |
173,00 |
673,00 |
8123,00 |
8969,00 |
|
Mn |
88,00 |
504,00 |
823,00 |
1415,00 |
|
Mo |
0,13 |
1,10 |
1,10 |
230,00 |
|
Ni |
0,20 |
2,20 |
1,60 |
4,00 |
|
Zn |
3,60 |
28,00 |
10,00 |
41,60 |
FONTE: MALAVOLTA et al. 4/8p.(1989). https://www.revistas.usp.br/aesalq/article/view/5207/6737
TABELA 2: NUTRIENTES E MICRONUTRIENTES ENCONTRADOS NA Eichhornia crassipes.
|
Comparação entre conteúdo mineral do aguapé e do esterco de curral seco. |
||
|
Elemento |
Aguapé |
Esterco |
|
Kg. ton -1 |
||
|
N |
10 |
20 |
|
P2O5 |
4 |
15 |
|
k2O |
64 |
22 |
|
Ca |
26 |
33 |
|
Mg |
10 |
9 |
|
S |
3 |
4 |
|
g. ton -1 |
||
|
B |
25 |
100 |
|
Cl |
10430 |
6000 |
|
Co |
2 |
|
|
Cu |
10 |
100 |
|
Fe |
8969 |
|
|
Mn |
1415 |
300 |
|
Mo |
2 |
|
|
Ni |
4 |
|
|
Zn |
42 |
100 |
FONTE: MALAVOLTA et al. 7/8p.(1989). https://www.revistas.usp.br/aesalq/article/view/5207/6737
Os nutrientes que destacaram por apresentarem as maiores concentrações na planta foram o potássio e os micronutrientes cloro, ferro e manganês.
Outro trabalho que compara a composição em nutrientes de uma macrófita aquática com outras fontes orgânicas (Tabela 3) é o realizado por Lima Abreu (2019). Visando a possibilidade de incorporação de nutrientes ao solo e de aumento da produção agrícola na área rural dos municípios de Bom Jardim e Cordeiro (Estado do Rio de Janeiro)[26], Lima Abreu (2019) investigou na literatura, o teor de Nitrogênio Total em % de Peso Seco encontrado para Salvinia sp., comparando-o com 3 (três) outros fertilizantes orgânicos, divulgados pela Embrapa Agrobiologia (2018).
TABELA 3: COMPARAÇÃO DO PESO SECO (OS) DE SALVINIA SP. COM OUTRAS FONTES DE FERTILIZANTE ORGÂNICO.
|
Salvínia sp. |
|
|
Fonte |
N (% de PS) |
|
Esterco Bovino |
1,5 |
|
Esterco de Frango |
2,5 |
|
(N-verde Embrapa)/ Espécies de Leguminosas |
4,0 |
|
Macrófita (Salvinia sp) |
1,6 |
FONTE: EMBRAPA (2018).
Em seu estudo, Lima Abreu (2019) relata que as macrófitas podem ter seu uso como biofertilizantes, agindo diretamente na oferta de nutrientes e atuando na melhoria da qualidade do solo e da vegetação ali presente. É nesta realidade onde ações de recuperação de áreas degradadas mostram-se de extrema importância.
Embrapa (2018), após análises laboratoriais, obteve eficiência do fertilizante vegetal N-verde[27] em 10% no primeiro ciclo, resultado este similar aos demais fertilizantes orgânicos. Lima Abreu (2019) estimou resultado semelhante a 6%, de eficiência para um fertilizante a base de Salvinia sp., significando que a cada 100 kg de fertilizante disponíveis para as plantas, a mesma seria capaz de absorver 6 kg. Logo, no reservatório da PCH Santa Rosa II (2018), para as 44,3 t.ha-1.ano produzidas, resultaria em 2,6 toneladas de nitrogênio capazes de serem absorvidas pelas plantas no primeiro ciclo.
Segundo Embrapa (2018), os fertilizantes orgânicos apresentados na Tabela 4, como o esterco bovino e o esterco de frango, possuem custo elevado e são de difícil obtenção em algumas regiões. Este fator poderia ser solucionado com o aproveitamento da biomassa de macrófitas aquáticas, as quais apresentam elevado grau de crescimento e disponibilidade atemporal. No entanto, para qualquer adubação se faz necessário o conhecimento prévio da possibilidade de incorporação de elementos indesejados no solo como alguns metais pesados (LIMA ABREU, 2019) [28].
Antunes (2004), estudando outras espécies, observou alterações positivas nos teores de fósforo, matéria orgânica, cálcio, magnésio, potássio, pH, soma de bases, saturação por bases e CTC com a incorporação de Eichhornia crassipes. Em outro estudo, Antunes (2009) aponta a viabilidade da aplicação de macrófitas das espécies Eichhornia crassipes, Pistia stratiotes, Lemna minor como matéria prima para compostagem por método de aeração natural [29].
Em seus estudos, Yamauchi (2014) observou que a incorporação de Eichhornia crassipes, T. latifólia, S. molesta e B. subquadripara alterou de forma positiva as características químicas do solo, bem como a incorporação do composto, fertilizando solo degradado utilizado nos seus experimentos.
Merenda (2011) relata que, em pesquisas realizadas nas décadas de 1960 e 1970, se confirmou que muitas plantas aquáticas, em especial Eichhornia crassipes, removiam poluentes de águas, incluindo nitrogênio, fósforo, metais pesados e fenóis. Também comenta que “As plantas utilizam estes nutrientes para seu crescimento, atuando, desse modo, como biorremediadoras de grande parte dos macro e micronutrientes das águas eutrofizadas”; e que estes nutrientes poderiam ser potencialmente utilizadas por plantas no ambiente terrestre quando da incorporação das macrófitas no solo ou do seu processamento como fertilizantes orgânicos. A matéria orgânica destas plantas, quando incorporadas no solo, pode exercer influência sobre numerosas propriedades físicas, químicas e biológicas do solo, as quais acabam por alterar a dinâmica do mesmo e, consequentemente, sua fertilidade.
Os resultados do estudo de Merenda (2011) mostraram que as espécies que apresentaram maior biomassa no reservatório da Usina Hidrelétrica Aimorés (MG) foram: Eichhornia crassipes, Pistia stratiotes, Salvinia molesta, Paspalum repens, Polygonum lapathifolium, Oxycarium cubense e Brachiaria subquadripara. A autora observou que as espécies de macrófitas aquáticas variam na capacidade de extração e acúmulo de nutrientes da água por unidade de biomassa acumulada, destacando-se Pistia stratiotes e Polygonum lapathifolium na extração de potássio, cálcio e magnésio e Salvinia molesta para micronutrientes. Neste reservatório, observou-se que as concentrações de metais pesados na biomassa da macrófitas foram menores que os estabelecidos para fertilizantes orgânicos pela legislação Brasileira.
Assim, as características químicas do solo foram alteradas favoravelmente com a incorporação da biomassa das macrófitas aquáticas, assim como ocorreu grande diferença entre as espécies testadas: para as concentrações de matéria orgânica não houve expressiva diferença entre espécies, mas para as concentrações de potássio, cálcio, magnésio, cálcio, soma de bases, capacidade de troca catiônica (CTC) e saturação por bases (SB) houve efeitos positivos mais pronunciados de Polygonum lapathifolium; Pistia stratiotes e Polygonum lapathifolium, que foram as mais efetivas na redução da acidez potencial do solo. Nakagawa (1992) cit. por Merenda (2011), afirmaram que todo e qualquer resíduo orgânico animal e vegetal, incorporado ou amontoado no solo, é degradado devido à ação de microrganismos que se alimentam das substâncias presentes, principalmente o carbono orgânico, sendo os nutrientes liberados para a biota terrestre, incluindo raízes de plantas superiores.
Estudos conduzidos pela empresa Ecosafe Agricultura e Meio Ambiente com macrófitas flutuantes coletadas em reservatórios de elevada eutrofização como os Ibirité (REGAP Petrobrás, Belo Horizonte), Santana (Piraí, RJ) e Americana (Americana, SP) mostraram que a incorporação de até 40 t. ha-1 de biomassa seca de Eichhornia crassipes e ou Pistia stratiotes, além de melhorarem as características químicas e físicas do solo, não promoveram teores de metais pesados no solo que se aproximassem dos limites estabelecidos pela CETESB[30]. Por esse motivo, a opção mais imediata para a utilização da biomassa é na recuperação de áreas degradadas ou recomposição de vegetação nativa. Experimentos bem sucedidos, com este tipo de utilização, foram obtidos em estudos realizados nas áreas da Light (RJ) e da UHE Aimorés (MG) (ECOLOGY BRASIL, 2020).
As macrófitas aquáticas eventualmente removidas da UHE Tibagi Montante foram depositadas na APP para auxiliar na recomposição e/ou manutenção da vegetação ali presente, mantendo a recomendação do Subprograma de Manejo de Macrófitas Aquáticas: UHE Tibagi Montante (ECOLOGY e ECOSAFE, 2021).
Desde o início do enchimento do complexo de Ribeirão das Lajes, o reservatório de Santana apresentou problemas com o crescimento excessivo de macrófitas aquáticas. Os resultados do estudo de Inácio (2012), visando à recuperação de áreas degradadas na “LIGHT Energia S.A.”, permitiram o desenvolvimento de um sistema simples e confiável de avaliação quantitativa e qualitativa da biomassa de macrófitas colhidas nos reservatórios de Santana e Vigário. Os resultados mostraram que essas espécies variam bastante com relação aos teores de elementos químicos e que influenciam de formas diferenciadas as qualidades de solo degradado, permitindo rápido crescimento de espécies nativas utilizadas em reflorestamento.
Tendo em vista as espécies com alta frequência em reservatórios, a planta daninha aquática com mais problemas no país é a Eichhornia crassipes. O estudo de Inácio (2012), realizado com o uso dessa espécie obtida no reservatório da Usina Hidrelétrica Corumbá IV (proximidades de Luziânia (GO)), visou constatar sua utilização como fonte de nutrientes para plantios de arbóreas nativas do Cerrado na Área de Preservação Permanente do reservatório da UHE. Partindo da premissa que um dos principais mecanismos de reabastecimento de nutrientes é a decomposição, Inácio (2012) avaliou a recuperação do solo utilizando como referência o incremento da comunidade de microartrópodos edáficos. Como a decomposição é um processo vital para o solo, os microartrópodos se apresentam como ótimo indicador biológico de sucesso do seu funcionamento. Segundo Santos & Whitford (1981) os microartrópodos edáficos exercem função direta nos mecanismos de decomposição; quando não estão presentes no solo observa-se uma queda acentuada na velocidade dos processos de decomposição. Portanto, são ótimos indicadores do funcionamento do processo de decomposição, que por sua vez é um mecanismo vital para o reabastecimento de nutrientes no solo.
Na busca de alternativas de destinação das macrófitas aquáticas e diminuição dos custos com a remoção mecânica foi observado que quando as macrófitas aquáticas passam pelo processo de compostagem elas auxiliam no desenvolvimento da comunidade de microartrópodos edáficos e concomitantemente no desenvolvimento da maioria das espécies arbóreas utilizadas nos plantios de recuperação florestal. A pesquisa de Inácio (2012) revelou o aproveitamento da Eichhornia crassipes tanto via sua transformação (compostagem) em adubo quanto pela sua utilização no controle do capim Brachiaria sp.; com os recursos fertilizantes direcionados para estabelecimento das mudas na APP e biomassa seca adicionada no entorno da muda, abafando a gramínea e promovendo acúmulo de umidade no solo.
A produtora de energia Corumbá Concessões, para evitar que os bancos de macrófitas interfiram na captação de água para a geração de energia, vem pelo ao menos 12 anos realizando a remoção do excesso das macrófitas do reservatório e incentivado a produção do composto orgânico. “Com o apoio na implantação do viveiro de produção de mudas, esse composto vem sendo utilizado como substrato, favorecendo o crescimento e fortalecimento das mudas plantadas na APP do reservatório”. Além disso, as mudas produzidas têm sido destinadas aos programas de educação ambiental da empresa (GUEDES, 2016 cit. por GUARANYS, 2019).
O estudo de Sampaio & Oliveira (2005) está relacionado ao aproveitamento da macrófita aquática Egeria densa como adubo orgânico nos reservatórios do sistema hidrelétrico de Paulo Afonso e Itaparica, no Rio São Francisco. O descarte da massa de Egeria densa retirada das grades, que retêm a vegetação de alcançar as turbinas, tem sido um problema para a Companhia Hidro Elétrica do São Francisco (CHESF). Também outras instituições, como a Prefeitura de Paulo Afonso e proprietários de terras nas margens dos lagos, têm tido dúvidas de como descartar o material retirado dos reservatórios infestados. Uma das alternativas de uso seria a incorporação ao solo, como adubação orgânica.
Para testar esta possibilidade, Sampaio & Oliveira (2005) compararam a incorporação da massa de Egeria densa com a de esterco bovino, um adubo orgânico tradicional na região, usando o milho como cultura-teste. O estudo concluiu que o aproveitamento, como adubo orgânico, da massa de Egeria densa retirada das grades das turbinas e da limpeza de reservatórios é recomendável. Dessa forma, resolve-se o problema de destinação adequada de um material até então tratado como passivo ambiental, ao mesmo tempo em que se incorporam nutrientes ao solo e se aumenta a produção agrícola. A adubação com Egeria densa não estaria elevando os riscos de contaminação daqueles que consumissem o milho, além dos já normalmente existentes na região.
Nesta linha de pesquisa, vários trabalhos foram conduzidos visando avaliar os efeitos das incorporações de macrófitas aquáticas sobre propriedades físicas, químicas e biológicas de solos e, em especial, solos degradados.
Pitelli (2003) sugere que as macrófitas retiradas de corpos hídricos podem constituir importantes materiais para recuperação de áreas degradadas pelas atividades de construção de usinas hidrelétricas. Para esse autor, a incorporação de biomassa de macrófitas aquáticas provenientes de reservatórios em solo degradado pode ser uma opção viável para a sustentabilidade da remoção mecânica de macrófitas aquáticas.
De acordo com Esteves (1998), várias espécies de macrófitas aquáticas têm sido utilizadas para aumentar a fertilidade do solo. Nos países asiáticos, onde mais se tem utilizado esta técnica, as principais espécies utilizadas são: Pistia stratiotes, Hydrilla verticillata, Salvínia sp, Eichhornia crassipes. O mesmo autor comenta que devido ao alto teor de potássio destas plantas, os solos lateríticos são os mais adequados para serem adubados com macrófitas aquáticas. Outra vantagem da adubação com macrófita aquática é a possibilidade de se aumentar o grau de umidade do solo. Um paradoxo, visto que por outro lado é justamente o alto teor da água que reduz seu valor como adubo, devido ao grande volume e à pequena contribuição como matéria orgânica para o solo.
A macrófita aquática Azolla pinnata, que vive na água em simbiose com a alga Anabaena azollae, tem sido muito empregada para aumentar a fertilidade de solos úmidos. Este método consiste em aumentar o teor de nitrogênio do solo, através de sua fixação por meio de alga simbionte. No Vietnan do Norte e na China, os agricultores constroem pequenas represas que servem de “criadouros” de Azolla pinnata. O aumento de produtividade nas plantações de arroz adubadas com Azolla pinnata tem sido de 50-100% (ESTEVES, 1998).
Para o estabelecimento de plantas em solos degradados é necessária a utilização de insumos químicos e orgânicos (Leite et al., 1994). Considerando os trabalhos de recuperação em áreas onde os horizontes superficiais do solo foram removidos, a necessidade de adição de matéria orgânica é ainda maior; portanto é necessário buscar alternativas para introdução de insumos orgânicos que melhorem as condições mencionadas.
Segundo Resende (s/d) o substrato para produção de mudas tem por objetivo fornecer condições para que a planta se estabeleça e se desenvolva bem em seus primeiros meses de vida; e que forme torrão adequado para ser transplantada para o campo. Ele deve simular as condições do solo, sendo composto por materiais capazes de fornecer nutrientes para as plantas, mas permitir também a formação do torrão e ainda ter drenagem satisfatória para o desenvolvimento da espécie a ser produzida. Podem ser utilizados compostos orgânicos (macrófitas trituradas), vermiculita, areia, horizontes superficiais ou subsuperficiais, esterco animal, serragem, casca de árvore, carvão triturado, restos de poda e culturas agrícolas, bagaço de cana, etc.. Dois ou mais desses materiais devem ser misturados, visando uma boa aeração, drenagem e suprimento de nutrientes para as mudas.
Segundo Vilela (2016), o emprego da macrófita aquática como fertilizante é possível por meio da compostagem, ou seja, processo biológico que, sob condições físicas e químicas adequadas, promove a decomposição do resíduo orgânico resultando como produto final o fertilizante orgânico. Além de reduzir à metade a massa vegetal processada, obtém-se no curto prazo um produto final bioestabilizado (composto orgânico), que pode ser empregado na agricultura ou no solo sem risco ambiental significativo.
Nos estudos de Yamauchi (2014), o processo de compostagem foi realizado com material vegetal coletado no reservatório de Santana (Light/RJ); triturado por uma picadora e enleirado de forma piramidal em baias de cimento protegidas da ação da chuva[31]. Para favorecer o fornecimento de oxigênio para as camadas mais internas da leira o material foi revolvido a cada quatro dias (evitar formação de zonas anóxicas)[32]. Outro objetivo do revolvimento periódico foi a homogeneização da biomassa, que melhora o contato da comunidade microbiana aeróbica com o material orgânico.
A compostagem traz grandes vantagens na formulação de substratos quando comparado ao uso de esterco curtido, pois no processo de estabilização da matéria orgânica, a elevação da temperatura elimina ervas daninhas e pode eliminar patógeno também, além de aumentar a concentração de nutrientes no material compostado.
A compostagem apresenta como desvantagem a extensão da área onde o material deverá ser trabalhado, o qual deve ser suficientemente grande para a disposição das leiras. O material orgânico deve estar isento de contaminação, pois compostos com altos percentuais de metais pesados devem ser descartados (VILELA, 2016).
A pesquisa de Farias et al. (2013) avaliou o efeito de substratos compostos com as espécies aquáticas Eichhornia crassipes, Pistia stratiotes e Typha domingensis no crescimento inicial e no teor de macronutrientes de mudas de Moringa (Moringa oleifera Lam.), espécie arbórea da família Moringaceae, resistente e adaptada às condições semiáridas do nordeste brasileiro. Os substratos foram compostos por diferentes proporções de Eichhornia crassipes, Pistia stratiotes e Typha domingensis (Macrófitas (M)) adicionadas a esterco bovino (E) e terra vegetal (TV), também em diferentes proporções. As combinações dos materiais orgânicos e da terra vegetal formaram os seguintes substratos: 100M; 60M + 30 E + 10 TV; 70M + 20 E + 10 TV e 70M + 30 TV, para cada uma das três espécies de macrófitas. As concentrações dos constituintes do substrato expressas em % estão apresentadas na tabela 4. A composição química dos substratos resultantes esta expressa na tabela 5.
TABELA 4: COMPOSIÇÃO DOS SUBSTRATOS PRODUZIDOS COM MACRÓFITAS AQUÁTICAS.
|
Tratamentos |
Macrófitas M(%) |
Esterco E (%) |
Terra vegetal TV (%) |
|
|
1 |
Pistia stratiotes |
100 |
0 |
0 |
|
2 |
70 |
30 |
10 |
|
|
3 |
70 |
20 |
10 |
|
|
4 |
70 |
30 |
0 |
|
|
5 |
Eichhornia crassips |
100 |
0 |
0 |
|
6 |
60 |
30 |
10 |
|
|
7 |
70 |
20 |
10 |
|
|
8 |
70 |
30 |
0 |
|
|
9 |
Typha dominguensis |
100 |
0 |
0 |
|
10 |
60 |
30 |
10 |
|
|
11 |
70 |
20 |
10 |
|
|
12 |
70 |
30 |
0 |
|
FONTE: FARIAS et al. (2016).2/6p.
TABELA 5: CARACTERIZAÇÃO QUÍMICA DA TERRA VEGETAL, ESTERCO BOVINO E DAS MACRÓFITAS AQUÁTICAS UTILIZADAS NA FORMAÇÃO DOS SUBSTRATOS.
|
Componentes |
N |
P |
K |
COT |
C/N |
|
(g kg-1) |
- |
||||
|
Terra vegetal |
35,64 |
0,572 |
4,24 |
49,77 |
1,4 |
|
Esterco bovino |
15,91 |
26,39 |
70,84 |
363,44 |
22,88 |
|
Pistia stratiotes (Alface-d’água) |
24,87 |
12,11 |
35,7 |
238,24 |
9,57 |
|
Eichhornia crassipes (Aguapé) |
14,89 |
11,33 |
70,24 |
614,18 |
41,44 |
|
Typha domingensis (Taboa) |
3,67 |
1,48 |
8,17 |
281,92 |
77,1 |
|
COT- carbono orgânico total. |
|||||
FONTE: FARIAS et al. (2016) 3/6p.
Observou-se que os quatro tipos de substratos promoveram crescimento em diâmetro de copa e comprimento de raízes semelhantes. As mudas cultivadas nos substratos 100M de cada uma das 3 macrófitas apresentaram menor crescimento em altura e diâmetro do caule. A presença de esterco bovino no substrato influenciou positivamente no desenvolvimento das plantas de moringa.
As mudas de moringa apresentaram menor desenvolvimento quando produzidas em substratos constituídos unicamente com Typha domingensis. As mudas de moringa produzidas com a taboa apresentaram menores teores de N, explicado pelo baixo teor deste nutriente nesta macrófita.
Alface d’água e substrato 100M apresentaram as mudas com os menores valores de potássio.
Pistia stratiotes e os substratos compostos por 60% macrófita + 30% esterco + 10% terra vegetal e 70% macrófita + 30% esterco proporcionam maior nutrição e crescimento de mudas de moringa. O substrato com 60% macrófita + 30% esterco + 10% terra vegetal composto por Eichhornia crassipes mostrou-se bom fornecedor de P às mudas de moringa.
Henry-Silva & Camargo (2006), analisando os conteúdos dos macronutrientes e micronutrientes na biomassa das macrófitas aquáticas, constataram que Eichhornia crassipes apresentou valores mais elevados de cálcio, magnésio, manganês, zinco, ferro e cobre, quando comparados com os valores encontrados na biomassa de Pistia stratiotes (Tabela 6). Mencionam que os valores observados podem ser considerados relativamente altos, especialmente para a biomassa de Eichhornia crassipes, quando comparados com os teores na biomassa de espécies forrageiras (Tabela 7), sugerindo a possibilidade de aproveitamento dessas macrófitas aquáticas como fertilizantes.
TABELA 6: VALORES DE MATÉRIA MINERAL, PROTEÍNA BRUTA, MACRO E MICRONUTRIENTES (P, N, CA, MG, MN, ZN, FE E CU), FRAÇÃO DE PAREDE CELULAR, POLIFENÓIS, CARBOIDRATOS SOLÚVEIS E LIPÍDEOS NA BIOMASSA TOTAL (MASSA SECA) DE Eichhornia crassipes e Pistia stratiotes.
|
Composição |
Eichhornia crassipes |
Pistia stratiotes |
|
Matéria mineral (%) |
17,09 |
18,95 |
|
Proteína bruta (%) |
12,45 |
15,02 |
|
Fósforo total(%) |
0,26 |
0,38 |
|
Nitrogênio total (%) |
2,00 |
2,40 |
|
Cálcio (%) |
1,51 |
1, 09 |
|
Magnésio (mg kg-1) |
3916,67 |
2145,83 |
|
Manganês (mg kg-1) |
1233,33 |
2145,83 |
|
Zinco (mg kg-1) |
81,83 |
29,83 |
|
Ferro (mg kg-1) |
5425,00 |
1391,67 |
|
Cobre (mg kg-1) |
25,83 |
9,17 |
|
Fração de parede celular (%) |
53,45 |
56,90 |
|
Polifenóis (UDO g-1) |
0,44 |
0,42 |
|
Carboidratos solúveis (mg L-1) |
14,47 |
12,39 |
|
Lipídeos (%) |
4,73 |
4,44 |
FONTE: Henry-Silva & Camargo, 3/8p. (2006).
TABELA 7: VALORES COMPARATIVOS DE MICRONUTRIENTES NA BIOMASSA TOTAL DE Eichhornia crassipes, Pistia stratiotes E ESPÉCIES FORRAGEIRAS.
|
Espécie |
Cu |
Fe |
Mn |
Zn |
|
mg.Kg-1 |
||||
|
Eichhornia crassipes 4(Aguapé) |
25,8 |
5.425,0 |
1.233,3 |
81,8 |
|
Pistia stratiotes4(Alface-d’água) |
9,2 |
1.391,7 |
430,0 |
29,8 |
|
Panicum maximum1(Capim-colonião) |
7,3 |
124,0 |
90,0 |
20,7 |
|
Panicum maximum2(Capim- colonião) |
4,3 |
154,0 |
174,0 |
31,0 |
|
Hyparrenia rufa1(Capim-jaraguá) |
2,8 |
166,0 |
273,0 |
26,6 |
|
Hyparrenia rufa2, 3(Capim-jaraguá) |
2,2 |
281,0 |
106,0 |
23,0 |
|
Melinis minutiflora1(Capim-gordura) |
5,8 |
161,0 |
123,0 |
42,0 |
|
Melinis minutiflora2, 3(Capim-gordura) |
4,5 |
487,0 |
126,0 |
21,0 |
|
Pennisetum purpureum1(Capim-elefante) |
10,2 |
178,0 |
179,9 |
40,1 |
|
Digitaria decumbens1(Capim-pangola) |
6,1 |
137,0 |
197,0 |
30,4 |
|
Brachiaria decumbens1(Capim-braquiária) |
6,3 |
187,0 |
108,0 |
27,3 |
|
Paspalum notatum1(Grama-batatais) |
7,0 |
142,0 |
116,0 |
19,7 |
|
1 Gallo et al. (1974); 2 Sousa et al. (1980); 3 Sousa et al. (1981); 4 Henry-Silva e Camargo (2006) |
||||
FONTE: Henry-Silva & Camargo, 5/8p. (2006).
Henry-Silva & Camargo (2006) constataram que a incorporação de Eichhornia crassipes em diferentes tipos de solo proporcionou produção de milho semelhante ou até mesmo superior à obtida em solos adubados com fertilizantes comerciais.
O uso da macrófita aquática Eichhornia crassipes, para produção de substratos, constitui uma alternativa sustentável e econômica, baseada em princípios ecológicos, por encontrar-se disponível de forma abundante em corpos d’água com níveis significativos de poluição e pelo potencial fitorremediador no tratamento efetivo de uma ampla variedade de poluentes orgânicos e inorgânicos, pois apresentam grande capacidade de absorção de nutrientes (PALMA-SILVA et al., 2012).
A Figura 4 ilustra a remoção e acondicionamento da biomassa de macrófitas obtidas pela remoção mecânica do reservatório da UHE Aimorés e utilizadas para compostagem do composto orgânico a ser utilizado na recomposição de APP.
FIGURA 4: COMPOSTAGEM DE MACRÓFITAS NA UHE AIMORÉS: UTILIZAÇÃO NA RECOMPOSIÇÃO VEGETAL DAS ÁREAS DE PRESERVAÇÃO PERMANENTE.

FONTE: Disponível em: https://aliancaenergia.com.br/br/alianca-produz-adubo-organico-a-partir-do-controle-de-plantas-aquaticas-no-reservatorio-da-uhe-aimores/ >. Acesso em 22 ago. 2021.
O ponto de partida para um plantio com mudas certamente é a sua produção. O sucesso ou não do plantio depende, basicamente em sua fase inicial, da qualidade da muda produzida, que, entre outros fatores, depende da qualidade da semente, substrato[33] e manejo durante sua fase de produção (DIAS, 2019).
O substrato é o meio em que as raízes se proliferam, Scremin-Dias et al. (2006), afirmam que a escolha e o preparo dos substratos são decisões importantes, pois não há um substrato ótimo para todas as espécies. Um bom substrato deve ter características que permitirão bom desenvolvimento radicular, retenção equilibrada de água, e um nível adequado de fertilidade, permitindo a absorção de água e nutrientes e não deve conter patógeno e assim contribuir para que as mudas cresçam e se desenvolvam satisfatoriamente com potencial máximo para sobrevivência após serem transplantadas para o campo (SOUZA et al., 2012).
A utilização de substratos alternativos pode significar menor custo de produção com insumos externos, desde que estes sejam advindos da própria região (OLIVEIRA et al., 2016).
Alguns pesquisadores têm obtido bons resultados com a utilização de substrato de compostagem de macrófitas aquáticas na produção de mudas nativas de qualidade e com menores custos. Costa de Morais et al. (2020) avaliaram o efeito do substrato de compostos de macrófitas aquáticas (Eichhornia crassipes) no crescimento inicial do Libidibia ferrea (Mart. ex Tul.) e concluíam que usar as macrófitas aquáticas para produção de composto orgânico é uma alternativa sustentável. Em trabalhos futuros, recomenda-se a utilização de doses maiores de composto de macrófitas, bem como a comparação do uso desse composto com outros compostos orgânicos na produção de mudas.
O estudo de N. C. de Souza et al.(2021) avaliou a eficiência de proporções de Salvínia auriculata na composição de substrato para a produção de mudas de Trema micrantha (L.) Blume (Grandiúva); e constatou que as características químicas do substrato foram melhoradas à medida que a proporção aumentou, resultando em uma redução de Al e aumento de pH, CTC, saturação por bases, teores de K, Ca, Mg, P e matéria orgânica. Logo, o crescimento das mudas de Grandiúva foi influenciado pelos níveis de fertilidade do substrato. As maiores alturas de planta, diâmetros de caule, massa seca e acúmulo de macronutrientes foram verificados nos tratamentos com 75% e 100% de composto orgânico.
Santos e Secco (2019) fizeram a comparação dos custos totais com utilização de resíduos orgânicos (macrófitas de reservatório de hidrelétrica e cinzas residuais produção sucroalcooleira) e fertilizante mineral (NPK 8-28-16 + ureia + calcário) visando proporcionar condições de receber e dar suporte à recomposição de vegetação de cerrado em uma área degradada de 3,4 hectares. Concluíram que a utilização do composto agroindustrial obteve-se o custo menor em relação à utilização de fertilizantes minerais.
Considerando a grande concentração de usinas alcooleiras e usinas hidrelétricas na região de estudo (Selvíria, MS), os resíduos produzidos por elas, se tornam viáveis a utilização em locais próximos as unidades produtoras, pois o transporte desse composto é o que pode ter a variação no custo. Além de que, uma disposição ambientalmente correta e com resultados convincentes para esses resíduos na utilização em recuperação de áreas degradadas, se torna uma prática sustentável tanto para as indústrias como para o proprietário do imóvel rural.
6. Considerações finais
A pesquisa revelou que entre as espécies de macrófitas aquáticas ocorrem diferentes respostas às variações ambientais, tornando-as distintas entre si quanto à composição de nutrientes na sua biomassa. Um dos estudos mostrou que a concentração de potássio no aguapé (Eichhornia crassipes) é cerca de duas vezes maior que a encontrada na alface d’água (Pistia stratiotes); outro estudo observou que a primeira apresentava concentrações bem mais elevadas de cobre, ferro, manganês e zinco. Considerando que expressões fenotípicas dessas plantas respondem sensivelmente aos gradientes ambientais, sugere-se a concentração de esforços para melhor conhecimento científico das diferentes espécies, visando seu possível aproveitamento como insumo para a melhoria do solo em áreas de recuperação no entorno dos reservatórios; ou ainda a utilização da biomassa para a confecção de adobe ou briquetes, por exemplo, promovendo o encapsulamento de poluentes no caso de material de macrófitas com concentrações elevadas de metais pesados.
O controle mecânico dessas plantas tem sido o manejo mais utilizado para a não interrupção na geração de energia, sendo a remoção e deposição dessa biomassa uma necessidade que, não estando adequadamente regulamentada, caracteriza passivo ambiental. As alternativas de uso da biomassa, acima mencionadas, contribuem para a redução desse passivo. A vulnerabilidade ambiental de reservatórios, aliada ao déficit estrutural dos serviços de saneamento básico, dificulta a tomada de decisão quanto à adoção de ações de controle e reversão do processo de eutrofização.
Aos órgãos ambientais cabe definir a regulamentação da destinação ambientalmente adequada do excedente das macrófitas como condicionante para renovação da Licença de Operação. A pesquisa, apesar de ainda incipiente, tem feito sua parte, mostrando que essa biomassa excedente pode ser insumo para a recuperação do solo, favorecendo o processo de revegetação das áreas degradadas no entorno nos reservatórios hídricos.
7. REFERÊNCIAS BIBLIOGRÁFICAS
ALMADA, E.V.C. Proposta de Mitigação da Eutrofização na Lagoa do Vigário-RJ através da Macrófita Eichhornia Crassipes: de Praga a Fitorremediadora. 2018. 15/93p. Tese (Doutorado em Ecologia e Recursos Naturais) - Universidade Estadual do Norte Fluminense Darcy Ribeiro – UENF, Campos dos Goytacazes, 2018. Disponível em: < https://uenf.br/posgraduacao/ecologia-recursosnaturais/wp-content/uploads/sites/7/2019/02/Tese-Doutorado-Eliliane-FINAL.pdf > Acesso em 12 abr. 2021.
AMADEU, M.S.U.S.; MENGATTO, A.P.F.; STROPARO, E.F.; DE ASSIS, T.T.S. Manual de normalização de documentos científicos de acordo com as normas da ABNT. Curitiba: Ed. UFPR, 2015.327p. Disponível em: < https://acervodigital.ufpr.br/bitstream/handle/1884/45654/Manual_de_normalizacao_UFPR.pdf?sequence=1&isAllowed=y >. Acesso em 23 set. 2021.
AGÊNCIA NACIONAL DE ÁGUAS E SANEAMENTO BÁSICO (Brasil). Conjuntura dos recursos hídricos no Brasil 2020: informe anual / Brasília: ANA, 2020, 129p. Disponível em: < http://conjuntura.ana.gov.br/static/media/conjuntura-completo.23309814.pdf >. Acesso em 29 ago. 2021.
AGÊNCIA NACIONAL DE ÁGUAS E SANEAMENTO BÁSICO: ANA. (Site) Política Nacional de Recursos Hídricos. Ministério do Desenvolvimento Regional, Assuntos, Gestão das águas, 2p. Disponível em: < https://www.gov.br/ana/pt-br/assuntos/gestao-das-aguas/politica-nacional-de-recursos-hidricos >. Acesso em 29 ago. 2021.
ANTUNES, R.P. Análise do potencial de uso das macrófitas aquáticas do sistema de áreas alagadas construídas da ETE da Comunidade de Serviços Emaús (Ubatuba, SP) como adubo orgânico. Dissertação (Mestrado: Ciências da Engenharia Ambiental), Escola de Engenharia de São Carlos, Universidade de São Paulo. São Carlos, 2009, 87p. Disponível em: < https://www.teses.usp.br/teses/disponiveis/18/18139/tde-04122009-111621/publico/dissertacaoRenataPinassiAntunes.pdf >. Acesso em 08 ago. 2021.
ASSIS, I. R.; DIAS, L.E. Recuperação de Áreas Degradadas: Bacias Hidrográficas. (Apostila) EAD/CEAD/UFV/MG, 2019, 18p.
BARBOSA, A.C. ; GENTIL, T.C. Histórico do manejo de Macrófitas Aquáticas no Reservatório Guarapiranga. (Artigo) Anais II Seminário de Recursos Hídricos da Bacia Hidrográfica do Paraíba do Sul: Recuperação de Áreas Degradadas, Serviços Ambientais e Sustentabilidade, Taubaté, Brasil, 09 -11 dezembro 2009, IPABHi, p. 585-592. (doi:10.4136/serhidro.76) 2009, 8p. Disponível em: < http://www.ipabhi.org/serhidro/anais/anais2009/doc/pdfs/p76.pdf >. Acesso em 22 jul. 2021.
BIUDES, J.F.V. ; CAMARGO, A.F. M. Estudos dos Fatores Limitantes à Produção Primária por Macrófitas Aquáticas no Brasil – Artigo: 13p. Oecologia Brasiliensis, ISSN-e 1981-9366, Volume 12, Nº. 1, 2008, 7/19p. Disponível em: < https://dialnet.unirioja.es >. Acesso em 05 ago. 2021.
BOLLMANN, H. A; CARNEIRO, C.; PERGORINI, E. S. Qualidade da Água e Dinâmica de Nutrientes. In: ANDREOLI, C.V.; CARNEIRO, C. Gestão Integrada de Mananciais de Abastecimento Eutrofizados. Curitiba: Gráfica Capital, Ltda., 2005. 500p. cap. 7, p. 213-270. Disponível em: < https://capacitacao.ana.gov.br/conhecerh/bitstream/ana/2205/2/Unidade_2.pdf > Acesso em 25 jul. 2021.
BONINI, C. S. B.; ALVES, M. C. Recuperação das Propriedades Físicas do Solo por Meio de Adubos Verdes, Calagem, Gesso, Pastagem e Espécies de Ocorrência Espontânea. (Artigo) Revista Brasileira de Ciência do Solo. Volume 35, nº 4, 2011, 10p. Disponível em: < https://www.scielo.br/j/rbcs/a/k3r4hXxMPZ5P8qtbrVmp4Hf/?format=pdf&lang=en > Acesso em 26 set. 2021.
BORTOLOTTO, J.M.; NETO, G.G. O uso do camalote, Eichhornia crassipes (Mart.). Solms, Pontederiácea, para confecção de artesanato no Distrito de Albuquerque, Corumbá, MS, Brasil. (Artigo) Acta Botânica Brasílica 19(2): 331-337. 2005, 7p. Disponível em: < https://www.researchgate.net/publication/250021629_O_uso_do_camalote_Eichhornia_crassipes_Mart_Solms_Pontederiaceae_para_confeccao_de_artesanato_no_Distrito_de_Albuquerque_Corumba_MS_Brasil/link/03b29ca10cf299f961f64fee/download >. Acesso em 15 ago. 2021.
BRASIL. Lei nº 12.651, de 25 de maio de 2012. Dispõe sobre a proteção da vegetação nativa; altera as Leis no 6.938, de 31 de agosto de 1981, 9.393, de 19 de dezembro de 1996, e 11.428, de 22 de dezembro de 2006; revoga as Leis no 4.771, de 15 de setembro de 1965, e 7.754, de 14 de abril de 1989, e a Medida Provisória no 2.166-67, de 24 de agosto de 2001; e dá outras providências. Disponível em:< http://www.planalto.gov.br/ccivil_03/_ato2011-2014/2012/lei/L12651compilado.htm >. Acesso em: 01 set. 2021.
_______. Lei nº 12.727 de 17 de outubro de 2012. Altera a Lei no 12.651, de 25 de maio de 2012, que dispõe sobre a proteção da vegetação nativa; altera as Leis nos 6.938, de 31 de agosto de 1981, 9.393, de 19 de dezembro de 1996, e 11.428, de 22 de dezembro de 2006; e revoga as Leis nos 4.771, de 15 de setembro de 1965, e 7.754, de 14 de abril de 1989, a Medida Provisória no 2.166-67, de 24 de agosto de 2001, o item 22 do inciso II do art. 167 da Lei no 6.015, de 31 de dezembro de 1973, e o § 2o do art. 4o da Lei no 12.651, de 25 de maio de 2012. Disponível em: http://www.planalto.gov.br/ccivil_03/_ato2011-2014/2012/lei/L12727.htm >. Acesso em: 01 set. 2021.
_______. Lei nº 9.433, de 8 de janeiro de 1997. Institui a Política Nacional de Recursos Hídricos, cria o Sistema Nacional de Gerenciamento de Recursos Hídricos, regulamenta o inciso XIX do art. 21 da Constituição Federal, e altera o art. 1º da Lei nº 8.001, de 13 de março de 1990, que modificou a Lei nº 7.990, de 28 de dezembro de 1989. Diário Oficial da República Federativa do Brasil, Brasília, DF 09/01/1997, P. 470. Disponível em: http://www.planalto.gov.br/ccivil_03/leis/L9433.htm >. Acesso em: 01 set. 2021.
_______. Ministério do Meio Ambiente. Resolução CONAMA nº 357, de 15 de junho de 2005. Alterada pelas Resoluções CONAMA n° 393/2007, N° 397/2008, N° 410/2009 e N° 430/2011. Dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes, e dá outras providências. Disponível em: < www.icmbio.gov.br/cepsul/images/stories/legislacao/Resolucao/2005/res_conama_357_2005_classificacao_corpos_agua_rtfcda_altrd_res_393_2007_397_2008_410_2009_430_2011.pdf >. Acesso em 22 set. 2021.
_______. Lei nº 6.938 de 31 de agosto de 1981. Dispõe sobre a Política Nacional do Meio Ambiente, seus fins e mecanismos de formulação e aplicação, e dá outras providências. Disponível em: < http://www.planalto.gov.br/ccivil_03/leis/L6938compilada.htm >. Acesso em: 01 ago. 2021.
CONSELHO NACIONAL DO MEIO AMBIENTE-CONAMA. Resolução CONAMA Nº 467, de 16 de julho de 2015. Dispõe sobre critérios para a autorização de uso de produtos ou de agentes de processos físicos, químicos ou biológicos para o controle de organismos ou contaminantes em corpos hídricos superficiais e dá outras providências. 2015. 4p. Disponível em:<https://www.icmbio.gov.br/cepsul/images/stories/legislacao/Resolucao/2015/res_conama_467_2015_disp%C3%B5e_crit%C3%A9rios_autoriza%C3%A7%C3%A3o_uso_produtos__agentes_processos_f%C3%ADsicos_qu%C3%ADmicos_biol%C3%B3gicos_controle_organismos_contaminantes_corpos_h%C3%ADdricos_superficiais.pdf> Acesso em 7 de set. 2021.
CASSIOLATO, A.M.R.; SANTOS, C.M.; MALTONI, K.L.; MACHADO, K. S. Resíduos orgânicos e fósforo como condicionantes de solo degradado e efeitos sobre o crescimento inicial de Dipteryx alata Vog. (Artigo) Ciência Florestal, Santa Maria, v. 24, n. 3, p. 541-552, jul.-set. 2014. ISSN 0103-9954. Disponível em: < https://periodicos.ufsm.br/cienciaflorestal/article/view/4010/pdf >. Acesso em 25 jul. 2021.
COMPANHIA AMBIENTAL DO ESTADO DE SÃO PAULO (CETESB) – (Site) Mortandade de Peixes – 2021 – Oxigênio Dissolvido - Disponível em: < https://cetesb.sp.gov.br/mortandade-peixes/alteracoes-fisicas-e-quimicas/oxigenio-dissolvido/ >. Acesso em 12 abr. 2021.
COMPANHIA ENERGÉTICA DE MINAS GERAIS, CEMIG. Macrófitas Aquáticas: Caracterização e importância em reservatórios hidrelétricos, 1ª Edição: ISBN 978-85-87929-85-3: Belo Horizonte. 2021, 16/17/96p. Disponível em: < https://www.cemig.com.br/wp-content/uploads/2021/03/livro-macrofitas-cemig-2021.pdf > Acesso em 22 set. 2021.
COSTA de MORAIS, E.R.C. NOGUEIRA, H.C.N.; FAUSTINO, S.J.B.; GAUDÊNCIO, H.R. da S.C. Avaliação de substrato de macrófita aquática para o crescimento de mudas de Jucá (Libidibia ferrea). (Artigo) Research, Society and Development, v. 9, nº. 8, e399985869, 2020 (CC BY 4.0) | ISSN 2525-3409 | DOI: http://dx.doi.org/10.33448/rsd-v9i8.58693 > 2020, 13p.Disponível em: < https://www.researchgate.net/publication/343221201_Avaliacao_de_substrato_de_macrofita_aquatica_para_o_crescimento_de_mudas_de_Juca_Libidibia_ferrea >. Acesso em 22 set. 2021.
DIAS, L.D. Recuperação Ecológica de Ambientes Degradados: SER (Sociedade Internacional para a Recuperação Ecológica). (Apostila) Curso de pós-graduação lato sensu em Recuperação de Áreas Degradadas: EAD/CEAD/UFV/MG, 2019, 8/37p.
DIAS L. E.; FRANCO, A. A.; CAMPELLO, E. F. C. Fertilidade do solo e seu manejo em áreas degradadas. Fertilidade do solo. Viçosa: Sociedade Brasileira de Ciência do Solo (cap. 17), 2007, 955/990p.
DIECKOW, J. Matéria Orgânica do Solo. (Apostila) Pós Graduação em Fertilidade do Solo e Nutrição de Plantas – UFPR, s/d. 58p. Disponível em: < http://ead.pecca.com.br/pluginfile.php/25766/mod_resource/content/2/Apostila.pdf >. Acesso em 11 ago. 2021.
ECOLOGY BRASIL. UHE Tibagi Montante: Subprograma de Manejo de Macrófitas Aquáticas. SPE-TBG-MAM-CTE-017-2020. Anexo 8: Relatório 2020, 49/76p. Disponível em < http://www.tibagienergia.com.br/documentos/relatorio4_acompanhamento_lo/Anexo8.pdf >. Acesso em 03 ago. 2021.
ECOLOGY BRASIL & ECOSAFE. UHE Tibagi Montante: Subprograma de Manejo de Macrófitas Aquáticas. Adendo: Adequação de Metodologias de Manejo. Anexo 6.2: 2021, 13p. Disponível em: < http://tibagienergia.com.br/documentos/relatorio6_acompanhamento_lo/anexo-6.2.pdf >. Acesso em 03 ago. 2021.
ECOSAFE - Subprograma de Manejo de Macrófitas Aquáticas Atividades da Campanha de Campo e da Avaliação de Relatórios Envolvendo o Acompanhamento da Comunidade de Macrófitas Aquáticas no Reservatório da UHE Tibagi Montante. SPE-TBG-REL-MAM-007-2021 13/47p. Disponível em: < http://tibagienergia.com.br/documentos/relatorio6_acompanhamento_lo/anexo-6.1.pdf > Acesso em 27 jun. 2021.
ECOSAFE. Atividades da Campanha de Campo e da Avaliação de Relatórios Envolvendo o Acompanhamento da Comunidade de Macrófitas Aquáticas. Relatório 02/04. UHE Tibagi Montante: Subprograma de Manejo de Macrófitas Aquáticas Anexo 6.1, 2021, 47p. Disponível em: < http://tibagienergia.com.br/documentos/relatorio6_acompanhamento_lo/anexo-6.1.pdf . Acesso em 03 ago. 2021.
ESTEVES, F. A. Fundamentos de Limnologia. Rio de Janeiro: Interciência: INEP. 1988b. 575 p.
____________. Fundamentos de limnologia. 2ª. Ed. Rio de Janeiro: Interciência/FINEP, 1998, 226p. Disponível em: < https://docplayer.com.br/7299410-Fundamentos-de-limnologia.html >. Acesso em 22 ago. 2021.
____________. Fundamentos de limnologia. 3ª. Ed. Rio de Janeiro: Interciência, 2011, 826p.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA, E. Pesquisa desenvolve fertilizante orgânico a partir da biomassa de plantas. Portal Embrapa. Disponível em: <https://www.embrapa.br/busca-de-noticias/-/noticia/37485979/pesquisa-desenvolve-fertilizante-organico-a-partir-da-biomassa-de-plantas>. Acesso em: 21 set. 2021.
FARIA, O.B. & ESPÍNDOLA, E.L.G. Adobe Produzido com Macrófitas Aquáticas: Uma alternativa para retirada e encapsulamento de poluentes de lagos e reservatórios. (Artigo) Revista Brasileira de Ciências Ambientais: ABES/RBCamb : ICTR – Instituto de Ciência e Tecnologia em Resíduos e Desenvolvimento Sustentável NISAM - USP – Núcleo de Informações em Saúde Ambiental da USP, 2005, 8-20/64p. Disponível em: < http://rbciamb.com.br/index.php/Publicacoes_RBCIAMB/issue/view/54/65 >. Acesso em 22 set. 2021.
FARIAS, W.M.; ANDRADE, L. de; PEREIRA, E.D.; DIAS, B.O.; ALBUQUERQUE, M.B. de; FRAGA, V. da S. (Artigo) Propriedades físicas e químicas de substratos produzidos utilizando macrófitas aquáticas - DOI 10.5433/1679-0359.2013v34n6Supl1p3257 - Semina: Ciências Agrárias 2013, 15p. Disponível em:<https://www.researchgate.net/publication/269951299_Propriedades_fisicas_e_quimicas_de_substratos_produzidos_utilizando_macrofitas_aquaticas/link/5f2d31dea6fdcccc43b0cd6f/download > Acesso em 22 set. 2021.
FAVARETTO, B. & PAULETTI, V. Adubos orgânicos minerais fluidos e adubação foliar – (Apostila) Universidade Federal do Paraná Setor de Ciências Agrárias Departamento de Solos e Engenharia Agrícola Curso de Especialização em Fertilidade do Solo e Nutrição de Plantas, 38p. s/d.
FARIAS, W.M; ANDRADE, L.A. de; ALBUQUERQUE, M.B. de; CUNHA, J.R. da. Utilização de macrófitas aquáticas em substrato para a produção de mudas de moringa (Artigo) Pesquisa Florestal Brasileira (PFB). Brazilian Journal of Forestry Research http://pfb.cnpf.embrapa.br/pfb/doi: 10.4336/2016.pfb.36.85.791, 2016, 8p.Disponível em: <https://www.researchgate.net/publication/299982149_Utilizacao_de_macrofitas_aquaticas_em_substrato_para_a_producao_de_mudas_de_moringa#:~:text=A%20utiliza%C3%A7%C3%A3o%20de%20macr%C3%B3fitas%20aqu%C3%A1ticas,P%20e%20K%20nas%20mudas. >. Acesso em 02 ago. 2021.
FLORES, V. Inovação tecnológica no manejo e remoção de macrófitas aquáticas. 2017. (site) Disponível em: < https://victorflores.org/2017/07/30/manejo-e-remocao-de-macrofitas-aquaticas/ >. Acesso em 22 ago. 2021.
GUARANYS, A. Assessoria de Comunicação / Corumbá Concessões - Adubo orgânico de macrófitas é usado na produção de mudas nativas para plantio na APP de Corumbá IV - Viveiristas da Unidade de Compostagem de Aguapés (UCA) são capacitados para a produção de mudas do Cerrado - Jorna Capital do Entorno (eletrônico) Ed. 130 - 21/março/2019. Disponível em < http://www.capitaldoentorno.com.br/adubo-organico-de-macrofitas-e-usado-na-producao-de-mudas-nativas-para-plantio-na-app-de-corumba-iv/> Acesso em 19 jul. 2021.
HENRY-SILVA, G.G. & CAMARGO, A.F.M. Composição química de macrófitas aquáticas flutuantes utilizadas no tratamento de efluentes de aquicultura - Planta Daninha, Viçosa-MG, v. 24, n. 1, p. 21-28, 2006. Disponível em < https://www.scielo.br/pdf/pd/v24n1/a03v24n1.pdf >. Acesso em 30 jul.2021.
INÁCIO, D.V. Avaliação do uso de Macrófitas Aquáticas na Recuperação do Solo e no Desenvolvimento de Espécies Arbóreas do Cerrado em Áreas Degradadas Adjacentes ao Reservatório Utilizado pela Usina Hidrelétrica Corumbá IV – Dissertação (Mestrado em Planejamento e Gestão Ambiental) Universidade Católica de Brasília - 2012, 56p. Disponível em: < https://bdtd.ucb.br:8443/jspui/bitstream/123456789/1651/1/Daniel%20Vieira%20Inacio.pdf >. Acesso 22 jul. 2021.
LANGANKE, R. Conservação para Ensino Médio: Eutrofização. Disponível em: http://ecologia.ib.usp.br/lepac/conservacao/ensino/des_eutro.htm. Acessado em 25/08/2021.
LIMA ABREU, M.V. Estudo Sobre a Dinâmica de Crescimento e Práticas de Manejo de Macrófitas Aquáticas na PCH Santa Rosa II (Bom Jardim/RJ), 2019. 95p. Disponível em: < https://repositorio.ufsc.br/handle/123456789/202777 >. Acesso em 02 ago. 2021.
LIMA, M. L. de. Pesquisa em Fertilidade do Solo e Nutrição de Plantas. (Apostila) UFPR-EAD-PECCA: Pós-graduação em Fertilidade do Solo e Nutrição de Plantas, 2021, 74p.
LOPES, O.M.N. & ALVES, R.N.B. Adubação verde e plantio direto: alternativas de manejo agroecológico para a produção agrícola familiar sustentável. ISSN 1517-2201: Documentos 212. Belém: Embrapa Amazônia Oriental, 2005. 34p. Disponível em: < https://ainfo.cnptia.embrapa.br/digital/bitstream/item/62424/1/DOCUMENTOS-212-Embrapa-A-Oriental.pdf >. Acesso em 25 ago. 2021.
MALAVOLTA, et al. Sobre a composição mineral do aguapé (Eichornia crassipes) Anais da Escola Superior de Agricultura Luiz de Queiroz, 46(1), 155-162. 1989. Disponível em: < https://doi.org/10.1590/S0071-12761989000100011 >. Acesso em 22 jun.2021.
MERENDA, A.M. de C, M.P. Avaliação da comunidade de macrófitas aquáticas no reservatório de Aimorés, composição química das principais espécies e influência da incorporação nas características químicas de um solo degradado. (Tese Doutorado em Agronomia), Faculdade de Ciências Agronômicas, Universidade Estadual Paulista "Júlio de Mesquita Filho", Botucatu, 2011, 99p. Disponível em: < https://repositorio.unesp.br/bitstream/handle/11449/99982/merenda_amcmp_dr_botfca.pdf?sequence=1&isAllowed=y >. Acesso em 03 ago. 2021.
MINISTÉRIO DO MEIO AMBIENTE (MMA). Lei Nº 9.985 de 18 de julho de 2000. Regulamenta o art. 225, § 1o, incisos I, II, III e VII da Constituição Federal, institui o Sistema Nacional de Unidades de Conservação da Natureza e dá outras providências. Diário Oficial da União publicado em 19/06/2000. Disponível em:< http://www.planalto.gov.br/ccivil_03/leis/l9985.htm >. Acesso em 15 jul. 2021.
NAIME, R. Impactos Socioambientais de Hidrelétricas e Reservatórios nas Bacias Hidrográficas Brasileiras. (Artigo) Revista Eletrônica em Gestão, Educação e Tecnologia Ambiental. (e-ISSN: 2236-1308) v(9), nº 9, p. 1924 – 1937, 2012, 12p. Disponível em: < http://dx.doi.org/10.5902/223611706109 >. Acesso em 26 set. 2021.
NATAL, D.; PAGANELLI, C. H.; SANTOS, J. L. H. Composição da população adulta de Culex (Culex) quinquefasciatus Say, 1823 em ecótopos próximos à represa Edgard de Souza, no município de Santana do Parnaíba, Estado de São Paulo, Brasil. Revista Brasileira de Entomologia 35: 1991, 539–543.
OLIVEIRA, W.N.de; LINHARES, G.N.M. Análise Comparativa entre as Áreas de Preservação Permanente antes e após a Construção de Reservatório de Água para Geração de Energia Elétrica. (Artigo) IBEAS – Instituto Brasileiro de Estudos Ambientais: III Congresso Brasileiro de Gestão Ambiental Goiânia/GO – 19 a 22/11/2012. 2012, 1/5p. Disponível em: < https://www.ibeas.org.br/congresso/Trabalhos2012/VIII-019.pdf >. Acesso em 7 set. 2021.
PALMA-SILVA, C.; TRINDADE, C.R. T.; PEREIRA, S.A.; ALBERTONI, E.F. Caracterização e Importância das Macrófitas Aquáticas com Ênfase nos Ambientes Límnicos do Campus Carreiros – (Artigo) FURG, Rio Grande, RS. ISSN1981-0223 Vol.5 nº 2: Cadernos de Ecologia Aquática: 1-22, ago – dez 2010, 22p. Disponível em: < http://repositorio.furg.br/bitstream/handle/1/436/Caracteriza%c3%a7%c3%a3o%20e%20import%c3%a2ncia%20das%20macr%c3%b3fitas%20aqu%c3%a1ticas%20com%20%c3%aanfase%20nos%20ambientes%20l%c3%admnicos%20do%20campus%20Carreiros%20-%20FURG%2c%20Rio%20Grande%2c%20RS..pdf?sequence=1 >. Acesso em 22 ago. 2021.
PEDRALLI, G.; MEYER, S. T.; TEIXEIRA, M. C.; STEHMANN, J. R. Levantamento das macrófitas aquáticas e da mata ciliar do reservatório de Volta Grande, Minas Gerais, Brasil. Iheringia. Série Botânica, Porto Alegre, nº 43, 1993, 29/40p.
POMPEO, M. Monitoramento e Manejo de Macrófitas Aquáticas. (Artigo) Oecologia Brasiliensis, 12 (3): 406-424, 2008, 1/19p. Disponível em: < https://revistas.ufrj.br/index.php/oa/article/download/5734/4320. >. Acesso em 15 ago. 2021.
_________. Monitoramento e manejo de macrófitas aquáticas em reservatórios tropicais brasileiros. ISBN 978-85-85658-67-0, DOI 10.11606/9788585658670, 1ª Ed. São Paulo, Instituto de Biociências da USP, 2017, 12/147p. Disponível em: < http://www.livrosabertos.sibi.usp.br/portaldelivrosUSP/catalog/view/140/118/602-1 >. Acesso em 05 abr. 2021.
PITELLI, R.A.; GRANDE, L.A.B.; VIEIRA, M.O.; PITELLI, R.L.C.M.; FIORILLO C.M.T. Avaliação do Controle Mecânico de Macrófitas Aquáticas na Remoção de Nutrientes da Água e como Bio-Fertilizante na Recuperação de Áreas Degradadas na Light Energia S.A. Anais do VI Congresso de Inovação Tecnológica em Energia Elétrica (VI CITENEL), Fortaleza (CE), 17 a 19 de agosto de 2011.12p. Projeto de P&D 0382-0014/2006 - Disponível em: < https://www.cgti.org.br/publicacoes/wp-content/uploads/2016/03/Avaliac%CC%A7a%CC%83o-do-Controle-Meca%CC%82nico-de-Macro%CC%81fitas-Aqua%CC%81ticas-na-Remoc%CC%A7a%CC%83o-de-Nutrientes-da-A%CC%81gua-e-como-Bio-Fertilizante-na-Recuperac%CC%A7a%CC%83o-de-A%CC%81reas-Degradadas-na-Light-Energia-SA.1.pdf >. Acesso em 31 jul. 2021.
MOHEDANO, R. Jornada de Sustentabilidade na Suinocultura: O uso de lagoas de macrófitas para pós-tratamento e valorização dos subprodutos da digestão anaeróbia na suinocultura. UFSC (Cartilha) 2017, 38/45/45p. Disponível em: < https://repositorio.ufsc.br/xmlui/bitstream/handle/123456789/173931/Jornada%20-%20RMohedano.pdf?sequence=1&isAllowed=y > Acesso em 22 set. 2021.
PROJETO MAPBIOMAS – A Dinâmica da Superfície de Água do Território Brasileiro: Mapeamento da superfície de água no Brasil (Coleção 1), 2021, 16p. Disponível em: < https://mapbiomas-br-site.s3.amazonaws.com/MapBiomas_A%CC%81gua_Agosto_2021_22082021_OK_v2.pdf >. Acesso em 25 ago. 2021.
REIS JUNIOR, F.B. e MENDES, I.C. Biomassa microbiana do Solo – Planaltina, DF: Embrapa Cerrados, 2007. 40 p.- (Documentos / Embrapa Cerrados, ISSN 1517-5111; 205). Disponível em: < https://www.infoteca.cnptia.embrapa.br/bitstream/doc/572256/1/doc205.pdf >. Acesso em 25 jul.2021.
RESENDE, A.S. de. Como Produzir Espécies Florestais Nativas: Apresentação Projeto Brasil Biomas: Embrapa Agrobiologia, s/d, 12/25p. Disponível em:< http://ead.senar.org.br/wp-content/uploads/capacitacoes_conteudos/bioma_mata_atlantica/PRODU%C3%87%C3%83O%20DE%20SEMENTES%20E%20MUDAS%20DE%20ESP%C3%89CIES%20FLORESTAIS%20NATIVAS%20DO%20BIOMA%20MATA%20ATL%C3%82NTICA/AULA_14_COMO_PRODUZIR_MUDAS_DE_ESPECIES_FLORESTAIS.pdf > Acesso em 7 set. 2021.
RODRIGUES, R.G.; MILHOMENS, L.B.S.; MOURA JUNIOR, E.G.; PADIAL, A.A.; Histórico das Publicações sobre Plasticidade Fenotípica em Macrófitas Aquáticas - Tema/Meio de apresentação: Ecologia de comunidades/Pôster – XIII Congresso de Ecologia/ III International Simposium of Ecology and Evolution – Múltiplas Ecologias: Evolução e Diversidade – 08 a 12 de outubro de 2017.UFV-Viçoça(MG). Disponível em: < http://seb-ecologia.org.br/revistas/indexar/anais/2017/anais/resumos/resAnexo1-0063-0705-e5b6941d7bab290db3f8c1fdc6e31159.pdf >. Acesso em 25 jul. 2021.
RODRIGUES, M. R. L.; TEIXEIRA, W. G.; BARROS, M. E. O.; MACEDO, R. S.; MARTINS, G. C.; FERRAZ, R. P. D.; SILVA, E. F. Uso do solo e adubação de espécies florestais nas condições pedoclimáticas da Base Petrolífera de Urucu, Coari, AM – Manaus: Embrapa Amazônia Ocidental, Documentos / Embrapa Amazônia Ocidental, ISSN 1517-3135; 136), 2017, 21/47p. Disponível em: < https://ainfo.cnptia.embrapa.br/digital/bitstream/item/174245/1/292017-Final.pdf >. Acesso em 03 ago. 2021.
SAMPAIO, E.V.S.B. e OLIVEIRA, N.M.B. Aproveitamento da Macrófita Aquática Egeria Densa como adubo orgânico (Artigo) Planta Daninha, Viçosa-MG, v. 23, n. 2, p. 169-174, 2005. Disponível em: < https://www.scielo.br/j/pd/a/tT4dZnRN5dxKJZHVsngQMCh/?lang=pt&format=pdf >. Acesso em 04 ago. 2021.
SANTOS, A.M. Produtividade Primária de Macrófitas Aquáticas. Publicação da Sociedade Brasileira de Limnologia- 35p. 2004. ISSN 1806-7115 - Disponível em: < https://livrozilla.com/doc/1358687/produtividade-prim%C3%A1ria-de-macr%C3%B3fitas-aqu%C3%A1ticas >. Acesso em 22 jul. 2021.
SANTOS, S. S.; SECCO, A.R.C. Comparação de Custos de Recuperação de uma Área Degradada com Utilização de Resíduos Agroindustriais em Substituição ao Fertilizando Mineral. 2º Congresso Sul-Americano de Resíduos Sólidos e Sustentabilidade (20 a 30/05/2019). Foz do Iguaçu (PR). 2019, 8p. Disponível em: < http://www.ibeas.org.br/conresol/conresol2019/V-044.pdf >. Acesso em 21 set. 2021.
SANTOS, C. P.; SOUZA, C.F. Efeitos da cascata de reservatórios sobre a variabilidade natural de vazões: o caso do rio Paraná em Porto Primavera – (Artigo) Revista Brasileira de Recursos Hídricos Versão On-line: ISSN 2318-0331RBRH vol. 20 nº3 Porto Alegre jul./set. 2015 p. 698 - 707. Disponível em: < https://abrh.s3.sa-east-1.amazonaws.com/Sumarios/182/a377b32ff9a0eebc0de418fe99e4215b_d32bda48da042830078fc8a6eaa98c6c.pdf >. Acesso em 24 ago. 2021.
SANTOS, P.F.; WHITFORD, W.G.; Os efeitos dos microartrópodes na decomposição da serapilheira em um ecossistema do deserto de Chihuahuan. (Article) Ecology, The Ecological Society of America, New York, v. 62, n. 3, p. 654-663, junho 1981. Disponível em: <https://esajournalsonlinelibrary.wiley.com/doi/abs/10.2307/1937733 >. Acesso em 15 ago. 2021.
SCREMIN-DIAS, E.; KALIFE, C.; MENEGUCCI, Z. dos R.H.; SOUZA, P.R.de Produção de mudas de espécies florestais nativas : Manual (Rede de sementes do Pantanal; 2). ISBN 85-7613-087-4 - Campo Grande, MS: Ed. UFMS, 2006, 22/62p. Disponível em:< https://www1.ufrb.edu.br/biblioteca/documentos/category/18-sementes-e-viveiros-florestais?download=222:manual-producao-de-mudas-de-especies-florestais-nativas. >. Acesso em 21 set. 2021.
SEQUINATTO, L.; LEVIEN, R.; TREIN, C. R.; MAZURANA, M.; MULLER, J. (Artigo) Qualidade de um Argissolo submetido a práticas de manejo recuperadoras de sua estrutura física. Revista Brasileira de Engenharia Agrícola e Ambiental, Campina Grande, ISSN 1807-1929. V. 18, n. 3, mar. 2014, 7p. Disponível em:< https://www.scielo.br/j/rbeaa/a/ynPPN8Nh3CzJqcnKqCYvqcr/?format=pdf&lang=pt > Acesso em 14 jul. 2021.
SOUSA, N. C.; LISBOA, B.; VARGAS, L. K.; BORDIGNON, S.; BENEDUZI, A. Composto orgânico à base de salvínia para a produção de mudas de grandiúva. (Artigo) Nota Científica. Pesquisa Florestal Brasileira (Revista eletrônica) [S. l.], v. 41, 2021, 4/7p. Colombo, DOI: 10.4336/2021.pfb.41e201801746. Disponível em: < https://pfb.cnpf.embrapa.br/pfb/index.php/pfb/article/view/1746 >. Acesso em 29 jul. 2021.
TAVARES, K.S. A Comunidade de Macrófitas Aquáticas em Reservatórios do Médio e Baixo Rio Tietê (SP) e em Lagos da Bacia do Médio Rio Doce (MG). (Dissertação de Mestrado em Ecologia e Recursos Naturais). Universidade Federal e São Carlos: Centro de Ciências Biológicas e da Saúde. São Carlos, 2003, 107/138p. Disponível em:< https://repositorio.ufscar.br/bitstream/handle/ufscar/2060/DissKST.pdf?sequence=1 > Acesso em 7 set.2021.
TUCCI, C.E.M.; MENDES, C.A. Avaliação Ambiental Integrada de Bacia Hidrográfica. Ministério do Meio Ambiente / SQA. ISBN 85-7738-047-5 Brasília: MMA, 2006, 302p. Disponível em: < http://projects.mcrit.com/ceara/attachments/article/189/Avali%C3%A7ao%20ambiental%20de%20bacias%20hidrogr%C3%A1ficas.pdf >. Acesso em: 22 ago. 2021.
THOMAZ, S. M.; BINI, L.M. Macrófitas aquáticas em Itaipu: Ecologia e perspectivas para o manejo - Ecologia e Manejo de Macrófitas Aquáticas - editores. -- Editora da Universidade Estadual de Maringá - ISBN 978-85-7628-191-7 (versão on-line)- EDUEM, 2003, 341p. Disponível em: < https://www.researchgate.net/publication/309384537_Macrofitas_aquaticas_em_Itaipu_Ecologia_e_perspectivas_para_o_manejo >. Acesso em 31 jul. 2021.
TUNDISI, J.G.; TUNDISI, T.M.; ABE; T.M.; ROCHA, O.; STARLING, F.L.do R.M.. Limnologia de águas interiores. Impactos, conservação e recuperação de ecossistemas aquáticos. Águas Doces no Brasil: capital ecológico, uso e conservação. São Paulo: Escrituras Editora, 1999, 195/223p. Disponível em: < https://www.researchgate.net/publication/261134193_Linologia_de_Aguas_Interiores_Impactos_Conservacao_e_Recuperacao_de_Ecossistemas_Aquaticos/link/5547afce0cf2b0cf7ace9188/download >. Acesso em 24 ago. 2021.
TUNDISI, J.G. Recursos hídricos no futuro: problemas e soluções. (Artigo) Estudos avançados. 22 (63), 2008, 10p. Disponível em: < https://www.scielo.br/j/ea/a/7gyMPtTzfkYfWWsMHqVLTqm/?format=pdf&lang=pt >. Acesso em 12 set. 2021.
TUCCI, C.E.M.; MENDES, C.A. Avaliação ambiental integrada de bacia hidrográfica / Ministério do Meio Ambiente / SQA. – ISBN 85-7738-047-5. Brasília: MMA, 2006.302p. Disponível em: < http://projects.mcrit.com/ceara/attachments/article/189/Avali%C3%A7ao%20ambiental%20de%20bacias%20hidrogr%C3%A1ficas.pdf >. Acesso em 14 ago. 2021.
UNIVERSIDADE FEDERAL DO PARANA (UFPR). Sistema de Bibliotecas. Portal da Informação. Curitiba, 2019. Disponível em: < http://www.portal.ufpr.br >. Acesso em 22 ago. 2021.
VIEIRA, R.F. Ciclo do Nitrogênio em Sistemas Agrícolas. (eBooK) Brasília, DF: Embrapa 2017, 128/163p - Disponível em < https://ainfocnptia.embrapa.br/digital/bitstream/item/175460/1/2017LV04.pdf > Acesso em 29 ago. 2021.
VILELA, A. D. Macrófitas do sistema de tratamento de efluentes sanitários do Complexo Portuário de Tubarão e seu potencial como fonte de nutrientes. (Dissertação de Mestrado): Instituto Tecnológico Vale. Belém (PA), 96p. 2016. Disponível em:< https://www.itv.org/wp-content/uploads/2018/02/Disserta%C3%A7%C3%A3o-Adriano-Vilela.pdf >. Acesso em 15 jul. 2021.
WALTER, S.L. Tratamentos Pré-Germinativos e Crescimento Inicial de Libidibia Ferrea (Mart. ex Tul.) L. P. Queiroz – Monografia: UFRP, 44p. 2017. Disponível em: < http://www.engenhariaflorestal.ufrpe.br/sites/ww4.deinfo.ufrpe.br/files/TCC_2017_LET%C3%8DCIA%20SIQUEIRA%20WALTER_Tratamentos%20pr%C3%A9-bgerminativos%20e%20crescimento%20inicial%20de%20Libidibia%20ferrea.pdf >. Acesso em 04 ago. 2021.
YAMAUCHI, A.K.F. Efeito da Incorporação de Macrófitas Aquáticas sobre Características Químicas de Solo Degradado. (Dissertação: Mestre em AGRONOMIA – Produção Vegetal. 2014. 45p. Disponível em: < https://repositorio.unesp.br/bitstream/handle/11449/110326/000795018.pdf?sequence=1&isAllowed=y >. Acesso em 16 jun. 2021.
ZAKIA, M.J.B. Identificação e caracterização da zona ripária em uma microbacia experimental: implicações no manejo de bacias hidrográficas e na recomposição de florestas. Tese de doutorado apresentada na Escola de Engenharia de São Carlos- Universidade de São Paulo. São Carlos, 1998, 113p. Disponível em: < https://www.yumpu.com/pt/document/read/14335854/identificacao-e-caracterizacao-da-zona-riparia-em-uma-ipef >. Acesso em 16 ago. 2021.
[1] O coordenador do MapBiomas Água, Carlos Souza Jr., comenta que o resultado é bastante preocupante porque o sinal de tendência de redução de água no Brasil, com os dados de satélites, é bem claro. “As evidências vindas do campo já indicam que as pessoas já começaram a sentir o impacto negativo com o aumento de queimadas, impacto na produção de alimentos, e na produção de energia, e até mesmo com o racionamento de água em grandes centros urbanos”. Disponível em:< https://mapbiomas.org/superficie-de-agua-no-brasil-reduz-15-desde-o-inicio-dos-anos-90 >. Acesso em 15 set. 2021.
[2] Fósforo: provém de apatita, mineral acessório presente na maioria das rochas magmáticas, mas que pode ter origem nos fosfatados, fertilizantes ou resíduos orgânicos.
[3] O aumento da biomassa vegetal em função da alta concentração de nutrientes, principalmente fósforo e nitrogênio, provoca o aumento de decompositores aeróbios da matéria orgânica que se acumula nos açudes, aumentando a DBO.
[4] Produtividade primária - Síntese de matéria orgânica (biomassa) através da fotossíntese ou da quimiossíntese no primeiro nível trófico de uma dada comunidade. Atualmente, sabe-se que a comunidade de macrófitas aquáticas é a mais produtiva da biosfera (MOSS, 1993, cit. por SANTOS, 2003).
[5]‘Os aspectos ambientais negativos envolvem a eutrofização, acidificação e aquecimento global com fortes implicações na sustentabilidade dos agroecossistemas e na saúde humana’ (VIEIRA, 2017).
[6] A cobertura vegetal da bacia exerce importante influência sobre a parcela da água de chuva que se transforma em escoamento superficial e sobre a velocidade com que esse escoamento atinge a rede de drenagem. Quanto maior a área da bacia com cobertura vegetal, maior será a parcela de água de interceptação. Além disso, o sistema de raízes da vegetação retira a água do solo e a devolve à atmosfera, através do processo de transpiração (ASSIS & DIAS, 2019).
[7] O objetivo dessa recuperação é chegar a um sistema ecológico semelhante esteticamente e com as mesmas funções ecológicas que existiam antes da degradação.
[8] A recuperação de um sistema degradado tem como base restabelecer ao substrato condições para que possa cumprir os serviços desempenhados pelo solo em qualquer sistema natural em equilíbrio.
[9] Áreas de solo degradado são caracterizadas por baixa disponibilidade de nutrientes, baixo teor de matéria orgânica e características físicas que dificultam o estabelecimento e crescimento de plantas
[10] Além de sua fundamental contribuição para a qualidade do solo, a matéria orgânica é também componente chave na regulação do ciclo biogeoquímico do carbono e na manutenção da qualidade atmosférica.
[11] Oxigênio Dissolvido (OD) é um fator limitante para manutenção da vida aquática e de processos de autodepuração em sistemas aquáticos naturais e estações de tratamento de esgotos. Durante a degradação da matéria orgânica, as bactérias fazem uso do oxigênio nos seus processos respiratórios, podendo vir a causar uma redução de sua concentração no meio (CETESB, 2021).
[12] No Brasil, a Resolução 357 de 2005 do Conselho Nacional do Meio Ambiente (CONAMA), estabelece os seguintes limites máximos de P total em água doce de classe 1: 0,1 mg L-1 em ambiente lótico (água de rios), 0,025 mg L-1 para ambiente intermediário e 0,020 mg L-1 para ambiente lêntico (água de reservatórios ou lagos) (BRASIL, 2005) .
[13] A Resolução CONAMA 357/2005, estabelece o limite máximo de 10 mg L-1 de N-NO3- . para o nitrogênio na forma amoniacal (N-NH4+), associado a problemas da vida aquática, os limites estabelecidos para água doce de classe 1, são: 3,7 mg L-1 em pH ≤ 7,5; 2,0 mg L-1 em pH entre 7,5 e 8,0; 1,0 mg L-1 em pH entre 8,0 e 8,5; 0,5 mg L-1 em pH > 8,5. O valor mínimo de oxigênio dissolvido (OD) para a preservação da vida aquática é de 5,0 mg/L, com variação na tolerância de espécie para espécie (BRASIL, 2005)..
[14] Com o desenvolvimento das cidades e a falta de saneamento básico quanto ao tratamento dos seus efluentes, as macrófitas existentes nesses ambientes têm crescido a uma taxa de até 0,5% ao dia. É o que ocorre na lagoa de Guarapiranga-SP. Essa taxa é determinada pela quantidade de nutrientes presentes nesses efluentes despejados sem nenhum tipo de tratamento (ESTEVES, 1998).
[15] Outro fator relevante é o fato das raízes servirem de habitat para larvas de insetos e as folhas de abrigo aos insetos adultos. As espécies mais recorrentes são do gênero Mansonia e Culex sp., vetores de doenças e de transtornos sociais (NATAL et al.,1991).
[16] A recuperação da vegetação na APP será de efetiva importância, na medida em que ocupará essa área marginal ao reservatório determinada legalmente para esse fim, evitando problemas futuros com relações aos crimes ambientais, visto que é proibido a ocupação da APP.
[17] A recomposição da cobertura vegetal nestas áreas deverá atenuar os efeitos erosivos e a lixiviação dos solos, contribuindo para regularização do fluxo hídrico, redução do assoreamento do reservatório, prolongar a vida útil de operação da usina, além de conectar com fragmentos florestais criando corredores de interação entre fauna e flora (OLIVEIRA, 2012).
[18] Em 2015, a ONU propôs aos seus países membros uma nova agenda de desenvolvimento sustentável para os próximos 15 anos, a Agenda 2030, composta pelos 17 Objetivos de Desenvolvimento Sustentável (ODS). Os ODS buscam assegurar os direitos humanos, acabar com a pobreza, lutar contra a desigualdade e a injustiça, alcançar a igualdade de gênero e o empoderamento de mulheres e meninas, agir contra as mudanças climáticas, bem como enfrentar outros dos maiores desafios de nossos tempos. O setor privado tem um papel essencial nesse processo como grande detentor do poder econômico, propulsor de inovações e tecnologias influenciador e engajador dos mais diversos públicos – governos, fornecedores, colaboradores e consumidores. Disponível em < https://www.pactoglobal.org.br/ods > Acesso em 22 jun. 2021.
[19] Do ponto de vista taxonômico, são reconhecidas 42 famílias de dicotiledôneas, 30 de monocotiledôneas, 17 de briófitas e 6 de pteridófitas com representantes de plantas aquáticas (ESTEVES, 1998).
[20] Apesar de existirem outras terminologias como, hidrófitas, helófitas, euhidrófitas e limnófitos, para descrever o conjunto de vegetais adaptados ao ambiente aquático, no Brasil o termo macrófitas aquática é de uso mais frequente (VILELA, 2016).
[21] Esta classificação reflete, em primeiro lugar, o grau de adaptação das macrófitas ao meio aquático.
[22] Produção primária é o processo pelo qual as plantas convertem energia solar em energia química. A mensuração do processo é dada pela quantidade de matéria orgânica, expressa em peso seco ou peso livre de cinzas (FERREIRA, 2005).
[23] LEI nº 6.938, de 31 agosto de 1981.
[24] Eichhornia crassipes , por exemplo, tem sido aproveitada para diversos fins, como alimentação de animais, construção de armadilhas de peixes, adubos, medicinal, produção de papel, controle da poluição, produção de Biogás, valor ornamental e ecológico, hábitat para diversos organismos aquáticos, usada para confecção de esteiras, cordas, cadeiras, cortinas e outras obras trançadas. O uso de fibras de origem vegetal para a confecção de artesanatos no Brasil está associado a culturas indígenas que desenvolveram técnicas de secar, trançar e costurar, com vários estilos diferentes (BORTOLOTTO e NETO, 2005).
[25]O aumento da matéria orgânica em solos degradados também é responsável pela melhora de atributos físicos do solo, pois cria condições favoráveis à atividade biológica e estruturação de suas partículas de maneira a restabelecer a micro e macroporosidade e retenção de água no substrato (YAMAUCHI, 2014).
[26] A Pequena Central Hidrelétrica Santa Rosa II está localizada entre as cidades de Bom Jardim (RJ) e Cordeiro (RJ).
[27] Produzido a partir da biomassa aérea (parte da planta que fica para fora da terra) de espécies leguminosas, o N-verde é um fertilizante orgânico vegetal rico em nitrogênio (N) e de fácil aplicação. “Ele tem os nutrientes essenciais para as plantas: fósforo, potássio, cálcio, magnésio, enxofre; e micronutrientes, como boro, ferro, manganês, molibdênio e zinco”, explica o pesquisador Ednaldo Araújo, da Embrapa Agrobiologia (RJ). Disponível em: https://www.embrapa.br/busca-de-noticias/-/noticia/37485979/pesquisa-desenvolve-fertilizante-organico-a-partir-da-biomassa-de-plantas > Acesso em 13 set. 2021.
[28] Como exemplo desses metais, o cádmio pode representar riscos à saúde da planta, uma vez que está associado à geração de distúrbios metabólicos graves (FAO, 2004 cit. por LIMA ABREU, 2019).
[29] Este método também é conhecido como método das leiras revolvidas (Windrow).
[30] A revisão da lista dos valores orientadores seguiu as diretrizes da Decisão de Diretoria nº 103/2007/C/E de 22 de junho de 2007 (CETESB, 2007). Disponível em: < https://cetesb.sp.gov.br/solo/valores-orientadores-para-solo-e-agua-subterranea/ >. Acesso em 13 set. 2021.
[31] O processo de compostagem também pode ser realizado sem que o material sofra fragmentação, no entanto, o processo de fragmentação provoca aumento da superfície de contato do material onde a comunidade microbiana poderá atuar.
[32] A compostagem é um processo aeróbico e a formação de zonas anóxicas provoca a produção do chorume, um produto da fermentação anaeróbica do material orgânico caracterizado por um odor desagradável.
[33] O substrato tem por objetivo fornecer condições para que a planta se estabeleça e se desenvolva bem em seus primeiros meses de vida e que forme torrão adequado para ser transplantada para o campo. Ele deve simular as condições do solo, sendo composto por materiais capazes de fornecer nutrientes para as plantas, mas permitir também a formação do torrão e ainda ter drenagem satisfatória para o desenvolvimento da espécie a ser produzida. Na formulação de substratos é sempre importante aproveitarmos o que existe disponível no entorno, visando reduzir custos. Uma mistura padrão de substrato: 2 partes de composto orgânico: 1 parte de subsolo argiloso (barro): 1 parte de areia lavada ( v:v ) misturado em betoneira ou com enxada (RESENDE, 2021).
Publicado por: VICTOR FRAGA
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.