Ecologia Alimentar Da Cavala Scomber colias Gmelin 1789 Desembarcada na Costa do Namibe
índice
- 1. RESUMO
- 2. INTRODUÇÃO
- 3. Hipóteses
- 4. Objectivos
- 5. Justificativa
- 6. REVISÃO DE LITERATURA
- 7. Biologia e Ecologia
- 7.1 Crescimento
- 7.2 Ecologia Alimentar de S. colias
- 7.2.1 Reprodução
- 7.3 Pesca
- 8. MATERIAIS E MÉTODOS
- 8.1 Caracterização da área de estudo
- 8.2 Análise de campo
- 8.2.1 Estratégia de Amostragem
- 8.3 Análise laboratorial
- 8.3.1 Regime alimentar
- 8.4 Análise e tratamento de dados
- 8.5 Comportamento alimentar
- 8.6 RESULTADOS
- 8.6.1 Descrição das amostras
- 8.6.2 Composição da dieta
- 8.6.3 Grau de enchimento
- 8.6.4 Dieta de S. colias capturado na costa do Namibe
- 8.6.5 Variações mensais da dieta
- 8.7 DISCUSSÃO
- 8.7.1 Regime alimentar
- 8.7.2 Dieta alimentar de S. colias
- 8.7.3 Coeficiente Alimentar
- 8.7.4 Variação mensal da dieta
- 9. CONCLUSÕES
- 10. SUGESTÕES
- 11. REFERÊNCIAS BIBLIOGRÁFICAS
- 12. APÊNDICES
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
O conhecimento da ecologia alimentar de uma determinada espécie é uma ferramenta indispensável para a compreensão das relações tróficas que se estabelecem no meio, informação útil para a gestão de espécies comerciais. A cavala (Scomber colias) pertence à família Scombridae e ao género Scomber sendo amplamente distribuída nas águas costeiras do oceano Atlântico. Em Angola não há quaisquer informações sobre a ecologia alimentar desta, razão pela qual este trabalho visou compreender a sua ecologia alimentar na costa do Namibe. Para tal foram analisadas conteúdos estomacais de 167 exemplares adquiridos entre Julho de 2019 a Fevereiro de 2020, na lota do Porto Pesqueiro do Namibe recorrendo a análise do conteúdo estomacal, uma metodologia amplamente utilizada em Biologia Pesqueira. Além da dieta, analisou-se o comportamento alimentar, variação mensal na composição da dieta, aplicando para o efeito índices alimentares, nomeadamente, frequência de ocorrência (%Fo), percentagem em número (%Pn), percentagem em em peso (%Pp), índice de vacuidade (C.V) e índice de importância relativa (IIR). A cavala apresentou uma estratégia alimentar generalista, sendo a dieta principalmente composta por copépodes (calanóides). Observaram-se igualmente ovos de peixe, decápodes, eufasiáceos, moluscos, misidáceos, hiperideas, poeicilostomatoides, anfípodes e cumaceas em alguns conteúdos estomacais, mas a sua contribuição para a dieta é consideravelmente reduzida, podendo mesmo tratar-se de predação acidental. O Calanoides cf. carinatus revelou-se a presa mais importante, tanto através de frequência de ocorrência como índice de importância relativa, seguido por Calanus agulhensis e Cathocalanus pauper. Verificou-se ainda que tanto os machos quanto as fêmeas apresentam mesma preferência alimentar. Em Setembro foi registado o maior número de estômagos cheios. Não foi observado grandes variações mensais na composição da dieta da cavala, com os copépodes (calanóides) a dominarem nos meses de Julho, Agosto, Setembro, Outubro (2019) e Fevereiro (2020). Em Novembro (2019), os eufasiáceos apareceram com maior percentagem, já em Dezembro (2019) e Janeiro (2020), dominaram os decápodes. Estes resultados estão em conformidade com algumas características típicas da espécie por ser costeira e reelam-se de grande importância para qualquer plano de gestão relacionada com a espécie.
Palavras-chaves: Scomber colias, conteúdo estomacal, dieta alimentar, costa do Namibe, regime alimentar.
ABSTRACT
The knowledge of the alimentary ecology of a certain species is an indispensable tools for the understanding of the trophic relationships that you/they settle down in the middle, useful information for the administration of species trades. The mackerel (Scomber colias) it belongs to the family Scombridae and to the género Scomber being distributed thoroughly in the coastal waters of Atlantic ocean. In Angola no there are any information about the alimentary ecology of this, reason for the which this work sought to understand his/her alimentary ecology in the coast of Namibe. For such stomach contents of 167 acquired copies were analyzed among July from 2019 to February of 2020, in the it fills up of Fishing Porto of Namibe going through the analysis of the stomach content, a methodology thoroughly used in Fishing Biology. Besides the diet, the alimentary behavior, monthly variation in the composition of the diet was analyzed, applying for the effect alimentary indexes, namely, occurrence frequency (%Fo), percentage in number (%Pn), percentage in in weight (%Pp), vacuity index (C.V) and index of relative importance (IIR). The mackerel presented a strategy alimentary generalista, being the diet mainly composed by copepods (calanoids). They were observed fish eggs equally, decapods, eufasiáceos, mollusks, misidáceos, hiperideas, poeicilostomatoids, anfípods and cumaceas in some stomach contents, but her contribution for the diet is considerably reduced, even could be treated of accidental predação. The Calanoides cf. carinatus was revealed the most important prey, so much through occurrence frequency as index of relative importance, following for Calanus agulhensis and Cathocalanus pauper. It was verified although as much the males as the females they present same alimentary preference. In September it was registado the largest number of full stomachs. It was not observed great monthly variations in the composition of the diet of the mackerel, with the copepods (calanoids) they dominate her in the months of July, August, September, October (2019) and February (2020). In November (2019), the eufasiáceos appeared with larger percentage, already in December (2019) and January (2020), they dominated the decapods. These results are in accordance with some typical characteristics of the species for being coastal and reelam-if of great importance for any glide of administration related with the species.
Keywords: Scomber colias, stomach contente, alimentary diet, coast of Namibe, alimentary regime.
2. INTRODUÇÃO
Cerca de 71% da superfície da terra é ocupado pelos oceanos e mares, onde mais da metade dos vertebrados que existem são representadas pelos peixes. O peixe, desde os primórdios das civilizações, figurou-se como alimento essencial e indispensável para a população, não só pelo facto de a pesca ser uma das primeiras actividades realizadas pelo homem enquanto ser provido de necessidades de alimentação, como também pelo facto de ser um alimento com um elevado valor protéico e nutricional, indispensável para o bem-estar do homem. Da grande diversidade de peixes existentes, destacam-se os pequenos pelágicos pelo valor nutricional a estes associado, volumes desembarcados e principalmente pela posição que ocupam nos níveis intermédios da teia trófica marinha, permitindo o fluxo de energia aos níveis superiores (Cury, 2000).
A cavala (Scomber colias Gmelin, 1789), faz parte da família Scombridae e gênero Scomber. O gênero Scomber além da S. colias, inclui ainda, as espécies, Scomber scombrus Linnaeus, 1758 (cavala Atlântica), Scomber japonicus Houttuyn, 1782 (cavala de gordo) e Scomber australasicus Cuvier, 1832 (cavala azul). Tradicionalmente, S. japonicus foi considerado espécies geograficamente difundidas no gênero que é encontrado no Oceano Atlântico, Índico e Pacífico, com a cavala descrita anteriormente sob a designação de S. japonicus, mas recentes estudos sobre a sua genética mitocondrial provaram a existência de duas espécies distintas: S. colias e S. japonicus, a primeira ocorrendo no oceano Atlântico e a segunda nos oceanos Pacífico e Índico (Infante et al., 2006).
Devido às semelhanças morfológicas entre a sarda (S. scombrus) e a cavala (S. colias) e à sua partilha de área geográfica, estas ao serem muitas vezes capturadas em conjunto, são confundidas e vendidas como se tratasse de uma mesma espécie (principalmente na costa portuguesa). No entanto, para além das diferenças genéticas, existem diferenças morfológicas que permitem distinguir as espécies. A nível interno, a principal diferença é a ausência de bexiga-natatória na sarda. A nível externo estas espécies podem distinguir-se pela distância entre o fim da primeira barbatana dorsal e o início da segunda barbatana dorsal a qual, na sarda, é maior do que o comprimento da primeira barbatana dorsal enquanto na cavala, é igual ou menor do que este. A cavala é ainda facilmente distinguível pela presença de uma zona translúcida na cabeça entre os olhos bem como de pequenas e numerosas manchas escuras abaixo das listas do dorso (Hernández & Ortega, 2000).
A cavala é uma espécie pelágica de pequena dimensão, constitui uma componente – chave na teia alimentar marinha de muitas áreas tropicais e subtropicais do oceano Atlântico. Nestas regiões, existem relatos de que a espécie é predada principalmente por algumas espécies de atum (Thunnus alalunga, atum rabilho T. Thynnus), focas (Zolaphus californianus), robalo branco (Cynoscion nobilis) e muitas espécies de tubarão (Schaefer, 1980).
Além do papel pivô nos níveis intermédios da teia alimentar marinha, sua significante biomassa, a cavala é um elemento fundamental na dieta alimentar de uma importante gama da população angolana, não só pelo seu valor nutritivo, mas também, pelo seu custo acessível a todas as classes sociais. Por outro lado, importa sublinhar, que juntamente com outros pequenos pelágicos contribui sobremaneira para o volume de pescado desembarcado nos portos nacionais, conferindo a este um razoável valor comercial e importância econômica para o país, e para a região de modo particular. Apesar destas valências associadas a espécie, pouco se sabe sobre aspectos relevantes da sua dinâmica populacional, particularmente da sua biologia e ecologia, o que compromete qualquer plano de gestão desta e de outras espécies de nível trófico superior.
Estudos sobre a ecologia alimentar de peixes são importantes para entender suas interacções tróficas, além de compreender a posição que cada espécie ocupa nas teias tróficas marinhas, contribuindo para a compreensão do fluxo de energia e do funcionamento dos ecossistemas marinhos (Bisi, José, & Malm, 2012). Além do facto de o comportamento de uma espécie e/ou indivíduo também ser influenciado pelo seu hábito alimentar (Braga, 2012). A ecologia alimentar de uma espécie está relacionada a sua dinâmica populacional e contribui para percepção de assuntos como partilha de recursos, preferência de habitats, selecção de presas, predação, evolução, efeitos de risco, competição, ecologia trófica e transferência de energia dentro e entre ecossistemas Braga (2012), além de permitir acessar a informações relevantes sobre a disponibilidade de presas no ambiente, o que na prática se pode reflectir no sucesso ou insucesso das capturas (Quiatuhanga, 2015).
Alterações na dieta são evidenciadas de acordo com a abundância ou escassez dos recursos alimentares nas diferentes estações do ano, devido às variações sazonais nos trópicos, peixes tropicais exibem uma intensa plasticidade trófica em suas dietas (Silva et al., 2007). Variações bióticas e abióticas podem levar a uma mudança nos itens que compõem a dieta dos peixes, sugerindo que a maioria pode utilizar uma ampla gama de alimentos, e quando um destes itens encontra-se em proporções diferentes do normal, em escassez ou em excesso, os peixes mudam seu comportamento alimentar (Silva et al., 2007).
Esta informação é de grande relevância para o desenvolvimento de estratégias de conservação e, portanto, um elemento chave para a protecção de espécies e ecossistemas (Braga, 2012). Logo, trabalhos sobre a alimentação de peixes são de grandes importâncias por trazerem à tona conhecimentos básicos e fundamentais sobre a biologia das espécies (Vitule & Aranha, 2002).
Consequentemente, pretende-se responder a seguinte situação problemática:
Qual é a ecologia alimentar de S. colias capturada ao longo da costa do Namibe face a alteração na disponibilidade de presas no meio?
3. Hipóteses
-
H1: A composição da dieta da cavala na costa do Namibe reflecte a disponibilidade de presas presentes no meio, com possibilidade de evidenciar um comportamento generalista e /ou.
-
H2: As variações mensais dos factores abióticos e bióticos provocam abundância ou escassez de alimentos numa base sazonal, conducentes a um comportamento alimentar oportunista.
4. Objectivos
Geral
Compreender a ecologia alimentar de S. colias capturada ao longo da costa do Namibe.
Específicos
-
Determinar a dieta de S. colias através da análise do conteúdo estomacal;
-
Analisar o comportamento alimentar de S. colias;
-
Caracterizar a composição da dieta de S. colias;
-
Analisar as variações mensais e sazonais da composição da dieta de S. colias;
-
Propor medidas de gestão para S. colias.
5. Justificativa
A morfologia, anatomia, habitat, distribuição e o comportamento de uma determinada espécie estão de alguma forma ligadas com a sua dieta alimentar (Hernandez, 1991). No entanto, o comportamento dos peixes em cardume confere várias vantagens para a sobrevivência, incluindo maior protecção contra predação, maior eficiência na detecção de presas em um ambiente heterogéneo e aumento da eficiência hidrodinâmica ao nadar (Pitcher & Parrish, 1993).
Os peixes pelágicos de pequena e média dimensão, mais especificamente a sardinha, a cavala e o carapau, são as três espécies com maiores volumes desembarcados em portos nacionais, o que realça a sua importância comercial a nível nacional (Abreu, 2011). Devido à relevância da pescaria de cavala a nível mundial, vários estudos têm sido feitos embora relacionados sobretudo com a sua biologia pesqueira (Abreu, 2011). No entanto, informações quantitativas sobre a sua ecologia alimentar são escassas. Dados sobre os hábitos alimentares desta espécie existem através de alguns trabalhos feitos na costa de Portugal, ilhas Canárias, costa Noroeste Atlântica de África, mar del Plata (Argentina), costa da África do Sul, (...). Em Angola, trabalhos sobre a cavala foram realizados por Panguila (2015), com objectivo de agregar valor à espécie através de estudos de controlo e qualidade que visaram compreender sobretudo o tempo de vida útil (prateleira) da espécie após a sua captura.
S. colias é uma espécie de grande relevância ecológica, comercial (pelo volume desembarcado) e social. Em Angola, existe pouca informação sobre a biologia e ecologia desta espécie, o que compromete e dificulta a implementação de planos de gestão. Apesar dos valores a espécie atribuídos, tem sido subaproveitada e desvalorizada nas comunidades pesqueiras. Além disso, por ser uma espécie consideravelmente costeira, não existem estatísticas de pesca credíveis sobre a espécie, bem como dados reais sobre a sua biomassa, o que a coloca em grande risco de sobre-exploração. Dado o exposto, a escolha deste tema é fundamentada por um lado pela necessidade de se conhecer a sua biologia conducente a uma efectiva gestão, e por outro, para a produção de uma base de dados com informações credíveis e científicas por forma a fazer face ao deserto bibliográfico de espécies marinhas, sobretudo das espécies com interesse comercial.
6. REVISÃO DE LITERATURA
6.1. Descrição da espécie
De acordo com a regra internacional de nomenclatura contida no site do Fishbase (https://www.fishbase.de), a cavala (Figura 1) é classificada, taxonomicamente, da seguinte forma:
Reino: Animalia
Filo: Chordata
Sub-filo: Vertebrata
Classe: Actinopterygii
Ordem: Perciformes
Família: Scombridae
Género: Scomber
Espécie: Scomber colias Gmelin, 1789

Figura 1- Ilustração científica da S. colias. Fonte: (Autor, 2019)
Morfologicamente, esta espécie possui um corpo fusiforme, alongado, focinho pontudo e curto, com 8 a 10 raios espinhosos e 112 raios na barbatana dorsal, 1 espinho e 12 a 14 raios na barbatana anal e 31 vêrtebras. A cabeça é pequena e a mandíbula ligeiramente proeminente. Os olhos são grandes, cobertos por pálpebras adiposas na região anterior e posterior. Boca ampla, terminal. Dentes presentes no vômer e palatino. Duas barbatanas dorsais bem separadas, em que a distância entre elas, é aproximadamente igual ao comprimento da base da primeira barbatana, uma barbatana anal, como também uma barbatana caudal. Anal curta, originando-se posteriormente à segunda dorsal. Pélvica sob a base da peitoral. Corpo com escamas pequenas. Região dorsal do corpo azulada, com linhas irregulares escuras, região ventral clara, com manchas ou linhas quebradas ondulantes (Alves, 2016).
Quando adulta, a cavala pode atingir 60 cm de comprimento e viver até 13 anos, sendo uma espécie heterossexual, sem evidência de dimorfismo sexual e apresentam fecundação externa (Kramer, 1969). A desova ocorre mais frequentemente em temperaturas da água de 15° a 20°C (Simãozinho, 2011). Cria em vários lotes com 250 a 300 ovos/g de peixe, com o número total de ovos por fêmea variando de 100.000 a 400.000 (Ferreira, 2019).
A cavala é um peixe euritérmico, ou seja, consegue tolerar grandes amplitudes térmicas, e ectotermal, o que significa que não possui mecanismos fisiológicos de termorregulação corporal. Esta espécie, de forma a evitar temperaturas demasiado baixas ou elevadas no seu habitat, desenvolveu duas adaptações principais: uma grande tolerância fisiológica a temperaturas altas e baixas, que podem variar entre 5ºC e 30ºC, e capacidades locomotoras e de sensibilidade termal que lhe permitem detetar e evitar locais com temperaturas desfavoráveis, termorregulando-se pelo comportamento (Schaefer, 1986).
6.2. Distribuição Geográfica
A cavala é uma espécie costeira pelágica, de dimensões médias, com vasta distribuição geográfica habitando as águas quentes e temperadas do Atlântico, Mar Mediterrâneo e Mar Negro (Alves, 2016) (Figura 2). É encontrda em cima do declive continental da superfície até 300 m de profundidade. No Atlântico oriental é frequente ao longo da costa africana, estando presente de Marrocos até África do Sul, inclusive as ilhas de Açores, Madeira, Canárias e Santa Helena e ainda no Grande monte de mar de Meteoro (30°N a 28°30'O ) (Hernández & Ortega, 2000). Para o Norte, é encontrada até o Golfo de Biscaia e, ocasionalmente no Sul nas Ilhas britânicas, Mar irlandês e na costa Belga (Quigley & Flannery, 1994). Também está presente no Mar Mediterrâneo e no Sul do Mar Negro. Na costa Atlântica da América são frequentes de Massachusetts para Flórida, Bahamas, Golfo de México e sul da Venezuela, Brasil, Uruguai e Argentina (Hernández & Ortega, 2000).
Os adultos desta espécie realizam migrações, passam a maior parte da sua vida nadando em cardumes organizados o que lhes confere várias vantagens para a sobrevivência, abrangindo maior protecção contra predação, detecção de presas em um ambiente heterogéneo e maior eficiência na dinâmica ao nadar (Pitcher & Parrish, 1993).
Figura 2- Mapa de distribuição geográfica da cavala (S.colias). Fonte: (mapa retirado de https://www.fishbase.se/summary/Scomber-colias.html)
7. Biologia e Ecologia
7.1. Crescimento
A taxa de crescimento desta espécie depende principalmente da intensidade de alimentação e da temperatura do meio, apresentando flutuações no tempo e entre diferentes locais. O crescimento varia ao longo do ano, sendo mais rápido nos meses quentes e lento nos meses frios (Carvalho, Perrota, & Isidro, 2002). Relativamente ao ciclo de vida, é comum a todas as populações a taxa de crescimento ser máxima no primeiro ano de vida, baixando depois rapidamente quando atinge a idade de primeira maturação, e a maior parte da energia corporal passa a ser utilizada para a reprodução (Lorenzo, Pajuelo, & Ramos, 1995). No arquipélago dos Açores estimou-se que no primeiro e segundo ano de vida os indivíduos atingiam aproximadamente 33% e 48% do tamanho máximo respectivamente Carvalho et al., (2002) e no arquipélago da Madeira 40% no primeiro ano (Vasconcelos, Dias, & Faria, 2011). No Golfo de Cádis, o crescimento no primeiro ano foi estimado em cerca de 50% do valor máximo, nas Ilhas Canárias 40% Lorenzo et al. (1995) e no Mar de Alborán cerca de 59% (Velasco, Arbol, Baro, & Sobrino., 2011).
7.2. Ecologia Alimentar de S. colias
Dados sobre os hábitos alimentares desta espécie existem através de alguns trabalhos. Abreu (2011), seus estudos realizado na Costa de Portugal, demonstraram que nos juvenis, a dieta era composta principalmente por zooplâncton, com a ictiofauna a ter uma menor relevância na dieta. Logo, a importância do zooplâncton na dieta diminui com o aumento do tamanho dos peixes desta espécie passando a ingerir presas de maiores dimensões. S. colias, apresenta um padrão ontogénico semelhante à dos peixes adultos, alimentando-se de pequenos peixes, lulas e pequenos crustáceos. Vários autores (e.g. Angelescu, 1979; Castro & Santana del Pino, 1995; Hernandez & Ortega, 2000) verificaram que a dieta de cavala era muito flexível, tanto em número de taxa (com mais de 20 taxa descritos) como em gama de tamanhos das presas (desde 1 mm até 140 mm). Para estes autores, a cavala é uma espécie oportunista, com pendor para a eurifagia ou seja, escolhe o alimento mais abundante em determinada altura (Abreu, 2011). Por outras palavras, é uma espécie planctófaga carcinófaga ou piscívora. Abreu (2011) Considerou a cavala quando em adulta uma espécie omnívora com hábitos carnívoros. Nas ilhas Canárias, Castro (1993) observou que a dieta de S. colias consistiu em 17 grupos taxonômicos. Para todas as fases combinadas, pequenos zooplâncton (principalmente os copepodes), foram os grupos mais importante de acordo a percentagem em número, seguido por apendicularias e misidáceos. Porém, através da percentagem em massa, misidáceos, seguidos por copépodes e pequenos peixes, constituíram o tamanho da dieta. Eufasiáceos foram os menos importantes na dieta. As espécies de peixe principais predadas por juvenis eram Sardina pilchardus e Atherina presbyter, considerando que Macroramphosus scolopax juvenil eram comuns na dieta de adulto de S. colias (Castro, 1993). Foram registrados apenas três casos de canibalismo durante o estudo. Castro (1993) ainda constatou que, nos meses frios, entre dezembro e maio, o principal conteúdo estomacal em todas as classes de comprimento, foram peixes. Portanto, num estudo conduzido por Fátima et al. (2015) na costa Noroeste Atlântica de África, para a mesma época predominaram os copépodes e pequenos crustáceos, enquanto nos meses quentes predominaram os peixes e copépodes. Esta diferença sazonal e espacial na composição da dieta da cavala resulta principalmente da disponibilidade de cada grupo de organismos no meio, bem como dos factores abióticos que consequentemente influenciam na sua abundância sazonal (Fátima et al., 2015).
Na costa de Las Palmas Gran Canárias, Hernández (1991) constatou que a dieta de S. colias é composta principalmente por crustáceos, sobre tudo copépodes e misidáceos, ainda puderam observar apendiculárias nos estômagos de juvenis. No mar del Plata (Argentina), Angelescu (1980) verificou que de acordo com a especificidade e tamanho de alimento principal, S. colias é um pequeno carnívoro do tipo misto (planctófago-carcinófago), em alguns casos obtem alimento (copépodes) por mecanismo de filtração por parte branquial, e predador-ictiófago, com maior impacto em juvenís e adultos de anchova que são perceguidos e apanhados pela boca como presa (alimentação articulada). Da mesma forma, a cavala busca e ingere crustáceos de maior tamanho, entre 5 e 25 mm de comprimento total, como as espécies de eufaúsias (Euphausia similis), anfípodes pelágicos (Parathemisto) e sergéstidos (Peisos petrunkevitchi). Na costa da África do Sul, Hendricks (2018) observou que juvenis de S. colias alimentam-se principalmente por copépodes (calanóides) e misidáceos, sendo que os adultos, alimentam-se também de copépodes (calanóides) e misidáceos, mas ingerem a maioria do carbono dietético a partir de larvas de lulas e pequenos peixes.
7.2.1. Reprodução
A cavala é uma espécie ovíparo, dióico, que se reproduz (desova) várias vezes ao longo da sua vida, ao longo de cada época de desova emite vários grupos de óvulos. O desenvolvimento do ovário é assíncrono, o que significa que nos ovários das fêmeas maturas activas existem oócitos em todas as fases de maturação que são recrutados várias vezes durante a época de reprodução (Lubzens, Young, Bobe, & Cerdà, 2009). A idade de primeira maturação é a idade em que o indivíduo atinge a maturação sexual e se reproduz pela primeira vez na vida, passando de virgem ou imaturo a adulto ou maturo. A idade de primeira maturação e época de reprodução estão relacionadas com factores ecológicos, incluindo a pressão humana por pesca, pelo que variam entre locais e anos (Carvalho et al., 2002). A desova ocorre em temperaturas de 15 a 20ºC, principalmente nos meses de inverno e primavera. No Mar Egeu, a época de desova tem lugar no período de abril a agosto (Čikeš Keč & Zorica, 2012), nas Ilhas Canárias ocorre mais tarde no outono e inverno Lorenzo et al. (1995) e no arquipélago dos Açores durante março a agosto (primavera a verão) (Carvalho et al., 2002). Em Angola, até à data, não existem informações sobre o período de desova da espécie, presumindo-se que seja igualmente na época quente, tendo em conta a sua preferência em reproduzir-se em meses com temperaturas relativamente alta.
7.3. Pesca
À semelhança de outros pequenos pelágicos de elevado valor nutricional, a cavala é muito apreciada na dieta alimentar de populações costeiras, sendo também uma espécie de grande importância comercial no mundo inteiro, uma das espécies-alvo da pesca de cerco (Collette, 1986). Do ponto de vista econômico, S. colias tem uma grande importância em pescas mundiais. Em 1978, foi a terceira espécie mais capturada a nível mundial com cerca de 3.4 milhões de toneladas, superada apenas pelo Theragra chalcogramma (3.9 milhões de t) e Mollotus villosus (3.5 milhões de t). Em 1979 e 1980, foi considerada a quarta e quinta mais capturada, com 2.8 e 2.6 milhões de t respectivamente (FAO, 1997). A captura em 1989 era 1.6 milhões de t, 0.9 milhões de t em 1992 e 1.5 milhão t em 1995 (FAO, 1997). De acordo com Dália-Fernández (1985), em 1981 a cavala representou 3.09% da captura total de pesca marítima. Apesar das variações anuais, a média de captura mundial da cavala foi aproximadamente 1.87 milhões de t em 1967 (FAO, 1997). Entre 1978 e 1983, havia um declínio nas capturas que recuperou subsequentemente entre 1984 e 1986, enquanto diminuindo novamente para um registro baixo de 962.978 t em 1992. Entre 1993 e 1995 capturas estavam perto de 1.5 milhões de t (FAO, 1997).
Em Angola e particularmente no Namibe, contribui sobremaneira para o PIB. Segundo a Direcção Provincial das Pescas da Província do Namibe, a cavala é a terceira espécie mais capturadas nos últimos anos ao longo da costa do Namibe, superado apenas pela sardinha e pelo carapau. Dados ilustram que em 2015 cerca de 67.216 kg foram desembarcadas na costa do Namibe e a cavala representa com cerca de 7.692,9 kg, que é segunda espécie mais capturada neste ano, superado apenas pela sardinha (com 46.794,5 kg). A captura total no ano de 2016 foi de 98.221,3 kg em que 4.842,3 kg representada pela cavala. No ano de 2017 a captura total foi de 110.002,6 kg e a cavala representa com 6.006,7 kg. Em 2018 a captura anual foi de 67.336,6 kg das quais 7.635,9 é representada pela cavala. Já no primeiro semestre de 2019, isto é, até ao mês de Julho a captura rondou nos 30.694,5 kg das quais a cavala representa com cerca de 4.183,7 kg (Figura 3).
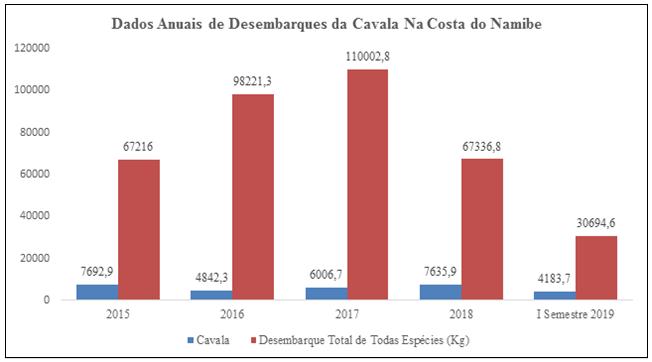
Figura 3- Desembarques de S. colias (em quilograma) na costa do Namibe no período de 2015 a 2019. Fonte: (adaptado da Direcção Provincial das Pescas do Namibe, 2019)
8. MATERIAIS E MÉTODOS
8.1. Caracterização da área de estudo
A Província do Namibe está situada na região Sul de Angola entre os paralelos 13o30’ a 17o15’ de Latitude Sul, apresenta uma área total de 57.091 km2 , com uma extensão costeira de 420 km. Administrativamente é constituída por cinco municípios (Moçâmedes, Tômbwa, Bibala, Virei e Camucuio), dois dos quais, Moçâmedes a Norte e Tômbwa a Sul, rica em recursos pesqueiros, sendo considerada o maior centro piscatório do país (Figura 4). É limitada a Norte pela província de Benguela, a Leste pela província da Huíla, a Oeste pelo oceano Atlântico, a Sul pelo rio Cunene e pela República da Namíbia.
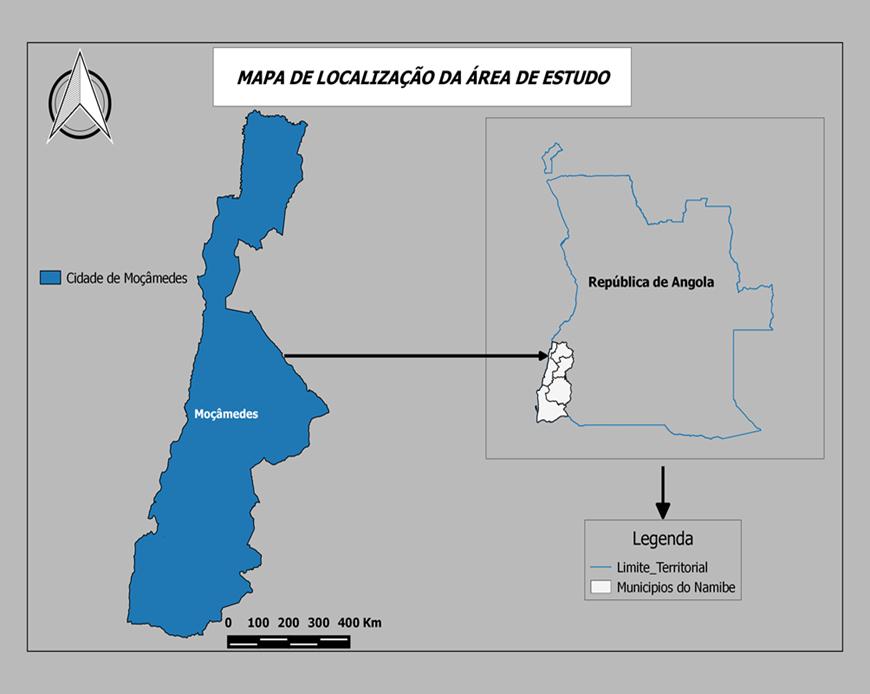
Figura 4- Situação da área de estudo no mapa.
Caracterizada por um clima seco, do tipo desértico, com uma temperatura média anual de 17℃ a 25℃ , ou seja, clima árido ao longo de uma larga faixa ocidental e semi-árido na parte restante, influenciado pelo deserto do Kalahari e corrente Fria de Benguela, conferindo-lhe um clima desértico quente e húmido. Observa-se que na zona costeira a temperatura aumenta de Sul para Norte entre os 16℃ à 27℃ e no interior a temperatura média do ar chega a atingir os 23,7°C (Bibala). De maneira sintética o clima é desértico em toda extensão do deserto do Namibe, Semi-árido nas zonas de menor altitude (Caraculo) e temperado húmido ao longo do litoral com variações entre 15℃ e os 32℃ (Saquenha, 2015).
A circulação das águas na região do Namibe é complexa já que sofre influência da Corrente Quente de Angola (CQA) que decorre do Equador à Sul ao longo da costa de Angola e a Corrente Fria de Benguela (CFB) que recobre a costa Sul até os 15° de Latitude Sul aproximadamente e desvia-se ao alto mar. O afloramento costeiro observado durante o ano por causa da interacção entre as duas correntes devido a existência de uma zona termal frontal a Frente Térmica Angola-Benguela pode ser a causa da enorme e rica biodiversidade marinha (Tchipalanga & Fidel, 2010). Quanto a humidade relativa, a zona de estudo (Namibe) distingue-se por variações que diminui do litoral para o interior, com os valores máximos podendo atingir acima dos 95% e os mínimos não inferior a 65% (Silva, 2016).
Na Província do Namibe, os desembarques são efetuados ao longo da linha da costa, denominadas aqui como portos de desembarques (localmente chamados de áreas de pesca) (Tabela 1).
Tabela 1- Zonas pesqueiras da província do Namibe
|
Área de pesca |
Portos de desembarques |
|
Norte |
Lucira |
|
Centro |
Porto Pesqueiro Praia-Amélia Saco-Mar |
|
Sul |
Tômbwa |
8.2. Análise de campo
No presente trabalho foram utilizadas amostras proveniente da lota do município de Moçâmedes (Porto Pesqueiro). Pretendeu-se determinar e caracterizar a dieta de S. colias e o seu comportamento alimentar.
8.2.1. Estratégia de Amostragem
Um total de 167 exemplares de S. colias foram amostrados mensalmente durante o período entre Julho de 2019 e Fevereiro de 2020, provenientes maioritariamente da pesca comercial (mercado de peixe), sendo que uma pequena quantidade foi obtido da peixaria Sicopal. Geralmente a pesca dirigida à cavala realiza-se entre as 20h e as 01h da manhã (comunicação pessoal com mestres de embarcação semi-industrial). No presente trabalho não foi possível obter a hora precisa de captura pelo facto de tanto as comerciantes como a empresa Sicopal não terem tido a informação disponível. Após a aquisição dos exemplares, estes foram submetidos em caixas exotérmicas contendo gelo de forma a retardar a acção enzimática e transportadas para o laboratório do Centro de Investigação Pesqueira do Namibe (CIPM) para posteriores análises.
8.3. Análise laboratorial
No laboratório, aos exemplares foram atribuídos uma identidade por meio de uma etiqueta numérica para evitar riscos de esvasamento de informação. Seguidamente, procedeu-se ao registro de dados biométrico (comprimento e peso), utilizando para o efeito um ictiómetro com precisão ao centímetro (cm) (Figura 5) e uma balança com precisão a grama (g) respectivamente (Figura 6B). Seguidamente, foi feita uma incisão na região médio ventral de cada exemplar para a determinação do sexo por meio da análise macroscópica da gónada. Posteriormente, o estômago foi removido e analisado o seu grau de enchimento, utilizando para o efeito uma escala de 0-4 (0= vazio; 1= 25% cheio; 2= 50% cheio; 3= 75% cheio; 4= 100% completamente cheio) (Figura 7) (Soares, Soares, Leitão, & Cristo, 2012). O estômago de cada peixe foi pesado, posteriormente cortado e aberto e o conteúdo removido, e o estômago vazio pesado novamente afim de se obter o peso do conteúdo estomacal. Todas as medidas de peso foram realizadas com a aproximação de 0,1 mg.

Figura 5- Ictimétro usado para medir o comprimento do peixe. Fonte: (Autor, 2019)
8.3.1. Regime alimentar
Em laboratório, foram removidos 167 estômagos de indivíduos capturados na costa do Namibe. Estes foram pesados para determinação do peso dos estômagos com conteúdo, estômago vazio e peso dos itens alimentares encontrados através de uma balança analítica (Figura 6A).


Figura 6- Balanças. A) Balança analítica usada para medição do peso dos estômagos, do conteúdo estomacal e das gónadas. B) Balança para medir o peso total do peixe. Fonte: (Autor, 2019)

Figura 7- Escala para a determinação do grau de enchimento dos estômagos. Fonte: (CIPM, 2019)
O peso do conteúdo foi obtido pela diferença entre o peso do estômago cheio e estômago vazio. O conteúdo estomacal foi fixado em formol a 4% durante um período de 7 dias e em seguida conservado em álcool a 70% para observação. Todas presas foram identificadas até ao mais baixo nível taxonômico possível. As presas foram analisadas com uma lupa binocular, com uma ampliação de 30x.
Quanto a descrição quantitativa da dieta, esta foi feita por meio de frequência de ocorrência que é o método mais eficaz para analisar quantitativamente a dieta de peixes (Santos, Oliveira, & Moralles, 2009). Com base na análise do conteúdo estomacal de todos os espécimes, uma lista é elaborada com os vários tipos de alimento e a seguir é registrada presença ou ausência deste item alimentar em cada espécime analisado. Quando todos os espécimes forem examinados, a proporção dos peixes que contêm um ou mais de um dado tipo de alimento é calculado como a frequência de ocorrência por aquele tipo de alimento (Santos et al., 2009). Se quase todos os peixes contêm em seu estômago o mesmo tipo de presa, isto é claramente documentado com a uniformidade de uma alta frequência de ocorrência. Mas, se um único peixe concentra sua alimentação em um só tipo de comida, isto é reflectido em baixa frequência de ocorrência deste item (Santos et al., 2009).
8.4. Análise e tratamento de dados
8.4.1. Descrição quantitativa da dieta
A análise quantitativa da dieta permite conhecer exclusivamente, a quantidade absoluta ou relativa de alimento ingerido pelo predador, permitindo, desta forma, avaliar a sua intensidade alimentar (Quiatuhanga, 2015).
-
Coeficiente de vacuidade (C.V): expressa a relação entre o número de estômagos vazios e o número total de estômagos observados (Quiatuhanga, 2015).
Equação 1- Coeficiente de vacuidade
![]()
-
Índice de repleção (I.R): visa avaliar o peso das presas ingeridas em função do peso do predador (Quiatuhanga, 2015).
Equação 2- Índice de repleção
![]()
-
Frequência de ocorrência (%Fo): Indica frequência com que um predador ingere um determinado tipo de presa, ou seja, percentagem de estômagos cheios em que a presa ocorre (Carapinha, Neves, Nogueira, & Ovelheiro, 2012). Calculada pelo número de estômagos em que um táxon ocorre dividido pelo número total de estômagos com presença de itens alimentares (Bisi et al., 2012).
Equação 3- Frequência de ocorrência
![]()
-
Método numérico (%Pn): representa a abundância relativa de cada item alimentar na dieta, e é expresso como a percentagem do número total dos itens alimentares na amostra (espécie) estudada (Baião, 2015).
Equação 4- Método numérico
![]()
-
Método gravimétrico (%Pp): consiste em estimar o peso de cada item alimentar, o qual é normalmente expresso como a percentagem do peso total do conteúdo alimentar (Quiatuhanga, 2015).
Equação 5- Método gravimétrico
![]()
8.4.2. Descrição qualitativa da dieta
A análise qualitativa da dieta visa fazer uma descrição completa dos organismos do conteúdo estomacal, ou seja, permite descrever os itens alimentares ocorrentes nos conteúdos estomacais, bem como as suas proporções relativas (Quiatuhanga, 2015).
-
Coeficiente Alimentar (Q): permite caracterizar as presas em três categorias: presas principais (Q> 200); presas secundárias (20
Equação 6- Coeficiente alimentar
![]()
Índice de importância relativa (I.I.R): é uma combinação de três parâmetros (frequência de ocorrência, método numérico e método gravimétrico). O I.I.R quantifica a representatividade de cada espécie de presa, em função da sua participação relativa na densidade e biomassa totais e em todos os conteúdos estomacais analisados. Este índice é considerado um bom indicador da importância ecológica de uma presa em uma determinada dieta (Young & Cockcroft, 1994).
Equação 7- Índice de importância relativa
![]()
Os índices %Pn e %Pp indicam a presa mais importante na dieta de uma espécie ou de um grupo de espécies, o índice %Fo mostra como de maneira uniforme um grupo de espécies selecciona uma presa, sem indicar a sua importância relativa para a outra presa. Este índice é o menos importante em relação aos outros índices na caracterização da cadeia alimentar.
8.5. Comportamento alimentar
Efetuou-se também a descrição gráfica a fim de se compreender o comportamento alimentar da espécie, recorrendo para tal ao diagrama/índice de Costello (1989) (Figura 8), que cataloga os índices de frequência de ocorrência (%Fo) e percentagem em número ou abundância (%Pn), para classificar a seletividade alimentar dos predadores (Baião, 2015).
Tabela 2- Categorias alimentares dos predadores.
|
Categorias dos predadores |
Índices de avaliação da dieta |
|
Especialistas |
Quando os valores de %Fo e %Pn estão situados entre 1 % e 100% |
|
Dominantes |
Quando os valores de %Fo e %Pn estão situados entre 100% e 100% |
|
Generalista |
Quando os valores de %Fo e %Pn estão situados entre 100% e 1% |
Fonte: (Baião, 2015)
No mesmo diagrama, foram representadas as relações entre a importância das presas e a estratégia alimentar do predador, por meio da relação entre a frequência de ocorrência (%Fo) e a percentagem em número ou abundância (%Pn). Esta representação classifica a alimentação dos predadores em homogénea (valores de Fo e %Pn distribuídos por baixo do eixo importância das presas) e heterogénea (valores de Fo e %Pn distribuídos por baixo do eixo estratégia alimentar) (Baião, 2015).
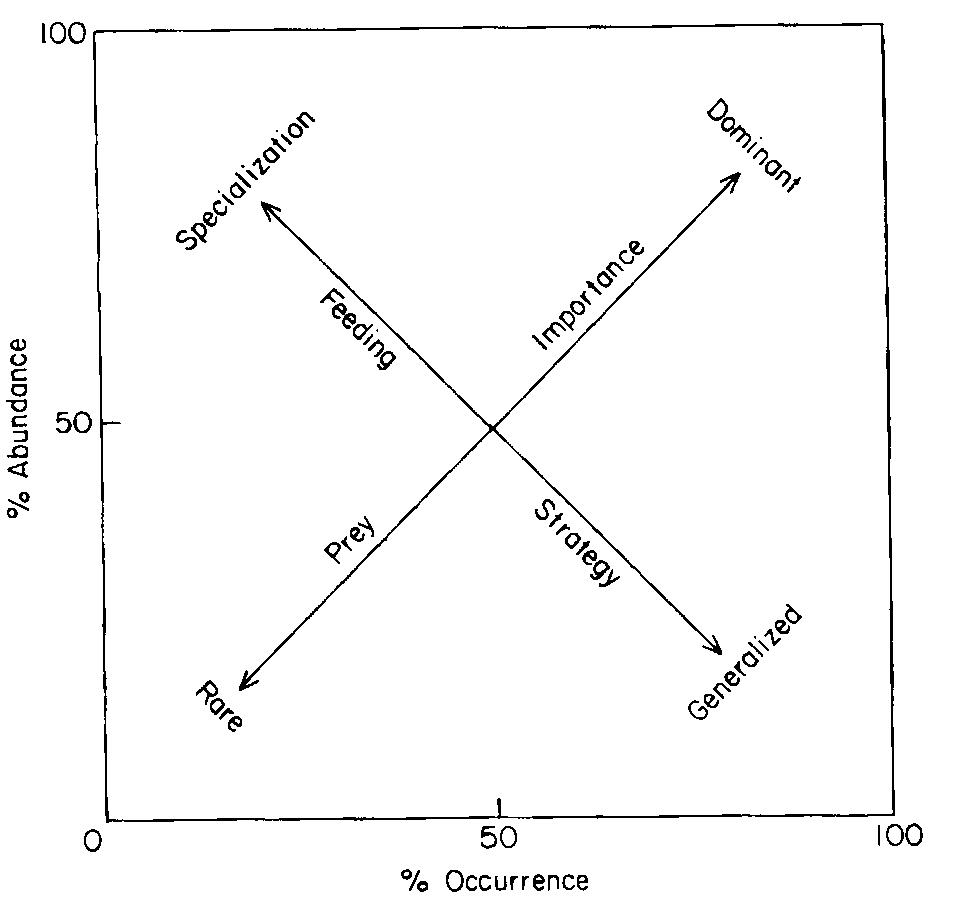
Figura 8- Diagrama de análise da dieta. Fonte: Adaptado de (Costello, 1989)
8.6. RESULTADOS
8.6.1. Descrição das amostras
Durante o período de amostragens (Julho de 2019 a Fevereiro de 2020), o menor indivíduo amostrado apresentou 28 cm de comprimento total e 207 g de peso, enquanto o maior apresentou 45 cm de comprimento total e 869 g de peso.
A frequência de indivíduos por classes de comprimento mostrou que o número mínimo de indivíduos por classe de comprimento foi zero (0) e o máximo foi de 32 indivíduos na classe de comprimento de 34 cm. Os indivíduos encontravam-se distribuídos com menores frequências nas classes 28 à 32, e 38 à 45 cm (n < 10) e com maiores frequências entre as classes 33 à 37 cm (n > 10), (Figura 9). Quanto a distribuição em peso, os resultados mostraram que os maiores pesos foram encontrados entre as classes 34 à 37 cm, tendo a classe de 34 cm sido a mais pesada (12.851,5 g ), (Figura 10).
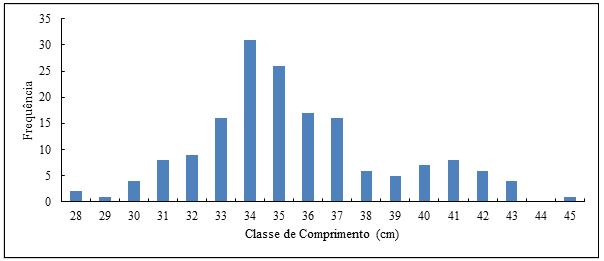
Figura 9- Caracterização da amostra em frequência de S. colias de Julho de 2019 a Fevereiro de 2020.
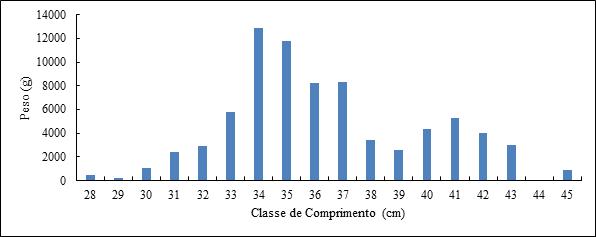
Figura 10- Caracterização da amostra em peso de S. colias de Julho de 2019 a Fevereiro de 2020.
8.6.2. Composição da dieta
8.6.3. Grau de enchimento
Dos 167 estômagos observados e analisados, 46,7% (78) tinham conteúdo no seu interior, 3,59% (6) estavam vazios e 49,7% (83) estavam compostos por massa digerida (escamas, iscos e matéria orgânica). Dos 78 estômagos contendo conteúdo foram separados por sexo, na qual 19,76% (33) correspondia a um grau de enchimento de 1./4; 25,74% (43) correspondia a um grau de enchimento de 2./4; 38,32% (64) correspondia a um grau de enchimento de 3./4 e 12,57% (21) teve um grau de enchimento 4./4, respectivamente (Figura 11). De maneira geral, predominou na amostras estômagos com graus de enchimento de 3./4.
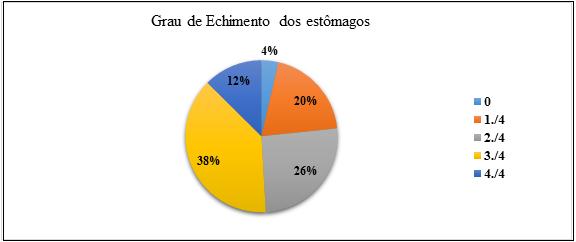
Figura 11- Grau de enchimento dos estômagos da amostra.
8.6.4. Dieta de S. colias capturado na costa do Namibe
A Tabela 3, apresenta o espectro alimentar de S. colias, representados pelos grandes grupos taxonómicos e pelos métodos e índices de avaliação da dieta. Os resultados encontrados mostram que em termos de frequência de ocorrência (%Fo), o item Calanoides cf. carinatus, foi o mais abundante presentes em 48% do total de estômagos, seguindo os ovos aparecendo aproximadamente em 46% do total dos estômagos. A seguir vem os itens Calanus agulhensis aproximadamente 42%, Euphausia recurva 25%, Cathocalanus pauper 24% e Carcinus maenas Megalopa 20%. Seguiram ainda os itens Nephrops norvegicus aproximadamente 13%, Carcinus maenas Zoea 11% do total dos estômagos, respectivamente. No que respeita a percentagem em peso, destacou-se o C. carinatus. Quanto à percentagem em número (%Pn) destacou-se novamente os itens C. carinatus aproximadamente 60% do total de presas, Calanus agulhensis aproximadamente 25%. Destacaram-se ainda os itens C. pauper 9% e ovos de peixe aproximadamente 6% do total de presas presente na amostra.
Tabela 3- Composição da dieta alimentar de S. colias expressa em percentagem em peso (%Pp), percentagem em número (%Pn), frequência de ocorrência (%Fo) coeficiente alimenta (Q) e índice de importâncioa relativa (IIR).
|
Taxa/ Presas |
%Pp |
%Pn |
%Fo |
Q |
IIR |
|
Calanóides |
|
|
|
|
|
|
Calanus agulhensis Calanoides cf. carinatus Cathocalanus pauper |
25,88 60,5 9,67 |
24,55 59,81 9,17 |
41,77 48,1 24,05 |
635,35 3618,65 88,7 |
1051,39 2937,59 230,29 |
|
Poeicilostomatoida |
|
|
|
|
|
|
Oncaea mediterrânea |
0,004 |
0,02 |
3,8 |
0,000075 |
0,08 |
|
Eufasiáceos |
|
|
|
|
|
|
Euphausia recurva |
0,59 |
0,2 |
25,32 |
0,11 |
5,67 |
|
Euphausia pacifica |
0,09 |
0,02 |
5,06 |
0,002 |
0,21 |
|
Decápodes |
|
|
|
|
|
|
Thalassocaris obscura |
0,006 |
0,003 |
1,27 |
0,000019 |
0,01 |
|
Carcinus maenas Megalopa |
1,078 |
0,1 |
20,25 |
0,1 |
3,11 |
|
Carcinus maenas Zoea |
0,002 |
0,03 |
11,39 |
0,000061 |
0,4 |
|
Nephrops norvegicus |
0,53 |
0,06 |
12,66 |
0,03 |
1,32 |
|
Solenocera crassicornis |
0,96 |
0,07 |
0,86 |
0,069 |
1,6 |
|
Thenus orientalis |
0,002 |
0,003 |
1,27 |
0,0000059 |
0,01 |
|
Lophogaster typicus |
0,002 |
0,003 |
1,27 |
0,000006 |
0,01 |
|
Sergestes sp. |
0,002 |
0,003 |
1,27 |
0,000007 |
0,01 |
|
Misidáceos |
|
|
|
|
|
|
Hemimysis anomala |
0,054 |
0,02 |
3,8 |
0,0009 |
0,12 |
|
Hyperiidea |
|
|
|
|
|
|
Hyperia hydrocephala |
0,02 |
0,001 |
2,27 |
0,0001 |
0,02 |
|
Cumacea |
|
|
|
|
|
|
Iphinoe serrata |
0,0004 |
0,001 |
2,53 |
0,000003 |
0,02 |
|
Bivalves |
|
|
|
|
|
|
Achatina fulica |
0,04 |
0,01 |
2,53 |
0,00045 |
0,07 |
|
Anfípodes |
|
|
|
|
|
|
Amphipoda sp. |
0,0003 |
0,003 |
1,27 |
0,0000011 |
0,005 |
|
Peixe |
|
|
|
|
|
|
Ovos |
0,004 |
5,88 |
45,57 |
0,02 |
267,9 |
|
Metade N/I |
0,57 |
0,01 |
1,27 |
0,0059 |
0,59 |
Os valores calculados zdos índices de frequência de ocorrência (%Fo), percentagem em peso (%Pp), percentagem em número (%Pn) e índice de importância relativa (IIR) por sexo (machos e fêmeas) e geral estão representados nas figuras 12, 13 e 14. Os resultados mostram que a frequência de ocorrência para as fêmeas (Figura 13), a sua dieta foi composta principalmente por calanóides (29%), ovos de peixe (25%), decápodes (23%) e eufasiáceos (18%) respectivamente. Já da representatividade em peso (% Pp), os calanóides representaram 95% do peso total, seguido dos decápodes com 5%. Para a percentagem em número e a importância que uma determinada presa tem na dieta da S. colias revelaram que os calanóides são dominante com 92% e 95% do total de estômagos amostrado respectivamente.
Para os machos (Figura 14), verificou-se tal como aconteceu com as fêmeas os resultados mostraram que os calanóides com 28% foram as presas mais frequentes, seguida dos Ovos de peixe 24%, decápodes (22%) e eufasiáceos (14%). Quanto a percentagem em peso (%Pp), os calanóides representaram com cerca de 95% do total de peso. A percentagem em número e índice de importância relativa, os calanóides foram mais importantes com 95% e 97% respectivamente. De forma geral (Figura 12), os resultados mostraram, que a dieta de S. colias, capturado na costa do Namibe foi composta principalmente por calanóides pois estas ocorreram em 29% dos estômagos, seguidas dos ovos de peixe (24%), decápodes (23%), eufasiáceos (16%) respectivamente. Em termos do contributo em peso os resultados mostraram que os calanóides com 97% foi o mais importante. Em termo de percentagem em número, os calanóides com cerca de 94% foram os mais importantes e quanto ao índice de importância relativa os calanóides representaram com 94% tornando assim o grupo de organismos mais importante na dieta alimentar de S. colias.
Em termos de importância ou contributo das presas na dieta de S. colias, observou-se que entre os diferentes grupos taxonómicos encontrados, os calanóides com um coeficiente alimentar de Q=4342,71 constitui a presa principal e os restantes com Q ≤ 20 representam as presas acidentais (Tabela 4).
Tabela 4- Classificação da dieta de S. colias quanto à importância alimentar (Q)
|
Presa principal |
Presas secundárias |
Q≤ 20 |
|
Calanóides |
|
Presas acidentais |
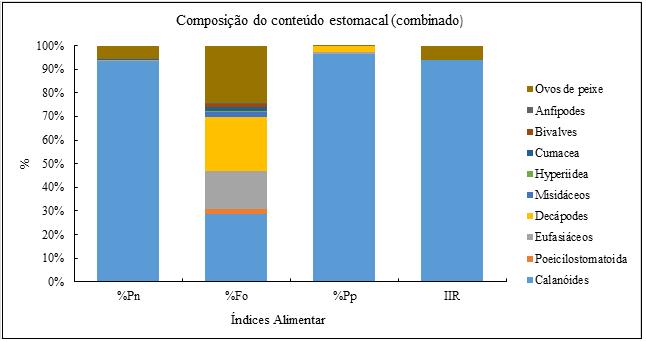
Figura 12- Distribuição dos grupos integrantes na dieta de S. colias expressos em percentagens em números (%Pn), frequências de ocorrência (% Fo), percentagem em peso (% Pp) e índice de importância relativa, dos grandes grupos de presas de S. colias (sexos combinados).
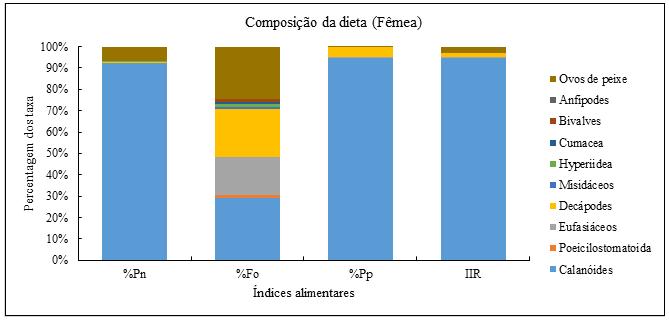
Figura 13- Distribuição dos grupos integrantes na dieta de S. colias expressos em percentagens em números (%Pn), frequências de ocorrência (% Fo), percentagem em peso (% Pp) e índice de importância relativa, dos grandes grupos de presas de S. colias (Fêmea).
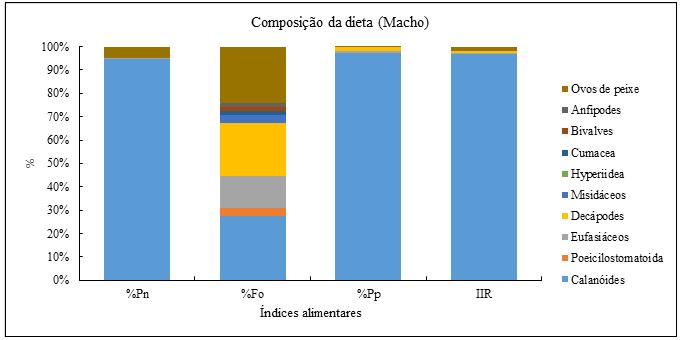
Figura 14- Distribuição dos grupos integrantes na dieta de S. colias expressos em percentagens em números (%Pn), frequências de ocorrência (% Fo), percentagem em peso (% Pp) e índice de importância relativa, dos grandes grupos de presas de S. colias (Machos).
Os resultados obtidos pelo índice de Costello (Figura 15), mostraram que em termos de seletividade alimentar, S. colias é principalmente generalista (2-7). Observou-se também outra fracção de presas que são dominantes (1).
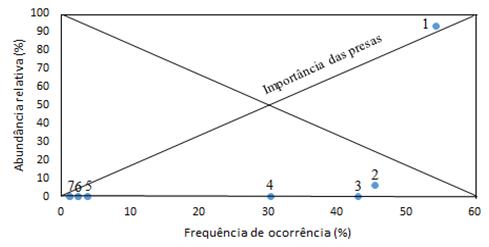
Figura 15- Diagrama de Costello. Adaptado de Costello (1989). 1- Calanóides, 2- Ovos de peixe, 3- Decápodes, 4- Eufasiáceos, 5- Poeicilostomatoida e Misidáceos, 6- Cumacea e Bivalves, 7- Anfípodes e Hyperiidea.
8.6.5. Variações mensais da dieta
Os resultados obtidos na Figura 16, mostram que os calanóides foram os grupos mais importantes na dieta de S. colias capturado na costa do Namibe nos meses de Julho (93%), Agosto (51%), Setembro (97%), Outubro (75%) de 2019 e Fevereiro (64%) de 2020. Em Novembro (2019), os eufasiáceos (64%) foram as presas mais importantes. Já em Dezembro (2019) e Janeiro (2020), os decápodes 98% e 92%, respectivamente, foram as presas mais importantes na dieta alimentar. Verificou-se ainda que em Janeiro (2020) não encontrou-se nenhum estômago com conteúdo dos grupos calanóides aquele que é considerada como a presa principal da S. colias.
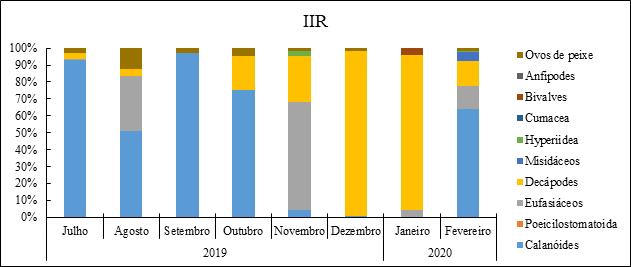
Figura 16- Variação mensal da dieta alimentar de S. colias (Julho 2019 a Fevereiro 2020).
8.7. DISCUSSÃO
8.7.1. Regime alimentar
O estudo dos conteúdos estomacais permitir-nos perceber a composição da dieta de certos organismos e as possíveis variações na sua intensidade alimentar. Por outro lado, o conhecimento dos hábitos alimentares de um organismo, torna-se útil pois permitirá entender como este vive e que tipo de alimento influenicia a sua abundância e distribuição (Baião, 2015). Hernández & Ortega (2000), relataram nos seus estudos que nos peixes juvenis, a dieta desta espécie era composta principalmente por zooplâncton, com a ictiofauna a ter uma menor relevância na dieta. No entanto, a importância do zooplâncton na dieta diminui com o aumento do tamanho dos peixes desta espécie passando a ingerir presas de maiores dimensões. A cavala do oceano Atlântico S. colias, apresenta um padrão ontógenico semelhante com os peixes adultos, alimentarem-se de pequenos peixes, lulas e pequenos crustáceos (Abreu, 2011). Neste trabalho foi observado que 49,7% (83) dos estômagos estavam compostos por escamas e matérias orgânicas e 3,59% (6) estavam vazios.
8.7.2. Dieta alimentar de S. colias
A determinação da dieta de peixes com recurso a análise do conteúdo estomacal é uma técnica amplamente utilizada por permitir o acesso a diferentes categorias de presa. No presente trabalho, esta técnica foi aplicada no que possibilitou acessar ao conteúdo estomacal de S. colias. A análise de resultados, resultou na observância de um grande número de presas em estômagos cheios em comparação com o total de estômagos analisados. O número de estômagos vazios observados reflete por um lado a arte de pesca utilizada para a captura deste recurso (cerco), levando o pescado a um possível stress e por outro, a rápida digestão dos alimentos neste grupo de peixe, sobretudo dos exemplares obtidos do porto pesqueiro, já que muitas das vezes são submetidos a um processo de conservação relativamente deficiente. Adicionalmente, pode estar relacionado com problemas de amostragem. No que respeita a composição da dieta da cavala capturada na costa do Namibe, os resultados revelaram que, os copépodes (calanóides) constituem a pesa principal em termos de abundância e de ocorrência desta espécie. Estes dados estão de acordo com o já referido por alguns autores (Castro, 1993; Abreu, 2011; Hernandes, 1991; Angelescu, 1980) que salientaram os copépodes como a presa principal da dieta da cavala. Os resultados obtidos neste trabalho mostram que em termo de ocorrência, S. colias alimenta-se principalmente de calanóides (29%), Ovos de peixe (24%), decápodes (23%) e eufasiáceos (16%) e em termos de peso, os calanóides foram as presas mais importantes ocupando cerca de 97% do peso total da amostra. Estudos similares realizados na costa continental portuguesa Abreu (2011), ilhas Canárias Castro (1993), costa de Las Palmas Gran Canárias Hernández (1991), no mar del Plata (Argentina) Angelescu (1980), costa da África do Sul Hendricks (2018), constataram que a dieta alimentar de S. colias é baseada principalmente de pequenos peixes, lulas e pequenos crustáceos, sobretudo copépodes e misidáceos, realce ainda para Castro (1993) que encontrou apendicularias. Verifica-se a similaridade na ocorrência de copépodes (calanóides) nos estômagos de S. colias estudados em diferentes costas, o que leva-nos afirmar de copépodes (calanóides) sendo a constante alimentar desta espécie em diferentes mares, ou seja, é a presa principal desta espécie, sugerindo que de alguma maneira satisfaz as necessidades nutricionais da espécie. Além deste grupo, foi observado uma quantidade considerável de outros organismos o que reafirma que a composição deste importante pequeno pelágico reflete sobremaneira a disponibilidade de presas no ambiente que está inteiramente relacionada com a sua localização geográfica, ou seja, diferentes stocks de S. colias apresenta uma composição similares da dieta, porém, a predominância de um grupo em detrimento de outro está relacionada com a sua distribuição geográfica em correlação com a composição de presas no meio.
De acordo com Angelescu (1980), a cavala parece ter diferentes estratégias de alimentação, alimentando-se de plâncton por filtração e também capturando presas de maiores dimensões, e como consequência apresenta uma gama de itens alimentares muito diverso com itens desde copépodes até necton (peixes pequenos e lulas). As conclusões deste autor estão de acordo com os dados obtidos no presente estudo, tendo sido constatada a tendência para a predação de crustáceos maiores e peixes nos indivíduos de maiores dimensões, com os indivíduos de menores dimensões a preferirem zooplâncton. Isto, de maneira clara, sugere que a cavala ocorrente nas águas angolanas, à semelhança de outros stocks do atlântico, apresenta uma grande flexibilidade alimentar, alimentando-se de uma vasta gama de presas, com tendência para especialista em termos de consumo de copépodes calanoides, por, talvez, melhor satisfazer as suas necessidades nutricionais.
As alterações dos hábitos alimentares da cavala, em função do aumento do seu tamanho, poderão ser esclarecidas através de modificações da sua morfologia, mais especificamente da abertura da boca (Castro & Santana del Pino, 1995). Os indivíduos passam a dispor de um conjunto de características que lhes permite a captura de presas de maiores dimensões, provavelmente com o aumento da dimensão do corpo e da maior capacidade muscular, permitindo-lhes colmatar as necessidades energéticas inerentes ao aumento de dimensão, bem como da reprodução. Essas mudanças pode ter outra explicação possível que poderá ajudar a explicar as diferenças observadas na dieta da cavala à medida que aumenta de tamanho. No presente trabalho foi apenas utilizado espécies com um padrão de comprimento similar já que utilizou-se espécie capturado pela arte de cerco sendo desenhada para espécie que nadam em cardumes e geralmente um cardume é composto por peixes de tamanhos iguais. Sendo assim, não se tem a explicação exata quanto ao hábito alimentar desta espécie em diferentes tamanhos na costa do Namibe.
8.7.3. Coeficiente Alimentar
Tendo em conta aos valores dos coeficientes alimentares (Q) encontrados, observou-se que os Calanóides são as presas principais, decápodes, ovos de peixes, eufasiáceos, misidáceos, bivalves, cumaceas, hiperídeas, poeicilostomatoides e anfípodes são presas acidentais. Tendo em conta a seletividade na alimentação, os resultados encontrados por Angelescu (1980) verificou que a dieta da cavala era muito flexível, tanto em número de taxa de presas como em gama de tamanhos das presas. Para este e outros autores (e.g. Yasuda,1960), a cavala é uma espécie oportunista. No entanto, é de destacar que os resultados do presente trabalho sugere que a espécie S. colias é um predador principalmente generalista com preodominância de copépodes calanóides, essa diferença deve-se, talvez, ao uso de métodos distintos, já que o presente trabalho baseou-se apenas no diagrama de costello (1989) para definir a categorias alimentares dos predadores. Podendo, igualmente ser justificado, tal como mencionado acima, à disponibiidade de alimentos no meio.
8.7.4. Variação mensal da dieta
Quando à variação mensal da dieta, verficou-se que a sua dieta é dominada principalmente pelos copépodes (calanóides), que é o grupo mais importante na sua dieta alimentar. Em Julho, os calanóides dominaram com cerca de 93%, Agosto a dieta foi um pouquinho mais equilibrado entre os copépodes (51%), eufasiáceos (33%) e ovos de peixe (12%). Em Setembro e Outubro o domínio total dos copépodes com 97% e 75%, seguido dos pequenos crustáceos (decápodes) (20%), isto em Outubro. Já em Novembro, a dieta alimentar de S. colias variou os eufasiáceos (64%) dominaram neste mês, seguidos pelos pequenos crustáceos (27%). Em Dezembro (2019) e Janeiro (2020), a dieta de S. colias foi composta principalmente por pequenos crustáceos com cerca de 98% e 92%, respectivamente. Os copépodes voltaram a dominar apenas em Fevereiro com 64%, seguido dos pequenos crustáceos (15%) e eufasiáceos (14%). Nas ilhas Canárias foi observado que, nos meses frios, entre dezembro e maio, a principal presa em todas as classes de comprimento, foram peixes (Castro, 1993). No entanto, num estudo conduzido por Fátima et al. (2015) na costa Noroeste Atlântica de África e para a mesma época predominaram os copépodes e pequenos crustáceos, enquanto nos meses quentes predominaram os peixes e copépodes. Esta diferença sazonal e espacial na composição de presas na dieta da Cavala resulta principalmente da disponibilidade de cada grupo de organismos ao longo do ano e dos habitats (Porfírio, 2017).
9. CONCLUSÕES
Os peixes pelágicos são elementos essenciais dos ecossistemas marinhos devido à sua biomassa significante nos níveis intermédios da cadeia trófica, à sua função como importante elo de ligação entre os níveis tróficos inferiores e superiores e a sua elevada importância comercial. No entanto, não existem estudos especificamente sobre a ecologia alimentar da cavala capturada na Costa do Namibe, como tal, o presente trabalho melhora os conhecimentos sobre a dieta de S. colias, já que permitiu analisar a composição da sua dieta e intensidade com que esta ingere um dado alimento.
Ao longo do presente estudo foi possível perceber que a cavala é uma espécie costeira que se alimenta de uma grande variedade de presas com diferentes comportamentos, tendo preferência por copépodes. A sua dieta é maioritariamente constituída por copépodes (calanóides). Foram também encontrados outros grupos considerados como presa acidental destacando os ovos de peixes, decápodes e eufasiáceos. A sua presa principal na costa do Namibe é o Calanoides cf. carinatus, seguindo-se o Calanus agulhensis, mas resultados diferentes foram obtidos por outros autores para outras águas, mostrando que existe uma variação geográfica na dieta da cavala, que depende das presas mais abundantes em diferentes regiões geográficas. Foram detetadas ainda variações mensais na dieta, que aparentemente se devem a alterações na abundância das presas ao longo do ano. Esta variabilidade encontrada leva a crer que a cavala é um predador generalista com dominância em copépodes (calanóides), ou seja, sem preferência acentuada por uma fonte alimentar, utilizando um amplo espectro de alimentos mas sujeitando-se à sua abundância local em cada momento, embora para outras águas, outros autores sugeriram que esta espécie é oportunista, ou seja, se alimenta de fonte não usual de sua dieta ou fazem uso de uma fonte alimentar abundante e incomum.
Apesar das enormes limitações discutidas na secção anterior, pode-se dizer que foi dado um importante passo no sentido de aumentar o conhecimento sobre uma espécie que é residente na nossa costa, o que colmata ou preenche parte do deserto bibliográfico sobre a sua biologia e ecologia. Apesar dos vários estudos existentes sobre a cavala, é a primeira vez que a sua ecologia alimentar é estudada na costa do Namibe. Sendo esta uma espécie muito capturada, o aumento do conhecimento de aspectos da sua ecologia é fundamental para ser tomadas medidas de gestão adequadas e aumentar a sua eficácia de modo a preservar o recurso marinho vivo.
10. SUGESTÕES
Depois das constatações feitas e observadas em correlação com as conclusões com que se chegou, é deixado as seguintes sugestões:
-
Os estudantes do Curso de Biologia Marinha, para o Trabalho de Conclusão de Curso de Licenciatura devem a apostar em temas práticos e de grandes pendores científicos, tais como: Ecologia alimenatar, reprodução, Idade e Crescimento de modo a contribuir no conhecimento da biologia de uma determinada espécie ocorrido na nossa costa de forma a facilitar na medida de gestão daquela mesma espécie.
-
Dada o rigor científico aplicado no presente trabalho, sugere-se que este documento seja utilizado como material de consulta na Biblioteca e Departamento de Biologia Marinha.
-
Trazer mais novidades e continuar investigar no presente tema, já que a ciência não é fixa e alguns padrões variam com passar dos anos o que permite que os dados possam ser diferentes anos após anos.
10.1. Medidas de gestão para a espécie
-
Definir período de veda para Cavala de modo a manter a abundância da espécie, sendo ela alternativa ao carapau.
-
Promover paletras e entrevistas aos armadores e pescadores de modo a manter uma exploração saudável deste recurso.
-
Propor ao ministério de tutela a inclusão da espécie nos planos de trabalho dos cruzeiros de investigação afim de se puder controlar a sua biomassa tal como é feito com outras espécies pelágicas;
-
Redifinição dos TACS e Quotas relacionadas com a espécie.
11. REFERÊNCIAS BIBLIOGRÁFICAS
Abreu, S. A. (2011). Interacções tróficas entre sardinha (S. pilchardus) e cavala (S. colias). Tese de Mestrado, Universidade de Algarve, Departamento de Aquacultura e Pescas, Algarve.
Alves, M. F. (2016). Survey of parasites of Atlantic Chub Mackerel (Scomber colias) with economic and public health impact. Tese de Mestrado, Faculdade de Ciências da Universidade do Porto, Departamento de Biologia, Porto. Acesso em 25 de Maio de 2020
Angelescu, V. (1980). Ecologia Trofica de la Caballa (Scombridae, Scomber japonicus marplatensis) Del Atlantico Sudoccidental. Instituto Nacional de Investigación y Desarrollo Pesquero INIDEP, Mar del Plata-Argentina. Acesso em 10 de Abril de 2020
Baião, N. F. (2015). Crescimento, ecologia alimentar e reprodução de Trachurus trecae (Cadenat, 1949), na costa sul de Angola-Namibe. Tese de Mestrado, Universidade do Algarve, Faro. Acesso em 13 de Agosto de 2019
Bisi, T. L., José, L.-B., & Malm, O. (2012). Ecologia alimentar em mamíferos marinhos: Técnicas de estudo. Tese de Doutoramento, Universidade Federal do Rio de Janeiro (UFRJ), Departamento de Ecologia, Rio de Janeiro.
Braga, R. R. (2012). Ecologia alimentar de peixes: Revisão e avaliação da aplicabilidade da lavagem gástrica para estudos com peixes de riachos neotropicais. Tese de Mestrado, Universidade Federal do Paraná, Departamento de Ciências Biológicas, Curitiba.
Carapinha, J., Neves, V., Nogueira, A., & Ovelheiro, A. (2012). Estudo de Idade/Crescimento, Reprodução e Regime Alimentar de Trachurus trachurus (Linneus, 1758) na Costa Atlântica Portuguesa. Universidade do Algarve, Departamento de Biologia e Ecologia Pesqueira, Faro. Acesso em 10 de Setembro de 2019
Carvalho, N., Perrota, R. G., & Isidro, E. (2002). Age, growth and maturity in chub mackerel (Scomber japonicus Houttuyn, 1782) from the Azores. Arquipélago.
Castro, J. J. (1993). Feeding ecology of chub mackerel Scomber japonicus in the Canary islands area. South African Journal of Marine Science, Departamento de Biologia, Canary Islands. doi:10.2989/025776193784287400
Castro, J., & Santana del Pino, A. (1995). Feeding preferences of Scomber japonicus in the Canary Islands area. Scientia Marina.
Čikeš Keč, V., & Zorica, B. (2012). The reproductive traits of Scomber japonicus (Houttuyn, 1782) in the Eastern Adriatic Sea. Split, Croatia: J. Appl. Ichthyol. Acesso em 18 de Julho de 2020
Collette, B. (1986). Scombridae. In: Fishes ofthe North-eastern Atlantic and the Mediterranean (Vols. 2 (P.J. PWhitehead, M-L. Bauchot, J.-C. Hureau, J. Nielsen E. Tortonese, eds)). (UNESCO, Trad.) París, França.
Costello, M. J. (1989). Predator feeding strategy and prey importance: a new graphical analysis. Acesso em Agosto de 2020
Cury, P. (2000). Small pelagics in upwelling systems: patterns of interaction and structural changes in “wasp-waist” ecosystems. ICES Journal of Marine Science.
Dávila-Fernández, C. (1985). Túnidos y demás escómbridos mundiales. Ministerio de Agricultura, Pesca y Alimentación, Madrid. Acesso em 18 de Outubro de 2019
FAO. (1997). FISHSTAT PC. A PC system for the extended time series of global catches. FAO, Data and Statistic Unit. FAO-Fisheries Department. Computer Operation Manual. Acesso em 18 de Outubro de 2019
Fátima, W., Tojo, N., Ramzi, A., Somoue, L., Manchih, K., & Errhif, A. (2015). Seasonal and size-dependent variability in diet of Scomber colias (Gmelin, 1789) of the Atlantic Coast of the Northwest Africa (Issue 12 ed., Vol. Volume 3). Acesso em 11 de Abril de 2020
Ferreira, V. (10 de Agosto de 2019). Omare. Fonte: Omare: www.omare.pt
Hendricks, J. P. (2018). The parasite assemblage of Scomber japonicus (Houttyun, 1782) off South Africa. Tese de Mestrado, University of Cape Town , Department of Biological Science . Acesso em 10 de Abril de 2020
Hernández, J. J. (1991). Ecología Trófica de la Caballa (Scomber japonicus Houttuyn, 1780), en águas del Arcipiélago Canario. Univesidad de Las Palmas de Gran Canaria, Departamento de Biologia. Las Palmas: Universidad de Las Palmas de Gran Canaria. Biblioteca Digital, 2003 . Acesso em 10 de Abril de 2020
Hernández, J. J., & Ortega, A. T. (2000). Synopsis Of Biological Data On the Chub Mackerel (Scomber japonicus Houttuyn, 1782)- FAO Fisheries Synorsis No. 157. Universidad de Las Palmas de Gran Canaria, Departamento de Biología, Las Palmas de Gran Canaria.
Infante, C., Blanco, E., Zuasti, E., Crespo, A., & Manchado, M. (2006). Phylogenetic differentiation between Atlantic Scomber colias and Pacific Scomber japonicus based on nuclear DNA sequences. Springer+Business. Acesso em 14 de Junho de 2020
Kramer, D. (1969). Synopsis of the biological data on the pacific mackerel, Scomber japonicus Houttuyn (northeast Pacific). U.S. Fish Wildl. Seri.
Lorenzo, J. M., Pajuelo, J. G., & Ramos, A. G. (1995). Growth of the Chub Mackerel Scomber japonicus (Pisces: Scombridae) off the Canary Island. Acesso em 2 de Junho de 2020
Lubzens, E., Young, G., Bobe, J., & Cerdà, J. (2009). Oogenesis in teleosts: How fish eggs are formed. Gen. Comp. Endocrinol. doi:10.1016/ j.ygcen
Pitcher, T., & Parrish, J. (1993). Functions of shoaling behaviour in teleosts. Acesso em 4 de Setembro de 2019
Porfírio, A. C. (2017). Biologia do Crescimento da Cavala (Scomber colias) na Costa Portuguesa. Tese de Mestrado, Universidade de Lisboa , Departamento de Biologia Animal, Lisboa. Acesso em 25 de Maio de 2020
Quiatuhanga, D. P. (2015). Material de Apoio de Biologia Pesqueira. Moçâmedes. Acesso em 13 de Julho de 2019
Quigley, D., & Flannery, K. (1994). Spanish mackerel Scomber japonicus (Houttuyn, 1782) in the Irish waters: A further record and a review of Irish record.
Santos, A. R., Oliveira, F. R., & Moralles, A. C. (2009). Análise do conteúdo estomacal de Astyamax lineatus (Perugia 1891) (Characiformes: Characidae), provenientes da Serra da Bodoquena. Mato Grosso do Sul, Brasil.
Saquenha, E. D. (2015). Influência dos fatores ambientais na distribuição e abundância dos recursos pesqueiros na zona sul de Angola (Namibe). Tese de Mestrado, Universidade de Aveiro, Departamento de Ambiente e Ordenamento.
Schaefer, K. M. (1986). Lethal temperatures and the effect of temperature change on volitional swimming speeds of Chub Mackerel, Scomber japonicus (Vols. Copeia, Vol. 1986, No. 1 (Feb. 10, 1986)). American Society of Ichthyologists and Herpetologists (ASIH).
Silva, B. D. (2016). Relação Morfométrica Peso-Comprimento do Mexilhão (Mytilus edulis, Linneaus, 1758) na Zona Piscatória do Mucuio na Província do Namibe. Monografia de Licenciatura, Universidade Mandume Ya Ndemufayo, Departamento de Biologia Marinha, Namibe.
Silva, D. A., Pessoa, E. K., Costa, S. A., Chellappa, N. T., & Chellappa, S. (2007). Ecologia alimentar de Astyanax lacustris (Osteichthyes: Characidae) na Lagoa do Piató, Assu, Rio Grande do Norte, Brasil. Tese de Pós-Graduação em Psicobiologia, Universidade Federal do Rio Grande do Norte, Departamento de Morfologia, Rio Grande do Norte. Acesso em 16 de Outubro de 2019
Simãozinho, P. F. (2011). Idade e crescimento da cavalinha (Scomber japonicus Houttuyn, 1782) capturada pela frota de cerco no sudeste e sul do Brasil. Universidade do Vale do Itajaí (UNIVALI), Departamento de Oceanografia. Itajaí: CTTMAR.
Soares, F. F., Soares, R., Leitão, J., & Cristo, F. (2012). Feeding ecology and morfhometric relationships of white seabreams, Diplodus sarguslineatus (Sparidae) endemic species of Cape Verde. Cybuim.
Tchipalanga, P., & Fidel, Q. (2010). Situação Oceanográfica do Namibe. Namibe: Centro de Investigacao Pesqueira.
Vasconcelos, J., Dias, M. A., & Faria, F. (2011). Age and growth of the Atlantic chub mackerel Scomber colias Gmelin, 1789 off Madeira Island. Arquipélago. Acesso em 2 de Junho de 2020
Velasco, E. M., Arbol, D. J., Baro, J., & Sobrino., I. (Abril de 2011). Age and growth of the Spanish chub mackerel Scomber colias off southern Spain: a comparison between samples from the NE Atlantic and the SW Mediterranean. Revista de Biología Marina y Oceanografía, Vol. 46(Nº1), 27-34. Acesso em 2 de Junho de 2020
Vitule, J. R., & Aranha, J. M. (2002). Ecologia alimentar do lambari, Deuterodon langei Travassos, 1957 (Characidae, Tetragonopterinae), de diferentes tamanhos em um riacho da Floresta Atlântica, Paraná (Brasil). Tese de Mestrado, Universidade Federal do Paraná, Departamento de Zoologia, Curitiba.
Young, D., & Cockcroft. (1994). Diet of common dolphins (Delphinus delphis) off the south-east coast of southern Africa: opportunism or specialization? Journal of Zoology, 234: 41-53.
12. APÊNDICES
Apêndice 1- Dados Anuais de Capturas da Província do Namibe (2015- Julho de 2019).
|
Espécie |
2015 |
2016 |
2017 |
2018 |
I Semestre 2019 |
|
Carapau |
6405,1 |
4969,2 |
10636,7 |
8236,5 |
4679 |
|
Sardinha |
46794,5 |
84162,6 |
75422,6 |
41204,1 |
18439,5 |
|
Cavala |
7692,9 |
4842,3 |
6006,7 |
7635,9 |
4183,7 |
|
Taco-Taco |
359 |
196,6 |
1090,7 |
298,5 |
161,2 |
|
Caranguejo |
639 |
1748,7 |
1751,9 |
1951,9 |
318,6 |
|
Anchova |
59,1 |
195,9 |
1121,2 |
123,8 |
130,8 |
|
Cachucho |
230,2 |
1166,3 |
2216,5 |
4443,9 |
1484 |
|
Corvina |
3533,5 |
88,2 |
854,2 |
1039,5 |
408,3 |
|
Diversos |
1502,7 |
851,5 |
10902,3 |
2402,7 |
889,5 |
|
Total (Kg) |
67216 |
98221,3 |
110002,8 |
67336,8 |
30694,6 |
Fonte: (Direcção Provincial das Pescas do Namibe, 2019)
Apêdice 2- Escala adaptada pelo INIP para a classificação dos estados de maturação dos atuns, carapau, cavala e sardinha em Angola (espécies com desova parcelar).
|
Estado de Maturação |
Descrição |
|
I Imaturo |
Gónada pequena, não ocupam mais do que 1/3 do comprimento da cavidade abdominal; ovários róseos e testículos esbranquiçados; os ovários não apresentam oócitos visíveis. |
|
II Virgem em desenvolvimento. E recuperação Pós-desova |
As gónadas apresentam um desenvolvimento aumentado substancialmente de tamanho; podem ocupar até ½ da cavidade abdominal; gónadas mais opacas e pequenos pontos são visíveis a vista desarmada (oócitos em início de vitelogenese). As gónadas em repouso/recuperação são mais flácidas e podem ter alguns vasos sanguíneos mais conspícuos do que as gónadas em desenvolvimento. |
|
III Maturação antes da pré-desova |
No início, os pequenos oócitos tornam-se mais conspícuos conferindo à gónada um aspecto granular; ovários amarelo-laranja e testículos de cor creme. Quando se cortam os testículos o esperma fica visível. Neste estado as gónadas, no início da época de reprodução estão bastante túrgidas. As gónadas que já desovaram uma vez, perdem a consistência inicial, mas a presença de oócitos opacos, nos ovários e esperma quando se corta o testículo, é característico deste estado. No final deste estado é possível encontrar alguns oócitos translúcidos. Gónadas ocupam cerca de 2/3 do comprimento total da cavidade abdominal. |
|
IV Maturo Pré-desova |
As gónadas ocupam cerca de 2/3 ou da totalidade do comprimento da cavidade abdominal; ovários de cor alaranjada com os vasos sanguíneos bastante visíveis e ensanguentada principalmente numa da extremidade. A maior parte dos oócitos são translúcidos; testículos de cor creme e com textura lisa e brilhante. As gónadas deixam sair oócitos e o esperma a mínima pressão e apresentam manchas róseas numa das extremidades. |
|
V Maturo em desova |
As gónadas ocupam cerca de 2/3 ou da totalidade do comprimento da cavidade abdominal; ovários de cor alaranjada com os vasos sanguíneos bastante visíveis e ensanguentada principalmente numa da extremidade. A maior parte dos oócitos são translúcidos; testículos de cor creme e com textura lisa e brilhante. As gónadas deixam sair oócitos e o esperma a mínima pressão e apresentam manchas róseas numa das extremidades. |
|
VI Pós-desova |
As gónadas diminuem de tamanho e ocupam cerca de ½ ou menos, do comprimento total da cavidade abdominal. Gónadas flácidas e ensanguentadas. O ovário pode conter resto do oócitos que não foram emitidos. Os testículos podem apresentar resto de esperma no ducto semenal. Os testículos podem apresentar umas manchas róseas em toda a extensão da gónada. |
Fonte: (CIP, 2019)
Apêndice 3- Observação microscópica dos conteúdos estomacais. Fonte: (Autor, 2019)

Apêndice 4- Alguns grupos de organismos encontrados no estômago da amostra

Fonte: Autor
Apêndice 5- Dieta alimentar em fêmeas e machos
Fêmeas
|
Presas |
%Pn |
%Fo |
%Pp |
IIR |
Q |
|
Calanóides |
92,30 |
63,41 |
94,72245 |
11859,85 |
8742,72 |
|
Poeicilostomatoida |
0,03 |
2,44 |
0,004386 |
0,076958 |
0,000119 |
|
Eufasiáceos |
0,20 |
39,02 |
0,549717 |
29,13851 |
0,108271 |
|
Decápodes |
0,46 |
48,78 |
4,646245 |
248,8431 |
2,114224 |
|
Misidáceos |
0,01 |
2,44 |
0,019369 |
0,063806 |
0,000132 |
|
Hyperiidea |
0,01 |
2,44 |
0,027107 |
0,099244 |
0,000368 |
|
Cumacea |
0,01 |
2,44 |
0,000394 |
0,017527 |
2,68E-06 |
|
Bivalves |
0,01 |
2,44 |
0,02645 |
0,081076 |
0,00018 |
|
Anfípodes |
0,00 |
0,00 |
0 |
0 |
0 |
|
Ovos de peixe |
6,99 |
53,66 |
0,00388 |
375,2057 |
0,027119 |
|
Média |
10 |
21,70732 |
10 |
1251,338 |
874,4971 |
|
Desvio padrão |
29 |
26,08 |
29,8 |
3729,78 |
2764,61 |
Machos
|
Presas |
%Pn |
%Fo |
%Pp |
IIR |
Q |
|
Calanóides |
94,80 |
59,26 |
97,39527 |
11389,08 |
9232,632 |
|
Poeicilostomatoida |
0,01 |
7,41 |
0,002717 |
0,124601 |
3,83E-05 |
|
Eufasiáceos |
0,25 |
29,63 |
0,821829 |
31,66385 |
0,202849 |
|
Decápodes |
0,16 |
48,15 |
1,614314 |
85,53587 |
0,261842 |
|
Misidáceos |
0,03 |
7,41 |
0,095971 |
0,919848 |
0,002707 |
|
Hyperiidea |
0,00 |
0,00 |
0 |
0 |
0 |
|
Cumacea |
0,01 |
3,70 |
0,000488 |
0,027928 |
3,44E-06 |
|
Bivalves |
0,01 |
3,70 |
0,065527 |
0,294931 |
0,000924 |
|
Anfípodes |
0,01 |
3,70 |
0,000754 |
0,028912 |
5,32E-06 |
|
Ovos de peixe |
4,72 |
51,85 |
0,00313 |
245,1605 |
0,014788 |
|
Média |
10,00 |
21,48 |
10,00 |
1175,28 |
923,31 |
|
Desvio padrão |
29,83 |
23,41 |
30,71 |
3589,59 |
2919,60 |
Apêndice 6- Descrição quantitativa da dieta
Índice de repleção (I.R%) e Coeficiente de vacuidade (CV%)
|
|
|
|
187,76 |
|
|
ID |
W/ conteúdo (g) |
Peso do peixe (g) |
IR % |
CV % |
|
1 |
5,57 |
561 |
0,99 |
52,69 |
|
2 |
0 |
632 |
0,00 |
|
|
3 |
2,38 |
586 |
0,41 |
|
|
4 |
6,4 |
511 |
1,25 |
|
|
5 |
5,25 |
794 |
0,66 |
|
|
6 |
2,45 |
624 |
0,39 |
|
|
7 |
2,42 |
648 |
0,37 |
|
|
8 |
4,28 |
547 |
0,78 |
|
|
9 |
6,62 |
654 |
1,01 |
|
|
10 |
11,31 |
746 |
1,52 |
|
|
11 |
0,94 |
643 |
0,15 |
|
|
12 |
8,07 |
623 |
1,30 |
|
|
13 |
6,64 |
664 |
1,00 |
|
|
14 |
39,32 |
608 |
6,47 |
|
|
15 |
0 |
669 |
0,00 |
|
|
16 |
6,2 |
335 |
1,85 |
|
|
17 |
1,35 |
577 |
0,23 |
|
|
18 |
6,77 |
869 |
0,78 |
|
|
19 |
1,44 |
462 |
0,31 |
|
|
20 |
8,48 |
655 |
1,29 |
|
|
21 |
9,11 |
675 |
1,35 |
|
|
22 |
6,85 |
672 |
1,02 |
|
|
23 |
10,48 |
741 |
1,41 |
|
|
24 |
17,5 |
710 |
2,46 |
|
|
25 |
4,69 |
708 |
0,66 |
|
|
26 |
1,51 |
533 |
0,28 |
|
|
27 |
9,44 |
614 |
1,54 |
|
|
28 |
0,56 |
380 |
0,15 |
|
|
29 |
1,04 |
507 |
0,21 |
|
|
30 |
8,32 |
604 |
1,38 |
|
|
31 |
4,37 |
411 |
1,06 |
|
|
32 |
3,9 |
344 |
1,13 |
|
|
33 |
6,36 |
414 |
1,54 |
|
|
34 |
9,47 |
568 |
1,67 |
|
|
35 |
6,14 |
411 |
1,49 |
|
|
36 |
3,48 |
356 |
0,98 |
|
|
37 |
22,03 |
470 |
4,69 |
|
|
38 |
9,55 |
428 |
2,23 |
|
|
39 |
41,15 |
380 |
10,83 |
|
|
40 |
11,82 |
514 |
2,30 |
|
|
41 |
14,24 |
532 |
2,68 |
|
|
42 |
9,55 |
522 |
1,83 |
|
|
43 |
8,89 |
641 |
1,39 |
|
|
44 |
9,81 |
639 |
1,54 |
|
|
45 |
0 |
619 |
0,00 |
|
|
46 |
15,91 |
722 |
2,20 |
|
|
47 |
9 |
396,5 |
2,27 |
|
|
48 |
6 |
402,5 |
1,49 |
|
|
49 |
10 |
322,5 |
3,10 |
|
|
50 |
4,5 |
480 |
0,94 |
|
|
51 |
8 |
495 |
1,62 |
|
|
52 |
5,5 |
436 |
1,26 |
|
|
53 |
8,5 |
461 |
1,84 |
|
|
54 |
8,5 |
429,5 |
1,98 |
|
|
55 |
8 |
398 |
2,01 |
|
|
56 |
11,5 |
418 |
2,75 |
|
|
57 |
7,5 |
430,5 |
1,74 |
|
|
58 |
6 |
455 |
1,32 |
|
|
59 |
10 |
433,5 |
2,31 |
|
|
60 |
9 |
436 |
2,06 |
|
|
61 |
9,5 |
434 |
2,19 |
|
|
62 |
6 |
480 |
1,25 |
|
|
63 |
8 |
470,5 |
1,70 |
|
|
64 |
7 |
391,5 |
1,79 |
|
|
65 |
11,5 |
262 |
4,39 |
|
|
66 |
7,5 |
411 |
1,82 |
|
|
67 |
9,5 |
473,5 |
2,01 |
|
|
68 |
9,5 |
435 |
2,18 |
|
|
69 |
4,5 |
493,5 |
0,91 |
|
|
70 |
7,5 |
496 |
1,51 |
|
|
71 |
3 |
590,5 |
0,51 |
|
|
72 |
7,5 |
458 |
1,64 |
|
|
73 |
3,5 |
486 |
0,72 |
|
|
74 |
7,5 |
522,5 |
1,44 |
|
|
75 |
4,5 |
492 |
0,91 |
|
|
76 |
5 |
434,5 |
1,15 |
|
|
77 |
8 |
507 |
1,58 |
|
|
78 |
3 |
484 |
0,62 |
|
|
79 |
3 |
544 |
0,55 |
|
|
80 |
5,5 |
532 |
1,03 |
|
|
81 |
4 |
480 |
0,83 |
|
|
82 |
11,5 |
557 |
2,06 |
|
|
83 |
5 |
431 |
1,16 |
|
|
84 |
4 |
445 |
0,90 |
|
|
85 |
5,5 |
563,5 |
0,98 |
|
|
86 |
8 |
469,5 |
1,70 |
|
|
87 |
6 |
528,5 |
1,14 |
|
|
88 |
7,5 |
372 |
2,02 |
|
|
89 |
4,18 |
247 |
1,69 |
|
|
90 |
3,4 |
256 |
1,33 |
|
|
91 |
1,36 |
272 |
0,50 |
|
|
92 |
3,56 |
345 |
1,03 |
|
|
93 |
2,32 |
311,5 |
0,74 |
|
|
94 |
1,59 |
353,5 |
0,45 |
|
|
95 |
4,25 |
379 |
1,12 |
|
|
96 |
0,95 |
331 |
0,29 |
|
|
97 |
2,12 |
282 |
0,75 |
|
|
98 |
4,23 |
306,5 |
1,38 |
|
|
99 |
1,37 |
460,5 |
0,30 |
|
|
100 |
4,24 |
465,5 |
0,91 |
|
|
101 |
2,68 |
451,5 |
0,59 |
|
|
102 |
1,81 |
393,5 |
0,46 |
|
|
103 |
1,95 |
441,5 |
0,44 |
|
|
104 |
3,23 |
423 |
0,76 |
|
|
105 |
0,93 |
293 |
0,32 |
|
|
106 |
2,53 |
401,5 |
0,63 |
|
|
107 |
4,82 |
422,5 |
1,14 |
|
|
108 |
2,85 |
403 |
0,71 |
|
|
109 |
1,83 |
342,5 |
0,53 |
|
|
110 |
1,73 |
302 |
0,57 |
|
|
111 |
2,29 |
447 |
0,51 |
|
|
112 |
2,11 |
326 |
0,65 |
|
|
113 |
1,91 |
442,5 |
0,43 |
|
|
114 |
1 |
301 |
0,33 |
|
|
115 |
2,24 |
467 |
0,48 |
|
|
116 |
1,71 |
328,5 |
0,52 |
|
|
117 |
1,73 |
397 |
0,44 |
|
|
118 |
0,76 |
294,5 |
0,26 |
|
|
119 |
0,19 |
344 |
0,06 |
|
|
120 |
1,32 |
380 |
0,35 |
|
|
121 |
3,85 |
439,5 |
0,88 |
|
|
122 |
2,78 |
386,5 |
0,72 |
|
|
123 |
1,06 |
330 |
0,32 |
|
|
124 |
1,15 |
454,5 |
0,25 |
|
|
125 |
2,41 |
315,5 |
0,76 |
|
|
126 |
1,48 |
344 |
0,43 |
|
|
127 |
2,41 |
323 |
0,75 |
|
|
128 |
1,17 |
380 |
0,31 |
|
|
129 |
3,91 |
477 |
0,82 |
|
|
130 |
6,5 |
394,5 |
1,65 |
|
|
131 |
1,5 |
268 |
0,56 |
|
|
132 |
3 |
381,5 |
0,79 |
|
|
133 |
1,5 |
252 |
0,60 |
|
|
134 |
2 |
236,5 |
0,85 |
|
|
135 |
2 |
338 |
0,59 |
|
|
136 |
2,5 |
422 |
0,59 |
|
|
137 |
1,5 |
372 |
0,40 |
|
|
138 |
2,5 |
356,5 |
0,70 |
|
|
139 |
1 |
349,5 |
0,29 |
|
|
140 |
2,5 |
314,5 |
0,79 |
|
|
141 |
1,5 |
410,5 |
0,37 |
|
|
142 |
8,5 |
619 |
1,37 |
|
|
143 |
1,5 |
354,5 |
0,42 |
|
|
144 |
5,5 |
559,5 |
0,98 |
|
|
145 |
1,5 |
444 |
0,34 |
|
|
146 |
3 |
437,5 |
0,69 |
|
|
147 |
6 |
473,5 |
1,27 |
|
|
148 |
1,5 |
215,5 |
0,70 |
|
|
149 |
1,5 |
207 |
0,72 |
|
|
150 |
1 |
269 |
0,37 |
|
|
151 |
1,04 |
406 |
0,26 |
|
|
152 |
4,48 |
411,5 |
1,09 |
|
|
153 |
1,91 |
518 |
0,37 |
|
|
154 |
0,63 |
540 |
0,12 |
|
|
155 |
5,9 |
605,5 |
0,97 |
|
|
156 |
2,54 |
631 |
0,40 |
|
|
157 |
4,81 |
381 |
1,26 |
|
|
158 |
4,02 |
409,5 |
0,98 |
|
|
159 |
2,89 |
497,5 |
0,58 |
|
|
160 |
3,35 |
582 |
0,58 |
|
|
161 |
2,88 |
611 |
0,47 |
|
|
162 |
5,01 |
477 |
1,05 |
|
|
163 |
2,72 |
509 |
0,53 |
|
|
164 |
1,55 |
518,5 |
0,30 |
|
|
165 |
1,64 |
468 |
0,35 |
|
|
166 |
4,38 |
620 |
0,71 |
|
|
167 |
3,12 |
494 |
0,63 |
|
|
|
|
|
187,76 |
|
Apêndice 7- Dados de Amostagem biológica
|
Nome do barco: |
Mês: Julho (2019) |
|||||||||
|
Arte de pesca: Cerco |
Captura Total: |
|||||||||
|
Local de pesca: |
Hora da captura: |
|||||||||
|
Espécie: Scomber colias |
Peso da amostra (kg): 31,5 |
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
1 |
39 |
561 |
F |
3 |
3 |
12,50 |
12,49 |
6,17 |
6,92 |
499 |
|
2 |
41,3 |
632 |
M |
4 |
0 |
29,60 |
6,12 |
4,51 |
6,12 |
563 |
|
3 |
40 |
586 |
F |
3 |
0 |
10,83 |
8,18 |
6,40 |
5,80 |
526 |
|
4 |
39,6 |
511 |
M |
2 |
3 |
9,57 |
15,68 |
5,274 |
9,28 |
448 |
|
5 |
43,5 |
794 |
F |
5 |
3 |
59,11 |
15,419 |
12,368 |
9,94 |
655 |
|
6 |
42 |
624 |
M |
4 |
3 |
5,423 |
8,757 |
6,562 |
6,30 |
573 |
|
7 |
40,8 |
648 |
F |
4 |
2 |
23,719 |
8,114 |
3,74 |
5,69 |
448 |
|
8 |
39,1 |
547 |
M |
2 |
3 |
34,40 |
8,84 |
8,28 |
4,56 |
585 |
|
9 |
41,2 |
654 |
F |
4 |
4 |
15,82 |
12,77 |
9,72 |
6,15 |
652 |
|
10 |
42,8 |
746 |
F |
5 |
1 |
33,145 |
18,64 |
7,35 |
7,33 |
592 |
|
11 |
41,7 |
643 |
M |
6 |
3 |
5,96 |
8,22 |
2,97 |
7,28 |
519 |
|
12 |
40 |
623 |
M |
4 |
3 |
44,78 |
12,57 |
3,89 |
4,50 |
604 |
|
13 |
42,5 |
664 |
F |
5 |
3 |
20,69 |
15,37 |
5,22 |
8,73 |
528 |
|
14 |
42,3 |
608 |
M |
6 |
4 |
2,38 |
48,88 |
4,55 |
9,56 |
527 |
|
15 |
40,7 |
669 |
M |
6 |
0 |
9,03 |
5,79 |
2,11 |
5,79 |
571 |
|
16 |
33,4 |
335 |
M |
4 |
2 |
34,47 |
11,30 |
6,88 |
5,10 |
306 |
|
17 |
40,9 |
577 |
F |
6 |
2 |
5,73 |
9,86 |
6,49 |
8,51 |
503 |
|
18 |
45 |
869 |
F |
4 |
3 |
37,46 |
17,53 |
8,83 |
10,76 |
744 |
|
19 |
37,3 |
462 |
M |
5 |
2 |
28,98 |
7,77 |
3,72 |
6,33 |
398 |
|
20 |
42,2 |
655 |
F |
4 |
3 |
13,22 |
17,76 |
6,32 |
9,28 |
584 |
|
21 |
41,5 |
675 |
F |
3 |
2 |
12,82 |
13,60 |
6,82 |
4,49 |
581 |
|
22 |
41,3 |
672 |
F |
4 |
2 |
29,03 |
10,22 |
8,36 |
3,37 |
593 |
|
23 |
43,5 |
741 |
M |
4 |
1 |
23,05 |
22,61 |
6,49 |
12,13 |
573 |
|
24 |
43,5 |
710 |
F |
6 |
2 |
6,36 |
27,65 |
5,01 |
10,15 |
582 |
|
25 |
43,5 |
708 |
F |
6 |
3 |
5,63 |
16,02 |
6,08 |
11,33 |
541 |
|
26 |
37,4 |
533 |
F |
5 |
1 |
36,98 |
7,19 |
4,39 |
5,68 |
466 |
|
27 |
40,8 |
614 |
F |
4 |
3 |
23,05 |
13,46 |
7,27 |
4,02 |
539 |
|
28 |
34,6 |
380 |
M |
4 |
3 |
18,29 |
7,19 |
3,10 |
6,63 |
350 |
|
29 |
38,5 |
507 |
F |
4 |
2 |
21,33 |
9,59 |
4,42 |
8,55 |
452 |
|
30 |
40,2 |
604 |
F |
5 |
3 |
13,89 |
17,36 |
6,30 |
9,04 |
330 |
|
Agosto |
Peso da amostra (kg): 8,071 |
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
31 |
39 |
411 |
M |
3 |
3 |
31,42 |
7,45 |
3,55 |
3,08 |
350 |
|
32 |
36 |
344 |
F |
4 |
3 |
12,80 |
6,32 |
1,26 |
2,42 |
307 |
|
33 |
37 |
414 |
F |
4 |
3 |
24,0 |
8,42 |
5,24 |
2,06 |
357 |
|
34 |
39 |
568 |
F |
4 |
3 |
30,49 |
14,13 |
10,47 |
4,66 |
492 |
|
35 |
34,5 |
411 |
F |
3 |
3 |
17,48 |
8,66 |
7,93 |
2,52 |
359 |
|
36 |
34 |
356 |
F |
5 |
2 |
17,18 |
5,65 |
8,04 |
2,17 |
313 |
|
37 |
38,8 |
470 |
F |
5 |
4 |
23,88 |
26,44 |
4,19 |
4,41 |
392 |
|
38 |
36,3 |
428 |
F |
2 |
3 |
11,96 |
13,06 |
6,49 |
3,51 |
378 |
|
39 |
34,4 |
380 |
M |
5 |
1 |
27,38 |
43,58 |
3,93 |
2,43 |
332 |
|
40 |
37,3 |
514 |
F |
3 |
3 |
16,41 |
14,90 |
7,66 |
3,08 |
453 |
|
41 |
37,9 |
532 |
M |
5 |
3 |
46,10 |
17,16 |
7,16 |
2,92 |
440 |
|
42 |
37,9 |
522 |
F |
4 |
4 |
31,37 |
13,95 |
10,23 |
4,40 |
447 |
|
43 |
41,5 |
641 |
F |
5 |
3 |
28,26 |
12,11 |
9,17 |
3,22 |
566 |
|
44 |
41,1 |
639 |
M |
5 |
3 |
37,90 |
12,77 |
6,54 |
2,92 |
558 |
|
45 |
41,6 |
719 |
M |
5 |
3 |
50,01 |
16,21 |
7,57 |
|
609 |
|
46 |
42,1 |
722 |
M |
5 |
3 |
27,69 |
19,37 |
7,45 |
3,56 |
633 |
|
Setembro |
Peso da amosta (Kg): 10,6 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
47 |
35 |
396,5 |
F |
3 |
4 |
17 |
12 |
4,5 |
4 |
246,5 |
|
|
48 |
34,5 |
402,5 |
M |
4 |
3 |
35,5 |
8,5 |
2,5 |
2,5 |
336 |
|
|
49 |
34,4 |
399,5 |
M |
4 |
4 |
22,5 |
13 |
3,5 |
3 |
335 |
|
|
50 |
36,5 |
480 |
F |
4 |
3 |
35 |
8 |
7 |
3,5 |
407,5 |
|
|
51 |
36,7 |
495 |
M |
4 |
4 |
49,5 |
11,5 |
4 |
3,5 |
412 |
|
|
52 |
35,5 |
436 |
M |
3 |
3 |
25 |
10 |
3 |
4,5 |
378,5 |
|
|
53 |
36,2 |
461 |
F |
5 |
3 |
26,5 |
12,5 |
5 |
4 |
395 |
|
|
54 |
35 |
424,5 |
F |
5 |
4 |
15,5 |
12,5 |
7 |
4 |
366 |
|
|
55 |
34,5 |
398 |
F |
4 |
3 |
16,5 |
11,5 |
5,5 |
3,5 |
350 |
|
|
56 |
35,4 |
418 |
F |
4 |
3 |
16 |
14,5 |
5,5 |
3 |
359,5 |
|
|
57 |
35,7 |
430,5 |
F |
3 |
3 |
26 |
11 |
6,5 |
3,5 |
368 |
|
|
58 |
35,7 |
435 |
M |
5 |
3 |
40 |
9,5 |
3 |
3,5 |
362 |
|
|
59 |
35,5 |
433,5 |
M |
4 |
4 |
25 |
14 |
4 |
4 |
364,5 |
|
|
60 |
34,2 |
436 |
M |
4 |
4 |
35 |
12,5 |
4 |
3,5 |
366 |
|
|
61 |
34,7 |
434 |
F |
4 |
4 |
23,5 |
14 |
6,5 |
4,5 |
368 |
|
|
62 |
36,4 |
480 |
F |
4 |
4 |
26 |
10 |
8 |
4 |
310 |
|
|
63 |
35,5 |
470,5 |
M |
4 |
4 |
46 |
11,5 |
3,5 |
4 |
398 |
|
|
64 |
33,5 |
391,5 |
M |
3 |
3 |
17,5 |
9,5 |
3,5 |
2,5 |
342 |
|
|
65 |
33,8 |
262 |
M |
4 |
4 |
23,5 |
14,5 |
2,5 |
3 |
380 |
|
|
66 |
34,2 |
411 |
F |
4 |
4 |
11 |
10,5 |
6,5 |
3 |
360 |
|
|
67 |
36 |
473,5 |
M |
3 |
3 |
29 |
13,5 |
4 |
4 |
403 |
|
|
68 |
34,9 |
435 |
M |
3 |
4 |
37 |
13 |
4 |
3,5 |
364 |
|
|
Outubro |
Peso da amosta (Kg): 9 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
69 |
35,9 |
493,5 |
M |
5 |
4 |
63 |
8,5 |
3,5 |
4 |
397 |
|
|
70 |
36 |
496 |
M |
5 |
3 |
43 |
12 |
4,5 |
4,5 |
416 |
|
|
71 |
34,5 |
590,5 |
F |
5 |
5 |
60 |
8 |
8,5 |
5 |
493 |
|
|
72 |
36 |
458 |
M |
5 |
2 |
58 |
11 |
3,5 |
3,5 |
362,5 |
|
|
73 |
36,7 |
486 |
F |
5 |
3 |
37 |
8,5 |
7 |
5 |
416 |
|
|
74 |
37 |
522,5 |
M |
5 |
3 |
59 |
11,5 |
5 |
4 |
423,5 |
|
|
75 |
37,4 |
492 |
M |
5 |
1 |
58 |
8,5 |
4 |
4 |
395 |
|
|
76 |
35,5 |
434,5 |
F |
3 |
3 |
20 |
11,5 |
6,5 |
3,5 |
375 |
|
|
77 |
36,5 |
507 |
M |
3 |
4 |
36,5 |
12,5 |
4,5 |
4 |
436 |
|
|
78 |
35,5 |
484 |
M |
4 |
3 |
65 |
6,5 |
4 |
3,5 |
387 |
|
|
79 |
37,5 |
544 |
M |
5 |
3 |
66 |
7 |
4 |
4 |
440 |
|
|
80 |
36,5 |
532 |
F |
5 |
3 |
76,5 |
9,5 |
7,5 |
4 |
422 |
|
|
81 |
36,2 |
480 |
F |
3 |
1 |
33,5 |
8 |
8 |
4 |
410 |
|
|
82 |
36,5 |
557 |
M |
5 |
3 |
29 |
16 |
6,5 |
4,5 |
476,5 |
|
|
83 |
35,5 |
431 |
F |
3 |
2 |
32 |
8 |
7 |
3 |
362 |
|
|
84 |
35,2 |
445,5 |
F |
4 |
3 |
35,5 |
7,5 |
6 |
3,5 |
377,5 |
|
|
85 |
37,9 |
563,5 |
F |
5 |
4 |
51 |
10 |
8 |
4,5 |
471 |
|
|
86 |
35,5 |
469,5 |
M |
5 |
3 |
55 |
11,5 |
4,5 |
3,5 |
378 |
|
|
87 |
37,2 |
528,5 |
F |
4 |
3 |
44,5 |
11 |
8,5 |
5 |
442 |
|
|
88 |
33,5 |
372 |
F |
3 |
3 |
20,5 |
10,5 |
5 |
3 |
318 |
|
|
Novembro |
Peso da amosta (Kg): 7,24 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
89 |
30,5 |
247 |
M |
1 |
4 |
0,3 |
7,10 |
1,73 |
2,92 |
229 |
|
|
90 |
30 |
256 |
Ind. |
Ind. |
2 |
Ind. |
6,04 |
3,21 |
2,64 |
234,5 |
|
|
91 |
31 |
272 |
F |
1 |
1 |
0,8 |
4,62 |
3,12 |
3,26 |
251 |
|
|
92 |
33 |
345 |
M |
1 |
2 |
1,39 |
6,93 |
4,10 |
3,37 |
316 |
|
|
93 |
32 |
311,5 |
Ind. |
Ind. |
3 |
Ind. |
5,75 |
3,43 |
3,43 |
280 |
|
|
94 |
32,8 |
353,5 |
F |
1 |
1 |
1,39 |
5,56 |
4,50 |
3,97 |
326 |
|
|
95 |
33,5 |
379 |
M |
2 |
4 |
2,49 |
8,17 |
4,27 |
3,92 |
346 |
|
|
96 |
32,5 |
331 |
Ind. |
Ind. |
1 |
1 |
5,44 |
4,13 |
4,49 |
303 |
|
|
97 |
31 |
282 |
F |
1 |
1 |
1,53 |
6,47 |
4,5 |
4,35 |
253 |
|
|
98 |
31,8 |
306,5 |
F |
Ind. |
1 |
0,1 |
7,18 |
3,95 |
2,95 |
276 |
|
|
99 |
34 |
460,5 |
F |
6 |
2 |
2,40 |
5,99 |
5,70 |
4,62 |
423,5 |
|
|
100 |
34,5 |
465,5 |
F |
2 |
3 |
1,63 |
9,02 |
6,68 |
4,78 |
425,5 |
|
|
101 |
34 |
451,5 |
F |
2 |
3 |
2,18 |
6,09 |
6,26 |
3,41 |
419,5 |
|
|
102 |
34 |
393,5 |
F |
6 |
3 |
2,1 |
5,02 |
4,96 |
3,21 |
364,5 |
|
|
103 |
34,4 |
441,5 |
F |
6 |
2 |
3,22 |
5,69 |
5,48 |
3,74 |
404 |
|
|
104 |
34,5 |
423 |
F |
2 |
2 |
2,27 |
6,23 |
7,73 |
3 |
381,5 |
|
|
105 |
31,4 |
293 |
F |
1 |
2 |
0,89 |
5,41 |
2,89 |
4,48 |
268,5 |
|
|
106 |
34,2 |
401,5 |
F |
2 |
2 |
1,85 |
6,03 |
5,13 |
3,5 |
371,5 |
|
|
107 |
34,4 |
422,5 |
M |
2 |
3 |
1,18 |
9,41 |
6,66 |
4,59 |
387,5 |
|
|
108 |
34 |
403 |
F |
2 |
3 |
0,46 |
7,37 |
5,33 |
4,52 |
368,5 |
|
|
Dezembro |
Peso da amosta (Kg): 7,5 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
109 |
32,5 |
342,5 |
F |
6 |
3 |
1,97 |
6,01 |
4,18 |
3,53 |
313 |
|
|
110 |
31 |
302 |
F |
6 |
3 |
1,54 |
5,76 |
4,03 |
3,2 |
278 |
|
|
111 |
35 |
447 |
F |
6 |
2 |
1,42 |
5,08 |
7,26 |
2,79 |
404,5 |
|
|
112 |
32 |
326 |
Ind. |
|
3 |
0,91 |
5,37 |
3,26 |
2,96 |
229 |
|
|
113 |
35 |
442,5 |
M |
2 |
2 |
1,32 |
5,01 |
4,54 |
3,1 |
414 |
|
|
114 |
31 |
301 |
F |
2 |
2 |
2,66 |
4,19 |
3,98 |
3,19 |
276 |
|
|
115 |
35,5 |
467 |
F |
2 |
1 |
3,23 |
7,35 |
5,98 |
5,11 |
426,5 |
|
|
116 |
34 |
328,5 |
M |
2 |
2 |
0,88 |
4,29 |
3,67 |
2,58 |
354,5 |
|
|
117 |
33,5 |
397 |
F |
6 |
2 |
2,09 |
4,99 |
5,85 |
3,26 |
362,5 |
|
|
118 |
31,5 |
294,5 |
M |
2 |
2 |
1,56 |
4,07 |
3,98 |
3,31 |
269,5 |
|
|
119 |
33 |
344 |
M |
2 |
3 |
1,36 |
5,25 |
5,06 |
2,79 |
318 |
|
|
120 |
33 |
380 |
M |
4 |
2 |
1,71 |
5,75 |
4,43 |
3,83 |
348,5 |
|
|
121 |
34 |
439,5 |
F |
3 |
2 |
2,46 |
6,81 |
5,55 |
2,96 |
404,5 |
|
|
122 |
34,5 |
386,5 |
M |
2 |
3 |
2,62 |
5,43 |
4,99 |
2,65 |
353,5 |
|
|
123 |
33 |
330 |
F |
3 |
1 |
0,77 |
4,15 |
4,80 |
3,05 |
300,5 |
|
|
124 |
35 |
454,5 |
M |
3 |
2 |
3,64 |
5,44 |
6,40 |
4,29 |
420,5 |
|
|
125 |
31,7 |
315,5 |
M |
2 |
2 |
1,46 |
4,90 |
2,18 |
2,49 |
290 |
|
|
126 |
32,5 |
344 |
F |
3 |
2 |
1,48 |
4,35 |
4,18 |
2,87 |
319 |
|
|
127 |
33 |
373 |
M |
3 |
2 |
1,15 |
5,88 |
4,32 |
3,47 |
345,5 |
|
|
128 |
33 |
380 |
M |
2 |
2 |
2,51 |
5,57 |
6,69 |
4,40 |
346,5 |
|
|
129 |
35 |
477 |
F |
4 |
2 |
3,64 |
7,81 |
6,74 |
3,9 |
437,5 |
|
|
Janeiro (2020) |
Peso da amosta (Kg): 7,5 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
130 |
34,5 |
394,5 |
M |
2 |
3 |
3 |
11,5 |
4 |
5 |
358,5 |
|
|
131 |
32 |
268 |
F |
2 |
3 |
1,5 |
5 |
2,5 |
3,5 |
246 |
|
|
132 |
34,5 |
381,5 |
F |
2 |
2 |
2,5 |
6,5 |
4 |
3,5 |
353 |
|
|
133 |
30 |
252 |
Ind. |
|
1 |
|
4 |
2,5 |
2,5 |
235,5 |
|
|
134 |
29,5 |
236,5 |
Ind. |
1 |
1 |
0,38 |
4,5 |
2,5 |
2,5 |
220,5 |
|
|
135 |
32,5 |
338 |
M |
2 |
1 |
0,36 |
6 |
3,5 |
4 |
313,5 |
|
|
136 |
34,5 |
422 |
F |
2 |
1 |
1,82 |
7 |
5 |
4,5 |
391 |
|
|
137 |
33,5 |
372 |
F |
2 |
2 |
2,05 |
5 |
3 |
3,5 |
344 |
|
|
138 |
34 |
356,5 |
M |
2 |
3 |
2,83 |
5,5 |
2 |
3 |
329,5 |
|
|
139 |
33 |
349,5 |
F |
2 |
1 |
1,92 |
4,5 |
3 |
3,5 |
326 |
|
|
140 |
32 |
314,5 |
F |
2 |
2 |
0,82 |
5 |
4,5 |
2,5 |
289,5 |
|
|
141 |
35 |
410,5 |
M |
2 |
2 |
3,03 |
5 |
4 |
3,5 |
383 |
|
|
142 |
38,5 |
619 |
M |
6 |
4 |
3,13 |
14,5 |
9 |
6 |
563 |
|
|
143 |
33 |
354,5 |
F |
2 |
3 |
1,25 |
4,5 |
4 |
3 |
330 |
|
|
144 |
38 |
559,5 |
M |
6 |
4 |
3,82 |
9 |
6 |
3,5 |
514,5 |
|
|
145 |
35,5 |
444 |
F |
3 |
1 |
4,25 |
5 |
4,5 |
3,5 |
415 |
|
|
146 |
35 |
434,5 |
F |
2 |
1 |
2,28 |
6,5 |
4,5 |
3,5 |
407 |
|
|
147 |
35,5 |
473,5 |
M |
3 |
3 |
5,44 |
10 |
5 |
4 |
440,5 |
|
|
148 |
28,5 |
215,5 |
Ind. |
|
2 |
|
3,5 |
2 |
2 |
196,5 |
|
|
149 |
28 |
207 |
Ind. |
1 |
3 |
|
3,5 |
1 |
2 |
194 |
|
|
150 |
30 |
269 |
F |
|
2 |
1,00 |
3,5 |
2,5 |
2,5 |
247 |
|
|
Fevereiro (2020) |
Peso da amosta (Kg): 8,68 |
|
|||||||||
|
Nº Ident. |
TL (cm) |
W (g) |
Sexo |
Est. Mat |
Grau Ench. |
W (gónadas) |
W. Est. (cheio) |
W. Fíg. |
W. Est. (vazio) |
W. Evisc. |
|
|
151 |
34 |
406 |
M |
2 |
2 |
1,5 |
5,82 |
5,40 |
4,78 |
378,5 |
|
|
152 |
33,5 |
411,5 |
F |
2 |
2 |
2,17 |
9,30 |
4,78 |
4,82 |
380 |
|
|
153 |
36 |
518 |
F |
2 |
2 |
3,25 |
6,42 |
5,37 |
4,51 |
485 |
|
|
154 |
37 |
540 |
F |
3 |
1 |
3,62 |
6,53 |
5,98 |
5,90 |
502 |
|
|
155 |
37,5 |
605,5 |
F |
2 |
3 |
3,70 |
12,11 |
7,77 |
6,21 |
592,5 |
|
|
156 |
38,4 |
631 |
M |
2 |
0 |
3,16 |
7,66 |
9,64 |
5,13 |
583,5 |
|
|
157 |
34,3 |
381 |
M |
1 |
4 |
0,68 |
10,31 |
4,79 |
5,50 |
355,5 |
|
|
158 |
34,5 |
409,5 |
M |
2 |
3 |
1,80 |
9,26 |
4,43 |
5,24 |
376,5 |
|
|
159 |
36,4 |
497,5 |
M |
2 |
2 |
1,71 |
7,66 |
6,43 |
4,77 |
463 |
|
|
160 |
37,4 |
582 |
M |
2 |
1 |
1,83 |
9,86 |
1,57 |
6,51 |
537 |
|
|
161 |
37,5 |
611 |
F |
2 |
1 |
3,07 |
7,67 |
6,78 |
4,79 |
560,5 |
|
|
162 |
35,5 |
477 |
M |
2 |
2 |
1,85 |
10,55 |
6,21 |
5,54 |
441 |
|
|
163 |
37,2 |
509 |
F |
2 |
1 |
2,55 |
7,86 |
5,39 |
5,12 |
470,5 |
|
|
164 |
35,5 |
518,5 |
F |
2 |
1 |
3,32 |
6,45 |
9,18 |
4,90 |
457 |
|
|
165 |
35,5 |
468 |
F |
2 |
2 |
4,31 |
6,53 |
5,13 |
4,89 |
437,5 |
|
|
166 |
38,4 |
620 |
F |
1 |
2 |
0,48 |
10,88 |
9,09 |
6,50 |
554 |
|
|
167 |
36,5 |
494 |
F |
2 |
1 |
2,212 |
8,24 |
6,60 |
5,12 |
460,5 |
|
Publicado por: José Lázaro Tchivela Calueio
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.