Germinação de Sementes de Dyckia cf. espiritosantensis (Bromeliaceae) em função de temperatura, envelhecimento acelerado e luz
índice
- 1. RESUMO
- 2. ABSTRACT
- 3. INTRODUÇÃO
- 4. REFERENCIAL TEÓRICO
- 5. MATERIAL E MÉTODOS
- 6. RESULTADOS E DISCUSSÃO
- 7. CONCLUSÕES
- 8. REFERÊNCIAS BIBLIOGRÁFICAS
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.
1. RESUMO
Espécie rupícola da família Bromeliaceae (Dyckia cf. espiritosantensis) ocorre naturalmente na vegetação de Cerrado do Parque Estadual da Serra Azul em Barra do Garças-MT. O presente trabalho teve como objetivo estudar o comportamento germinativo das sementes da espécie em diferentes temperaturas, na presença e ausência de luz e após o processo de envelhecimento acelerado. Para tal, sementes de D. cf. espiritosantensis foram coletadas a partir de uma população natural e armazenadas em recipientes plásticos à temperatura ambiente, durante 14 meses. Para a realização de todos os testes foram selecionadas sementes intactas, as quais foram dispostas para germinar em caixas plásticas tipo Gerbox® sobre papel mata-borrão, previamente esterilizado em autoclave. A comparação entre tratamentos na estatística paramétrica foi realizada pelo teste de Scott-Knott, e na estatística não-paramétrica pelo teste U de Mann-Whitney, em ambos a 5% de probabilidade. Com os resultados obtidos foi possível afirmar que o teste de germinação de D. cf. espiritosantensis realizado na temperatura constante de 30°C pode ser encerrado no vigésimo dia após a instalação do experimento. O tratamento em temperaturas alternadas de 25/15°C obteve o maior índice de germinação, porém foi o mais lento dentre as temperaturas testadas e a menor germinação foi obtida a 40°C, entretanto não foi possível estabelecer temperatura ótima para germinação. As sementes de D. cf. espiritosantensis mostraram-se indiferentes a luz para a germinação e perderam vigor no teste de envelhecimento acelerado, quando comparadas ao controle. No entanto, as sementes que foram expostas a umidade apresentaram um início de germinação mais precoce.
Palavras-chave: Cerrado, tecnologia de sementes, bromélias, qualidade fisiológica
2. ABSTRACT
Dyckia cf. espiritosantensis is a rupicolous species of the Bromeliaceae family and naturally occurs in the Cerrado (tropical savanna ecorregion) vegetation of The Serra Azul State Park, Barra do Garças, Mato Grosso, Brazil. This study aimed to investigate the seed germination behavior of this species in alternating temperatures, in absence and presence of light, and after the accelerated aging test. For these experiments, seeds of D. cf. espiritosantensis were collected from natural stands, stored in plastic containers and kept at room temperature for 14 months. All the tests were performed utilizing Gearbox® type plastic boxes and autoclaved blotting papers. The Scott-Knott (parametric statistics) and the Mann-Whitney U (nonparametric statistics) tests were used to compare treatments, both significant at 5% of probability. According to the results, the seed germination test performed at 30 degrees Celsius could be finished twenty days after the experiment installation. The treatment with alternating temperatures of 25 degrees and 15 degrees Celsius had the higher germination rating, but had the lower germination speed; and the treatment at 40 degrees Celsius had the lower germination rating among the treatments tested. Because of these results it was not possible to establish the optimal temperature for seed germination. For the germination process, seeds of D. cf. espiritosantensis were indifferent to the light. It was found that the seeds submitted to the accelerated aging test lost vigor, when compared to those that were not submitted to this test. On the other hand, seeds that were exposed to moisture started the germination process earlier than the seeds that were not exposed.
Keywords: Seed technology, bromeliads, physiological seed quality, tropical savanna
3. INTRODUÇÃO
A família Bromeliaceae apresenta cerca de 3.000 espécies divididas em 58 gêneros (LUTHER, 2008). Muitas espécies de bromélias possuem interesse comercial devido principalmente à rusticidade e às características ornamentais. São plantas oriundas exclusivamente do continente americano, sendo apenas uma espécie descrita como de origem africana. Podem ser encontradas no Brasil mais da metade das espécies catalogadas (PAULA; SILVA, 2004). Bromélias são importantes para a comunidade como um todo, principalmente pela capacidade de armazenar água em sua roseta fechada, o que as torna elementos importantes para a ampliação da diversidade do hábitat. Por esta característica, diversas espécies animais utilizam a água contida no tanque das bromélias para alimentação, reprodução e refúgio contra predadores (ROCHA et al., 1997).
As bromélias são valorizadas devido às suas características ornamentais e potencial comercial. A folhagem típica e as inflorescências vistosas são responsáveis por sua beleza. É sabido que as bromélias se adaptam bem a ambientes internos em climas temperados, requerendo poucas práticas de manejo (RODRIGUEZ, 2005). Além disso, as bromélias podem ser utilizadas no paisagismo para composição de ambientes xéricos, que resultam em jardins com baixo consumo de água (NEGRELLE; MITCHELL; ANACLETO, 2012).
A família Bromeliaceae é dividida em três subfamílias tendo como base suas características botânicas: Pitcarnioideae, Bromelioideae e Tillandsioideae. São encontradas no Cerrado, aproximadamente, 17 gêneros sendo que o gênero Dyckia é um dos mais abundantes (MIRANDA, 2001).
O gênero Dyckia, pertencente a subfamília Pitcairnioideae, possui aproximadamente 130 espécies e 7 variedades botânicas. Como características descritivas, são espécies rupícolas e heliófilas, apresentam roseta foliar aberta, ou seja, sem tanque. Apresentam folhas suculentas com grande quantidade de espinhos rígidos, raízes funcionais e escamas foliares pouco eficientes na absorção de água e nutrientes (PAULA; SILVA, 2004). Plantas desse gênero são observadas em ambientes xéricos: afloramentos rochosos areníticos, basálticos e calcáreos; canga, cascalheiras e restingas. Multiplicam-se pela divisão do caule principal, pela produção de estolões e por sementes. Observou-se que poucas espécies possuem crescimento monopodial, isto é, não dividem o caule principal (KRANZ, 2013).
A espécie utilizada no presente trabalho assemelha-se a Dyckia espiritosantensis Leme & A.P. Fontana, que foi descrita pela primeira vez no estado do Espírito Santo e se apresenta como uma planta rupícola, podendo ser encontrada em regiões de Cerrado e floresta tropical com sistema de propagação tanto por meio vegetativo como por sementes (LEME et al., 2010).
Devido à necessidade de recuperar áreas degradadas e recompor a paisagem natural tem se intensificado o interesse em se propagar espécies nativas. Todavia, é restrito o conhecimento disponível para o manejo e análise das sementes da maioria das espécies de modo a caracterizar seus atributos físicos e fisiológicos. Além disso, é de suma importância a obtenção de informações básicas sobre a germinação, o cultivo e as potencialidades dessas espécies, visando sua utilização para os mais diversos fins (POMPELLI, 2006).
Os principais fatores ambientais que afetam a germinação de sementes desde que haja disponibilidade adequada de água e oxigênio são a temperatura e a luz. Para um grande número de espécies vegetais, quando são fornecidas condições adequadas de luz e umidade, a temperatura predominante é o fator que determina a velocidade e a porcentagem de germinação (ANDRADE, 1995). A temperatura tem como característica afetar a germinação e induzir a dormência de sementes. Os dados de temperaturas médias da germinação de sementes tem a função de contribuir para explicar muitas particularidades biogeográficas de espécies neotrópicas (BORGHETTI, 2005). Seguindo esse conceito, estudos da germinação de sementes são importantes para fornecer não apenas informações relevantes à tecnologia de sementes como também para a compreensão da ecofisiologia das espécies vegetais (BORGHETTI; FERREIRA, 2004).
No tocante ao comportamento germinativo de espécies sensíveis à luz, encontram-se sementes que germinam somente após rápida exposição à luz; outras que necessitam de período amplo de exposição, outras em que a germinação é desencadeada somente no escuro e sementes que são indiferentes à luz (ARAÚJO NETO; AGUIAR; FERREIRA, 2003).
Altas temperaturas e umidade durante o armazenamento das sementes contribuem para a sua deterioração, por promoverem alterações degenerativas como a desestabilização nas atividades de enzimas e a desestruturação e perda de integridade do sistema de membranas celulares, causada, principalmente, pela peroxidação de lipídios. Tais condições podem ser simuladas em laboratório e essa técnica é denominada envelhecimento acelerado (VIEIRA; SOCOLOWSKI; TAKAKI, 2007).
Levando em consideração a importância da manutenção da biodiversidade do cerrado e a necessidade de fornecer subsídios para a tecnologia de sementes e preservação das espécies oriundas desse bioma, o presente estudo teve como objetivo estudar o comportamento germinativo das sementes de Dyckia cf. espiritosantensis em diferentes temperaturas, na presença e ausência de luz e após o processo de envelhecimento acelerado.
4. REFERENCIAL TEÓRICO
O Cerrado brasileiro ocupa aproximadamente 12% do território nacional, abrigando cerca de 33% da diversidade biológica do país, sendo considerado o segundo maior e um dos mais diversos biomas do Brasil (AGUIAR; MACHADO; MARCOS FILHO, 2004). Baseado em imagens de satélite, estima-se que a área remanescente de vegetação nativa do Cerrado é de aproximadamente 46,74% (BRASIL, 2007). O modelo de ocupação que ocorre na região Centro Oeste, onde se converte grandes extensões de vegetação nativa em pastagens e cultivos de monocultura foram fatores contribuintes para que o Cerrado se tornasse um dos biomas mais ameaçados (KLINK; MACHADO, 2005). Esse modelo de ocupação traz uma grande preocupação devido ao fato de que o Cerrado trata-se da savana floristicamente mais rica do mundo em biodiversidade (WALTER, 2006). A elevada riqueza de espécies, o alto grau de endemismo e a intensa destruição de habitats colocam o Cerrado brasileiro na lista das áreas prioritárias à conservação da biodiversidade (MITTERMEIER et al., 2005).
O Cerrado é um bioma composto por três formações: florestais, que apresentam a formação de dossel contínuo ou descontínuo; savânicas, com a presença de árvores e arbustos espalhados sobre um estrato graminoso, sem a formação de dossel contínuo; e campestre, que engloba áreas com o predomínio de espécies herbáceas e algumas arbustivas, mas sem a presença de árvores na paisagem (RIBEIRO; WALTER, 2008). O Cerrado também pode ser classificado em função da sua fitofisionomia, sendo elas, Cerrado denso, típico, ralo e rupestre. Os três primeiros são diferenciados pela densidade do estrato lenhoso, sendo crescente do Cerrado ralo ao denso, enquanto o Cerrado rupestre ocorre em solos rasos e com afloramentos rochosos, denominados de ambientes rupestres. Nesses ambientes, a vegetação lenhosa se estabelece nas fendas e nos degraus formados entre as rochas onde há acúmulo de solo e microsítios para o estabelecimento das plantas (GIULIETTI et al., 2000).
Os ambientes rupestres apresentam uma flora bastante rica e diversificada (HARLEY, 1995) e um número considerável de espécies raras, principalmente no componente herbáceo-arbustivo (VITTA, 2002), além disso, devido à grande quantidade de rochas e a pouca profundidade do solo, esse ambiente exerce uma pressão que atua como fator seletivo sobre o desenvolvimento e estabelecimento de plantas (FELFILI; FAGG, 2007), o que pode resultar em uma vegetação com um padrão estrutural característico desses ambientes. Esses ambientes ocupam aproximadamente 7% da área do Cerrado (REATTO; CORREIA; SPERA, 2008).
No ambiente rupestre algumas famílias botânicas adaptam-se melhor, dentre elas Bromeliaceae, Cactaceae, Velloziaceae e Xyridaceae (RAPINI et al., 2008).
A família Bromeliaceae é composta por 58 gêneros e aproximadamente 3.000 espécies, sendo constituída geralmente de plantas herbáceas, terrestres, saxícolas ou epífitas. As espécies são encontradas em uma grande variedade de hábitats desde de florestas úmidas até sobre rochas nuas. As mesófitas são geralmente epífitas, colonizando o dossel de árvores altas, encontram-se principalmente em ambientes com alta umidade, como em florestas tropicais, possuem eficientes mecanismos adaptativos para captação de água como folhas dispostas em forma de tanque, tricomas foliares que são capazes de absorver água juntamente com nutrientes, pois suas raízes ficam expostas ao ar. Enquanto as xerófitas, geralmente são saxícolas ou rupestres, apresentam metabolismo ácido das crassuláceas (CAM), que consiste na fixação noturna de CO2. Essas plantas são capazes de habitar ambientes secos, como em savanas, campos rupestres e ambientes desérticos (MC WILLIANS, 1974; LINDER; RUDALL, 2005).
A valorização das bromélias se dá em parte devido suas características ornamentais e potencial comercial. A folhagem atrativa com formas características, brácteas florais coloridas e brilhantes (apesar das flores serem pequenas e efêmeras) e inflorescências terminais são responsáveis por sua beleza. As bromélias se adaptam bem a ambientes internos em climas temperados, requerendo poucas práticas de manejo (RODRIGUEZ, 2005).
As bromélias além de suas características ornamentais, desempenham um papel ecológico de suma importância nos ecossistemas naturais. As espécies epífitas são fundamentais no ciclo de nutrientes e de água (COXSON; NADKARNI, 1995), sendo componentes essenciais da biodiversidade de florestas tropicais. Algumas bromélias podem apresentar folhas que se sobrepõem em forma de roseta fechada, que apresentam a capacidade de armazenar água, sendo este reservatório utilizado como habitat para diversos membros da fauna (YANOVIAK; NADKARNI; GERING, 2003) e servindo de fonte de água para um grande número de animais, como por exemplo anfíbios e pássaros (PIZZO,1994).
Segundo Martinelli (2006), Bromeliaceae é uma das famílias mais importantes de monocotiledôneas neotropicais, devido a sua grande riqueza e adaptabilidade aos mais variados nichos. O grupo apresenta grande plasticidade, com a capacidade de se adaptar as mais diversas condições climáticas, mas são extremamente sensíveis a qualquer mudança ou perturbação das condições ambientais, que acabam resultando na alteração das composições de suas populações. As escamas foliares das espécies epifíticas absorvem umidade e nutrientes direto do ambiente (BENZING, 1998). Essa característica permite que as bromeliáceas absorvam poluentes através de suas folhas, comprometendo não apenas o próprio indivíduo, mas toda a diversidade de organismos que dependem de uma dada bromélia (ELIAS et al., 2006).
Além de função ecológica, a família Bromeliaceae possui espécies de importância para o ser humano, dentre elas, o abacaxi (Ananas comosus), podendo-se incluir ainda outros representantes da família na produção de fibras, alimentação humana e animal, como combustível e para fins medicinais (BENNET, 2000).
O Brasil tem uma importância significativa na diversidade de Bromeliaceae possuindo 42 gêneros e cerca de 1.200 espécies, sendo que 85% destes táxons são endêmicos do país. Levando em consideração toda a família, o Brasil detém 72% dos gêneros e 38% das espécies. Bromeliaceae é encontrada em todos os estados brasileiros, mas o domínio da Mata Atlântica abriga a maior riqueza de espécies e endemismos (STEHMANN et al., 2009; FORZZA et al., 2011).
Bromeliaceae constitui a maior família das Angiospermas exclusiva para o continente americano, apresentando uma distribuição quase exclusivamente neotropical, desde o sul da América do Norte, passando pela América Central até chegar a Patagônia na América do Sul (SMITH; DOWNS, 1979), com exceção de apenas uma única espécie, Pitcairnia feliciana (A. Chev.) Harms e Mildbr., que ocorre no Oeste africano (POREMBSKI; BARTHLOTT, 1999). Essa família se encontra tradicionalmente dividida em três subfamílias (Pitcairnioideae, Bromelioideae e Tillandsioideae), tendo como base suas características botânicas (LUTHER, 2008).
Pitcairnioideae são plantas terrestres de folhas espinescentes, frutos secos (cápsulas) e sementes geralmente aladas, como em Dyckia e Hechtia. Estas plantas vivem junto a cactus e agaves, em pleno sol (SMITH; DOWNS, 1974).
Bromelioideae podem ser terrestres ou epífitas, com folhas serrilhadas, denteadas ou com acúleos nas margens; os frutos podem ser secos (cápsulas) ou carnosos (bagas). Pertencem a este grupo Ananas, Bromelia, Aechmea, Nidularium e Cryptanthus, entre outros, cultivados para jardim e para vasos. Algumas formam, com as folhas, um depósito para captação de água, como uma cisterna. As epífitas vivem em matas pluviais ou em ambientes com alta umidade relativa do ar (SMITH; DOWNS, 1979).
Tillandsioideae são em sua maioria epífitas, com folhas de margens lisas, sem espinhos ou dentes; os frutos são secos e as sementes apresentam uma coroa de pelos longos, que as auxiliam na dispersão pelo vento. Em cultivo comercial encontram-se algumas espécies de Tillandsia, bem como variedades de Vriesea e Guzmania (SMITH; DOWNS, 1977).
A subfamília Pitcairnoideae possui 16 gêneros e aproximadamente 1.050 espécies (LUTHER, 2008). Trata-se da família mais primitiva das bromélias e possui semelhanças com as Poaceae, da qual evoluiu. Como características diagnósticas, as plantas pertencentes a este grupo são em sua maioria terrestre, com raízes fibrosas e extensas desenvolvidas para a obtenção de água e nutrientes, além de folhas dispostas em rosetas que não formam tanque (BENZING; BURT, 1970). Crescem em locais de intensa radiação solar, principalmente em solos úmidos, arenosos ou húmicos (MEDINA, 1974). Os frutos são principalmente do tipo cápsulas deiscentes, o ovário pode ser súpero ou ínfero. As sementes apresentam apêndices pequenos podendo ser facilmente transportadas pelo vento (SMITH; DOWNS, 1974). Os gêneros mais importantes dessa são subfamília são: Pitcairnia, com cerca de 320 espécies; Puya, com aproximadamente 190 espécies; Dyckia, apresentando por volta de 130 espécies e Navia com 105 espécies (LUTHER, 2008).
Através de estudos moleculares, o número de subfamílias foi ampliado para oito, sendo essa uma classificação considerada como mais natural: Brocchinioideae, Lindmanioideae, Tillandsioideae, Hechtioideae, Navioideae, Pitcairnioideae, Puyoideae e Bromelioideae (GIVNISH et al., 2011). No trabalho destes autores, foi possível que se confirmasse a monofilia de Tillandsioideae e Bromelioideae e que se resolvesse a parafilia de Pitcairnioideae com inserção de cinco novas subfamílias a partir da mesma. Nos estudos moleculares feitos recentemente, estas oito subfamílias estão bem suportadas, sendo ainda que estes autores sugerem o abandono da classificação tradicional em três subfamílias. O gênero Dyckia permaneceu em Pitcairnioideae.
O gênero Dyckia trata-se do terceiro maior da subfamília, ficando atrás apenas dos gêneros Pticairnia e Puya (LUTHER, 2008). Segundo Martinelli et al. (2008), o gênero Dyckia possui um grande número de espécies indeterminadas ou com identificações imprecisas sugerindo a realização de uma revisão urgente.
As bromélias pertencentes ao gênero Dyckia são terrestres com algumas espécies potencialmente ornamentais (SILVA et al., 2008) tendo sua distribuição em todo o território nacional e em países vizinhos como Argentina, Bolívia, Paraguai e Uruguai (SMITH; DOWNS, 1974). No Brasil são encontradas aproximadamente 83% das espécies, com sua ocorrência desde o nível do mar até aproximadamente 1.000 metros de altitude, geralmente expostas ao sol. As espécies podem ser encontradas nos biomas de Cerrado, Mata Atlântica e Caatinga. Apresentam-se de forma individual quando dispersas pelas sementes, ou formando agrupamentos de alta densidade como consequência da propagação feita por clones. São principalmente terrestres ou rupícolas e crescem em solos bem drenados ou afloramentos rochosos. Algumas espécies possuem a capacidade de sobreviver em ambientes frequentemente inundados (LEME; RIBEIRO; MIRANDA, 2012).
Representantes do gênero Dyckia apresentam em geral folhas coriáceas e suculentas, com frequente desenvolvimento de acúleos marginais. As inflorescências laterais racemosas, simples ou ramificadas, mostram flores de coloração principalmente vermelha, laranja ou amarela, sendo que já foi observada coloração castanho avermelhada em algumas espécies (FORZZA; WANDERLEY, 1998; LEME; RIBEIRO; MIRANDA, 2012).
De acordo com Givnish et al. (2011), com base em análises moleculares, o gênero Dyckia é monofilético. Estudos filogenéticos específicos reforçam essa ideia (LEME; RIBEIRO; MIRANDA, 2012), tornando evidente que a dispersão na maioria das espécies do gênero é recente o que possivelmente explica a dificuldade em se distinguir características morfológicas que são empregadas em estudos taxonômicos na diferenciação de espécies de Dyckia (SALOMÃO, 2013).
Dyckia espiritosantensis é uma espécie que cresce principalmente sobre solos rasos, no topo de regiões montanhosas, apresentando inflorescência de cerca de 105 centímetros de altura, com plantas distribuídas próximas umas das outras, sob exposição direta de luz solar ou em ambientes sombreados, podendo ser propagadas por sementes e também de forma vegetativa. Foi descoberta primeiramente no Estado do Espírito Santo, sendo morfologicamente semelhante as espécies D. mello-barretoi e D. martinelli diferenciando destas principalmente por possuir acúleos menores e folhas mais finas (LEME et al., 2010).
As flores da espécie estudada neste trabalho e coletadas no Parque Estadual da Serra Azul em Barra do Garças-MT, tem as mesmas características das flores de D. espiritosantensis, diferindo desta no tamanho e na distância entre os acúleos foliares. A confirmação da identidade da espécie será realizada por especialista. Não foi encontrada bibliografia que tratasse da germinação desta espécie.
Nos últimos anos, o interesse na propagação de espécies nativas tem se intensificado, fato esse, justificado pela acentuada importância dada aos problemas ambientais, enfatizando-se a necessidade de recuperação de áreas degradadas. Entretanto, conhecimentos sobre o manejo e análise das sementes nativas para identificação de seus atributos físicos e fisiológicos ainda são limitados (POMPELLI, 2006). Dentro deste contexto, estudos de germinação de Dyckia foram realizados para D. enchleroides, D. goehringii, D. tuberosa, dentre outras poucas espécies, (POMPELLI, 2006; VIEIRA; SOCOLOWSKI; TAKAKI, 2007; DUARTE et al., 2010).
O processo germinativo compreende aqueles eventos celulares e metabólicos que se iniciam com a absorção de água por sementes quiescentes e culminam com o alongamento do eixo embrionário (COME; TISSAOUI, 1973; BEWLEY; BLACK, 1994; EGLEY, 1999).
Todavia, em tecnologia de sementes, a conceituação de germinação tem um cunho mais prático, incluindo a fase de crescimento inicial da plântula neste processo. Como resultado, a germinação de sementes em teste de laboratório é a emergência das estruturas essenciais do embrião, demonstrando a sua aptidão para produzir uma planta normal sob condições favoráveis de campo (BRASIL, 2009).
Segundo Machado (2002), a porcentagem de plântulas normais obtida no teste de germinação representa o máximo que a amostra pode oferecer, devido ao fato de que o teste é conduzido sob condições ótimas, artificiais e padronizadas para cada espécie avaliada.
Os fatores considerados de fundamental importância para a germinação de sementes são água, temperatura, luz, oxigênio e substrato. Os efeitos destes fatores na germinação possuem efeito variado, dependendo da espécie, maturidade fisiológica das sementes e suas condições sanitárias (ALBRECHT; ALBURQUERQUE; SILVA,1986). É comum que haja a interação entre estes fatores, sendo a interação entre luz e temperatura, considerada uma das mais importantes (FERREIRA et al., 2001).
A água é fator imprescindível, pois é com a absorção de água por embebição que se inicia o processo de germinação. Para que isso aconteça, há necessidade de que a semente alcance um nível adequado de hidratação, a qual permita a reativação dos processos metabólicos; onde esse nível de hidratação é variável entre as espécies (MORAES, 2007).
A água influi na germinação, atuando no tegumento, amolecendo-o, favorecendo a penetração do oxigênio e permitindo a transferência de nutrientes solúveis para as diversas partes da semente (MARCOS FILHO, 2005). A absorção de água é maior em certas espécies quando a temperatura é mais alta, podendo haver variações no tempo de embebição, de minutos a horas, ou até de vários dias (BEWLEY, 1997).
As sementes apresentam comportamento variável em diferentes temperaturas, não havendo uma temperatura ótima e uniforme de germinação para todas as espécies. Em geral, a temperatura é chamada ótima quando ocorre a máxima germinação no menor período de tempo. A faixa de 20 a 30ºC mostra-se adequada para a germinação de grande número de espécies subtropicais e tropicais, uma vez que estas são temperaturas encontradas em suas regiões de origem, na época propícia para a germinação natural, verificando nestas temperaturas uma máxima porcentagem e velocidade de germinação (BORGES; RENA, 1993; NASCIMENTO et al., 2003). A temperatura afeta a porcentagem, velocidade e uniformidade de germinação e está relacionada com os processos bioquímicos (CARVALHO; NAKAGAWA, 2000), tornando necessária a determinação de temperaturas em que a eficiência da germinação é máxima, assim como a determinação das temperaturas máximas e mínimas toleradas pelas sementes (MARCOS FILHO, 2005).
Além da temperatura adequada, determinadas espécies também necessitam de luz para que possa ocorrer a germinação. A luz é responsável por promover o controle respiratório, a síntese de enzimas e de hormônios, além de exercer efeito sobre a permeabilidade do tegumento e o metabolismo de lipídios (MARCOS FILHO, 2005). A presença de um sistema fotossensorial permite que o organismo vegetal reaja com uma resposta as alterações das condições de luminosidade local. A sensibilidade das sementes à luz varia de acordo com a espécie (OLIVEIRA, 2009). Determinadas espécies germinam unicamente no escuro, sendo conhecidas como fotoblásticas negativas, enquanto outras denominadas fotoblásticas positivas germinam somente em presença de luz. Outras espécies são indiferentes a luz para germinar, chamadas de fotoblásticas neutras. Algumas das sementes fotoblásticas negativas, porém, podem exigir a presença de luz quando submetidas a condições desfavoráveis (LIMA, 2012).
Segundo Moraes (2007), existem sementes cujos tegumentos são tidos como impermeáveis ao oxigênio ou ao gás carbônico e, não havendo trocas gasosas, as sementes não conseguem germinar. O oxigênio é necessário para a promoção de reações metabólicas importantes na semente, especialmente a respiração. Ainda que a respiração nos primeiros momentos da germinação seja, em geral, anaeróbica, logo em seguida ela passa a ser absolutamente dependente de oxigênio. A respiração da semente é também afetada por diversos outros elementos, tais como o tipo de tegumento, o teor de água, a temperatura, a concentração de CO2, a dormência e alguns fungos e bactérias. Na primeira fase de absorção de água, o oxigênio não é fator limitante, sendo-o, entretanto para a emergência da radícula, isto é, a dependência de respiração aeróbica inicia-se na segunda fase de absorção de água (BORGES; RENA, 1993).
Estevan et al. (2010) relatam que o substrato usado durante o processo de germinação possui extrema importância, pois fatores como textura, aeração e capacidade de retenção de água tendem a ser diferentes entre os substratos, resultando em diferenças na quantidade de água disponível para sementes, o que altera a porcentagem de emergência.
É necessário levar em consideração no momento da escolha do substrato, o tamanho da semente, assim como a exigência com relação a umidade, sensibilidade a luz e a facilidade que o substrato oferece para o desenvolvimento e avaliação das plântulas. Os tipos de substratos mais utilizados, descritos e prescritos para testes em laboratório são: pano, papel-toalha, papel-filtro, papel mata-borrão, terra e areia, sendo que para espécies nativas, poucas recomendações existem (FIGLIOLA; OLIVEIRA; PINA-RODRIGUES, 1993; BRASIL, 2009). Para algumas espécies de Bromeliaceae, o teste de germinação foi executado em papel filtro (PEREIRA et al., 2009). Para Dyckia goehringii foi conduzido em laboratório sobre papel mata-borrão (DUARTE et al., 2010) e para D. tuberosa sobre papel filtro (VIEIRA; SOCOLOWSKI; TAKAKI, 2007), enquanto para D. encholirioides a germinação foi realizada em meio de cultura MS (POMPELLI, 2006) e para D. maritima o meio de cultura foi solidificado sem adição de sais (SILVA et al., 2008), portanto não há uma padronização para o gênero.
A longevidade natural das sementes varia de uma forma ampla entre as espécies, sendo definida como o período em que a semente se mantém viva, isto é, capaz de germinar quando colocada em condições favoráveis, quando não houver dormência (TOLEDO; MARCOS FILHO, 1977). Segundo Marcos Filho (2005), a longevidade das sementes é variável de acordo com o genótipo, mas o período de conservação do potencial fisiológico depende, em grande parte, do grau de umidade da semente, da temperatura e das condições do ambiente de armazenamento.
As sementes, por serem constituídas de material altamente higroscópico, apresentam o seu conteúdo de água sempre em equilíbrio com a umidade relativa do ar, e sob umidade elevada a respiração das sementes é aumentada e, por conseguinte, a velocidade de deterioração. Altas temperaturas aceleram os processos de degeneração dos sistemas biológicos, em que ocorre respiração intensa, consumindo seu material de reserva, de maneira que, sob essas condições, as sementes perdem o vigor e a capacidade de germinar (DELOUCHE e POTTS, 1974). Sementes de D. goehringii foram armazenadas em temperatura ambiente durante três meses (DUARTE et al., 2010), enquanto as sementes de D. encholirioides foram armazenadas em geladeira (4 ± 2ºC) (POMPELLI, 2006). A longevidade das sementes de Dyckia foi considerada alta, pois em D. distachya, o potencial de germinação permanecia superior a 70% após um ano de armazenamento (POMPELLI; GUERRA, 2005). Não há estudos de longevidade e armazenamento para outras espécies de Dyckia.
A busca pelo conhecimento sobre o comportamento de lotes de sementes durante o armazenamento tem sido meta constante entre os pesquisadores, tecnologistas e produtores de sementes, visando subsidiar o manejo racional dessas sementes em bancos de germoplasma na comercialização e para o estabelecimento de uma nova cultura (MARTINS, 2006).
De acordo com Ferreira e Borghetti (2004), o armazenamento das sementes deve ser iniciado na maturidade fisiológica e o maior desafio é conseguir que as sementes, após certo período, ainda apresentem elevada qualidade fisiológica. Dessa forma, o objetivo é manter a qualidade das sementes durante o período em que ficam armazenadas, visto que não é possível melhorar a sua qualidade, mesmo sob condições ideais.
As sementes, de modo geral, são separadas em dois grupos, de acordo com a classificação proposta por Roberts (1973): as sementes ortodoxas, que podem ser secas a baixos níveis de umidade (em torno de 5%) e armazenadas a temperaturas baixas, o que possibilita a manutenção da viabilidade por um longo período; e as sementes recalcitrantes, que não toleram estas condições e, portanto, apresentam dificuldades de armazenamento.
Além dos cuidados com o teor de água e a temperatura ambiental, Crochemore (1993) afirma que o tipo de embalagem utilizada no acondicionamento das sementes durante o armazenamento também assume relevante importância na preservação da sua viabilidade e vigor. Sementes conservadas em embalagens que permitem trocas de vapor d’água com o ar atmosférico podem absorver água sob alta umidade relativa do ar, deteriorando-se com certa facilidade.
A qualidade fisiológica de um lote de sementes pode ser avaliada usando-se o teste de germinação desde que o lote apresente alta homogeneidade. Entretanto, se o mesmo apresentar alto grau de heterogeneidade, o teste não apresenta alta sensibilidade e, nesse caso, os testes de vigor são complementares (VIEIRA; CARVALHO; SADER, 1994).
O vigor das sementes é o reflexo de um conjunto de características ou propriedades que determinam o seu potencial fisiológico, ou seja, a capacidade de apresentar desempenho adequado quando expostas a diferentes condições de ambiente. Vários métodos têm sido desenvolvidos para avaliar o vigor com segurança. O objetivo básico dos testes de vigor é a identificação precisa de diferenças importantes na qualidade fisiológica dos lotes, principalmente dos que possuem poder germinativo semelhante (MARCOS FILHO, 1994).
Os testes de vigor realizados em laboratório, sob condições controladas, são considerados métodos indiretos e são instalados, em sua maioria, nas mesmas condições do teste de germinação e a seguir são avaliadas características da germinação das sementes ou da emergência das plântulas, conforme o critério adotado pelo avaliador (NAKAGAWA, 1994).
Os testes de vigor são realizados no sentido de fornecer informações complementares às obtidas no teste de germinação, permitindo melhor conhecimento da qualidade de sementes. O objetivo primordial destes testes e detectar diferenças no potencial fisiológico de sementes com porcentagem de germinação semelhante (MARCOS FILHO, 2005).
Dentre os vários testes de vigor, o teste de envelhecimento acelerado é um dos mais utilizados para avaliação do potencial fisiológico de diversas espécies (TEKRONY, 1995). Este teste tem como princípio o aumento considerável na taxa de deterioração das sementes quando da sua exposição em níveis elevados de temperatura e umidade relativa do ar, considerados os fatores ambientais preponderantes na intensidade e velocidade de deterioração. Para diferentes espécies, o período de exposição das sementes ao envelhecimento varia e não há consenso entre os pesquisadores, portanto a padronização do teste deve ser realizada experimentalmente (MARCOS FILHO, 1994). Não foram encontrados na literatura trabalhos de envelhecimento acelerado com sementes do gênero Dyckia.
Assim, sementes de baixa qualidade deterioram-se mais rapidamente do que as mais vigorosas, apresentando queda acentuada de sua viabilidade (AOSA, 1983). Entretanto, vários fatores como genótipo, grau de umidade inicial das sementes, temperatura e período de permanência das sementes no interior da câmara de envelhecimento, dentre outros, influenciam o resultado do teste de envelhecimento acelerado (MARCOS FILHO, 2005).
Outro teste bastante utilizado é o teste de velocidade de germinação, sendo considerado um teste relativamente simples e prático, que se baseia no princípio de que a velocidade de germinação ou de emergência é proporcional ao vigor das sementes (MARCOS FILHO; CICERO; SILVA, 1987).
Estudar a germinação de sementes é de fundamental importância tanto para que se possa entender o estabelecimento de uma comunidade vegetal quanto para a sobrevivência e regeneração natural das espécies, tendo em vista que, a germinação das sementes pode determinar a distribuição das espécies em diferentes ambientes (FENNER; THOMPSON, 2005). É necessário que as sementes sejam alocadas em substratos e ambientes adequados para que ocorra a germinação de sementes e consequentemente o desenvolvimento das plantas (WINKLER; HULBER; HIETZ, 2005).
O gênero Dyckia surge como mais uma opção de planta para o uso ornamental, portanto, se faz necessário conhecer o comportamento de suas sementes em diferentes condições de germinação. Para algumas espécies os estudos estão avançados ao ponto de se conseguir realizar micropropagação (POMPELLI; GUERRA, 2005), enquanto que para outras como Dyckia cf. espiritosantensis faltam conhecimentos básicos.
5. MATERIAL E MÉTODOS
Os experimentos foram realizados no período de novembro de 2014 a fevereiro de 2015, no Laboratório de Análise de Sementes do Curso de Agronomia da Universidade Federal de Mato Grosso, Campus Universitário do Araguaia, utilizando-se sementes de Dyckia cf. espiritosantensis, obtidas a partir de frutos parcialmente abertos, de coloração marrom, coletados em setembro de 2013, em plantas de uma população natural do Parque Estadual da Serra Azul, localizado no município de Barra do Garças – MT, cujas coordenadas geográficas são 15º52’19’’S e 52º15’35’’ W GR com altitude aproximada de 500 m acima do nível do mar. O clima da região segundo classificação de Köppen é do tipo Aw caracterizado como possuindo temperaturas médias superiores a 27ºC nos meses mais quentes (novembro a fevereiro), temperaturas médias superiores a 18ºC nos meses mais frios (junho a agosto) e com média de precipitação anual entre 1.000 e 1.500 mm distribuídos em dois períodos bem definidos em termos de precipitação: época de chuvas intensas (outubro a março) e período de estiagem (abril a setembro).
As plantas adultas desta espécie foram coletadas em áreas de solos pedregosos em meio a uma vegetação de pequeno porte, característica de Cerrado rupestre. Algumas espécies que habitam a mesma área que a espécie em estudo são: Lafoensia pacari (dedaleiro), Vellozia sp. (canela-de-ema), Qualea sp. (cambará), Casearia silvestris (guaçatonga), Magonia pubescens (tingui), Aristida pallens (capim-barba-de-bode) entre outros.
Os frutos foram mantidos em condições de laboratório por duas semanas, e, posteriormente foram beneficiados, separando-se as sementes das impurezas, e a seguir, as sementes foram armazenadas à temperatura e luz ambientes durante 14 meses em recipientes plásticos que foram tampados de forma não hermética.
Para a realização de todos os testes foram selecionadas sementes intactas, as quais foram dispostas para germinar em caixas plásticas tipo Gerbox® (previamente higienizadas com álcool 54º GL), sobre duas folhas de papel mata-borrão, previamente esterilizadas em autoclave e pré-umedecidas com volume de água destilada 2,5 vezes a massa do papel (BRASIL, 2009).
Foi realizado um teste piloto a 30ºC constante com fotoperíodo de 12 horas proporcionado por quatro lâmpadas fluorescentes do tipo luz do dia de 15 W, onde avaliou-se a germinação em câmara do tipo Mangelsdorf SL 207 em intervalos regulares de 2 dias até determinar a estabilização da porcentagem de germinação, por quatro dias consecutivos. Foram consideradas germinadas as sementes que emitiram 2,0 mm de radícula. As sementes germinadas foram mantidas nos Gerbox® até o desenvolvimento de plântulas normais, sendo assim consideradas após a emissão da primeira folha (BRASIL, 2009). Foram utilizadas 100 sementes por repetição, em um total de oito repetições. Nos demais testes, foram utilizadas 100 sementes por repetição e quatro repetições por tratamento, exceto para o teste de fotoblastia.
Para a avaliação da germinação a diferentes temperaturas foram testadas as seguintes condições: temperaturas constantes (20, 30, 35 e 40 ± 1°C), combinadas com fotoperíodo de 12 horas de luz e 12 horas de escuro; e temperaturas alternadas (25/15, 30/20 e 35/25 ± 1°C), com fotoperíodo de 12 horas de luz e 12 horas de escuro, sendo que o horário de temperatura mais baixa coincidiu com a ausência de luz. Para as temperaturas constantes utilizou-se câmaras de germinação do tipo Mangelsdorf SL 207; e para as temperaturas alternadas foram utilizadas estufas incubadoras refrigeradas tipo BOD das marcas CIENLAB e ELETROLAB. Para todas as temperaturas foram utilizadas lâmpadas similares ao do teste- piloto. Utilizou-se o mesmo critério do teste-piloto para avaliar sementes germinadas e plântulas normais e cada tratamento foi avaliado até a estabilização da porcentagem de germinação. Adotou-se o delineamento experimental inteiramente casualizado (DIC) para o teste de germinação em função da temperatura em um total de sete tratamentos em um total de 28 amostras, sendo apresentadas as curvas de germinação acumulada para cada temperatura.
A seguir, realizou-se o teste de germinação em função da presença e ausência de luz apenas na temperatura constante de 30ºC com a finalidade de avaliar a característica fotoblástica destas sementes. Para obtenção do tratamento ESCURO, cada Gerbox® foi envolvido em uma bolsa de plástico preto. Para o tratamento CLARO, cada Gerbox® foi envolvido em uma bolsa de plástico transparente, sendo portanto dois tratamentos com cinco repetições para cada. Todos as repetições permaneceram em câmara do tipo Mangelsdorf SL 207 com luz contínua durante 15 dias. A germinação total foi avaliada ao final deste período sem avaliações intermediárias.
Para o experimento de envelhecimento acelerado, as sementes foram expostas ao ar úmido em temperatura de 42 ± 1°C em câmara do tipo Mangelsdorf SL 207 sem luz, durante diferentes intervalos de tempo: 24, 48, 72 e 96 h e um controle que não foi exposto a essa condição, totalizando cinco tratamentos e 20 amostras. Para criar uma condição de câmara úmida foram utilizadas caixas do tipo Gerbox® com as sementes distribuídas sobre uma tela de metal suspensa sobre 40 mL de água destilada (MARCOS FILHO, 1994). Ao final do período de exposição, as sementes foram colocadas para germinar na mesma condição do teste-piloto.
Segundo Borghetti e Ferreira (2004) o cálculo da germinabilidade (%G) é a forma mais simples de determinar a qualidade das sementes, sendo calculada a partir da razão entre o número de sementes germinadas (ni) e o número de sementes dispostas a germinar (N) sob determinadas condições experimentais:
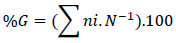
Calculou-se também a velocidade de germinação (v), expressa em dias-1, de acordo com Borghetti e Ferreira (2004), onde: igual ao número de sementes germinadas em uma determinada data e tempo decorrido entre o início do experimento e a data de avaliação:
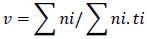
Para cada experimento, realizou-se os testes de normalidade dos dados (Dmax) pela fórmula de Kolmogorov-Smirnov e a homogeneidade das variâncias (Fmax) pela fórmula de Hartley, conforme fluxograma apresentado por Santana e Ranal (2004).
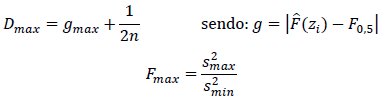
Onde: F0,5 frequência relativa observada e ajustada, n = número de parcelas ou de amostras, s2max = maior variância entre tratamentos; s2min = menor variância entre tratamentos.
Em função dos testes de normalidade e homogeneidade optou-se pela estatística paramétrica ou não-paramétrica para a análise de variância.
Quando as variâncias foram homogêneas realizou-se a análise de variância pelo teste F e para variâncias heterogêneas utilizou-se o teste de Kruskal-Wallis.
A comparacao entre tratamentos na estatística paramétrica foi realizada pelo teste de Scott-Knott, e na estatística não-paramétrica o teste U de Mann-Whitney, em ambos a 5% de probabilidade (SANTANA; RANAL, 2004).
6. RESULTADOS E DISCUSSÃO
-
Experimento piloto
No teste piloto de germinação, onde avaliou-se o comportamento germinativo das sementes de D. cf. espiritosantensis, verificou-se que a germinação iniciou-se sete dias após a instalação do experimento e começou a se estabilizar a partir do 15o dia. A partir do 20o dia de acompanhamento da germinação das sementes de D. cf. espiritosantensis foi possível verificar a ocorrência de mortalidade de plantas já germinadas, concluindo que o teste deve ser encerrado nesse limite de tempo.
Constatou-se que a germinação média das repetições foi de 38,87% (Figura 1b), o valor mínimo foi de 31% e o máximo de 46% (Figura 1a), estando dentro dos limites de tolerância de variabilidade de germinação de acordo com as regras de análise de sementes (BRASIL, 2009).
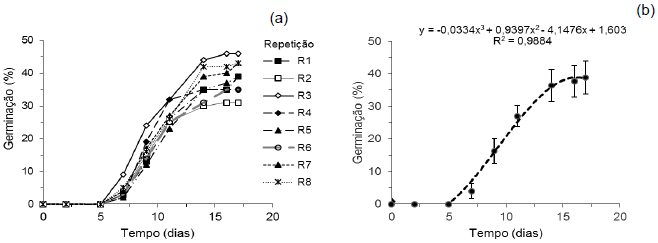
Figura 1. (a) Porcentagem de germinação de sementes de D. cf. espiritosantensis a 30ºC em função do tempo em diferentes repetições. (b) Curva média da porcentagem germinação de sementes de D. cf. espiritosantensis a 30ºC. Barra do Garças-MT, 2015.
Sugere-se que a primeira contagem para estas sementes seja realizada entre o 7º e o 9º dia após a instalação do experimento.
Geralmente a germinação de sementes de espécies de Dyckia é elevada, atingindo valores próximos a 75% para Dyckia tuberosa (VIEIRA; SOCOLOWSKI; TAKAKI, 2007). Pompelli (2006) também observou germinação superior a 70% em Dyckia encholirioides. O fato da germinação ter sido baixa levou a hipótese de temperatura inadequada para germinação no teste piloto. A partir deste dado realizou-se o teste de germinação a diferentes temperaturas para estabelecer a mais apropriada para o desempenho germinativo dessas sementes.
-
Teste de germinação a diferentes temperaturas
O teste de Shapiro-Wilk mostrou que a germinação a diferentes temperaturas não apresentou distribuição normal dos dados tanto para a germinação (%) quanto para a velocidade média de germinação (Tabela 1). Em função disso, a análise de variância foi realizada pelo teste de Kruskal-Wallys, mostrando que houve diferença significativa entre tratamentos a um nível de 5% de probabilidade (Tabela 2). Devido ao fato de a análise estatística ser não-paramétrica, são apresentados os valores de medianas para germinação (%) e velocidade de germinação (Tabela 3).
Tabela 1. Avaliação da normalidade dos dados para o teste de germinação de sementes de D. cf. espiritosantensis a diferentes temperaturas pelo teste de Shapiro-Wilk. Barra do Garças-MT, 2015.
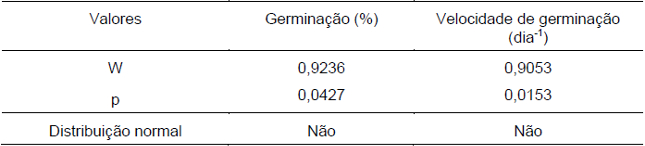
Número de observações = 28
Tabela 2. Análise de variância para o teste de germinação de D. cf. espiritosantensis a diferentes temperaturas pelo teste de Kruskal-Wallys. Barra do Garças-MT, 2015.
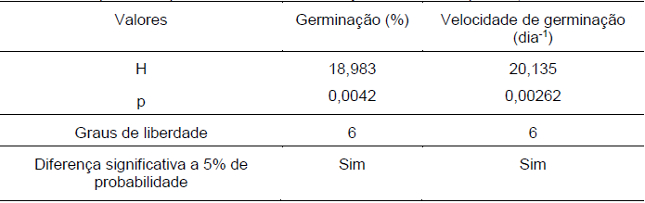
Tabela 3. Valores de medianas de germinação (%) e velocidade de germinação de D. cf. espiritosantensis para teste a diferentes temperaturas. Barra do Garças-MT, 2015.
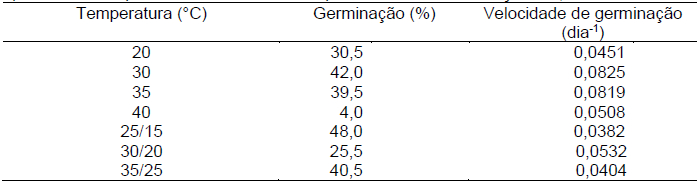
Os maiores valores de germinação (%) foram observados na temperatura alternada de 25/15°C (Tabela 3), no entanto, este tratamento não diferiu significativamente dos seguintes: 30 e 35°C constantes e 35/25°C (Tabela 4). O menor valor foi observado no tratamento a 40°C (Tabela 3) e este diferiu significativamente de todos os demais (Tabela 4). Na temperatura de 20°C e 30/20°C, os valores de porcentagem de germinação foram intermediários (Tabela 3) e não diferiram entre si (Tabela 4).
A germinação foi mais rápida a 30 e a 35°C constantes (Tabela 3), sendo significativamente diferentes de todas as demais temperaturas (Tabela 4). A velocidade de germinação mais baixa foi verificada na temperatura 25/15°C (Tabela 3), não diferindo significativamente dos tratamentos 35/25 e 40°C (Tabela 4). Velocidades intermediárias foram observadas no tratamento a 30/20°C (Tabela 3) que difere estatisticamente apenas do 25/15°C (Tabela 4).
No teste de germinação em diferentes temperaturas, os tratamentos que apresentaram início da germinação mais precoce foram: 30, 35 e 35/25°C com as primeiras sementes germinadas entre 8 e 10 dias após a semeadura, atingindo o máximo de germinação entre 16 e 21 dias. Os tratamentos a 35 e 30°C foram os que apresentaram a germinação mais sincronizada dentre os três citados, pois o intervalo entre o início e a estabilização da geminação foi de 7 e 8 dias respectivamente (Figura 2).
Por outro lado, os tratamentos a 20, 25/15 e 30/20°C foram os que apresentaram o início de germinação mais tardio, com as primeiras sementes germinadas entre 15 e 21 dias após a semeadura, obtendo a porcentagem máxima de germinação entre 28 e 36 dias. Os tratamentos a 25/15 e 30/20°C apresentaram baixa sincronização demorando entre 15 e 20 dias para a estabilização da germinação, enquanto o tratamento a 20°C apresentou maior sincronização. O tratamento a 40°C se distinguiu de todos os demais tratamentos, estabilizando-se aos 25 dias após a semeadura com índices muito baixos de germinação (Figura 2).
O baixo índice de germinação de D. cf. espiritosantensis na temperatura de 40ºC, concorda com Borghetti (2005), onde no experimento realizado com espécies tropicais a temperatura máxima para germinação foi de 40°C, embora algumas espécies apresentem germinação a 45°C. Resultados semelhantes ao de Borghetti (2005) foram encontrados por Pinheiro e Borghetti (2003) em Aechmea nudicaulis (L.) e Streptocalyx floribundus (Martius ex Schultes f.) Mez, duas bromélias de restinga, que apresentaram a temperatura máxima de germinação sendo de 40°C.
Tabela 4. Quadro de probabilidades de significância da diferença entre tratamentos para os dados de germinação (%) e de velocidade de germinação de sementes de D. cf. espiritosantensis a diferentes temperaturas pelo teste de U de Mann-Whitney. Barra do Garças-MT, 2015.
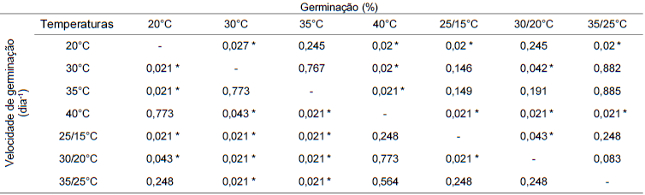
* Diferença significativa entre tratamentos a 5% de probabilidade pelo teste U de Mann-Whitney.
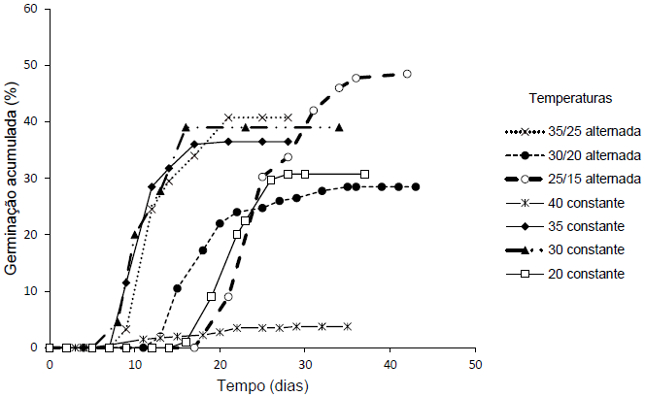
Figura 2. Porcentagem de germinação de sementes de D. cf. espiritosantensis em diferentes temperaturas em função do tempo. Barra do Garças-MT, 2015.
De acordo com Pereira, Cuquel e Panobianco (2010), em experimento realizado com Nidalurium innocentii (Bromeliaceae) constatou-se que o teste de germinação pode ser conduzido utilizando as temperaturas constantes de 20°C e 25°C e alternadas de 30/20°C obtendo-se alta taxa de germinação. Isso ocorre provavelmente em razão das temperaturas estarem numa faixa próxima a do ecossistema natural das plantas. A homogeneidade dos resultados no teste de germinação em diferentes temperaturas também foi encontrada por Tarré et al. (2007), que pesquisaram os gêneros de bromélias Encholirium e Dyckia e não observaram diferenças no poder germinativo das sementes quando testadas nas temperaturas de 20°C, 25°C e 30°C.
Em trabalho realizado por Duarte et al. (2010), constatou-se que sementes de Dyckia goehringii Gross & Rauh apresentam maior germinação e vigor à temperatura de 30°C, apresentando germinação máxima de 90% aos 15 dias após a semeadura. Vieira, Socolowski e Takaki (2007) observaram que para Dyckia tuberosa, os maiores valores de germinação foram observados a 30 e 35°C, com germinação média de 75% aos 15 dias após a semeadura. A alta germinabilidade de suas sementes em temperaturas elevadas indica que sementes de D. tuberosa são capazes de germinar em ambientes abertos e aparentemente, o processo de germinação de sementes não é um fator limitante para esta espécie.
Pereira, Cuquel e Panobianco (2010) pontuam que a alta porcentagem de germinação de N. innocentii obtida na faixa de temperatura de 20 a 30ºC evidencia que a espécie pode facilmente ser propagada em viveiros inseridos no próprio ecossistema da planta, sem a necessidade de controle de temperatura. Isto possivelmente seria uma alternativa para redução de custos na implantação de estruturas adequadas para a propagação, favorecendo a propagação de bromélias por sementes. No caso da espécie deste estudo, D. cf. espiritosantensis, isso não ocorre, uma vez que se obteve baixos índices de germinação em todos os tratamentos. Pode se supor que essa baixa porcentagem de germinação tenha sido causada pelo modo e também pelo longo período de armazenamento das sementes. Sugere-se que num futuro trabalho seja realizado o teste de tetrazólio para avaliar a viabilidade das sementes, ou a realização dos testes de germinação logo após a coleta.
Outro aspecto a se considerar é a contaminação por fungos que foi observada neste experimento. Sugere-se que na continuidade dos estudos com esta espécie realize-se o tratamento das sementes com fungicida. Outra possibilidade é a identificação dos fungos que se desenvolveram com a finalidade de avaliação fitossanitária.
Em função da baixa porcentagem de germinação, pode-se ainda avaliar a capacidade de propagação vegetativa desta espécie a partir de indivíduos adultos, pois em outras Bromeliaceae essa capacidade adaptativa foi observada (SILVA et al., 2008; SALOMÃO, 2013).
-
Fotoblastia
No teste de fotoblastia, avaliou-se a germinação em função da presença ou ausência de luz, obtendo-se as seguintes médias: 42% na presença de luz e 39,6% na ausência (Figura 3). O teste U de Mann-Whitney revelou que a diferença não foi significativa entre estes tratamentos a 5% de probabilidade (Tabela 5). Desta forma, a incidência de luz não é um fator limitante para que as sementes de D. cf. espiritosantensis iniciem o processo germinativo. Assim, as sementes podem ser classificadas como fotoblásticas neutras ou indiferentes à luz quando expostas a temperatura constante de 30ºC.
Em vários estudos observou-se que as sementes de Bromeliaceae são fotoblásticas neutras tal como D. cf. espiritosantensis. Em trabalho realizado por Vieira, Socolowski e Takaki (2007) foi visto que as sementes de Dyckia tuberosa (Vell.) Beer germinaram entre 15 e 40 °C, tanto na luz como no escuro.
Tabela 5. Valores médios de germinação (%) de sementes de D. cf. espiritosantensis para avaliação de fotoblastia. Barra do Garças-MT, 2015.
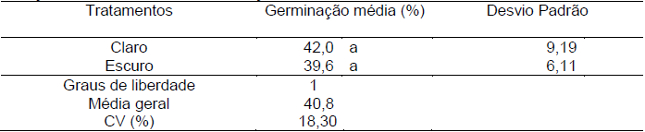
Médias seguidas da mesma letra na coluna não diferem entre si pelo teste U de Mann-Whitney a 5% de probabilidade
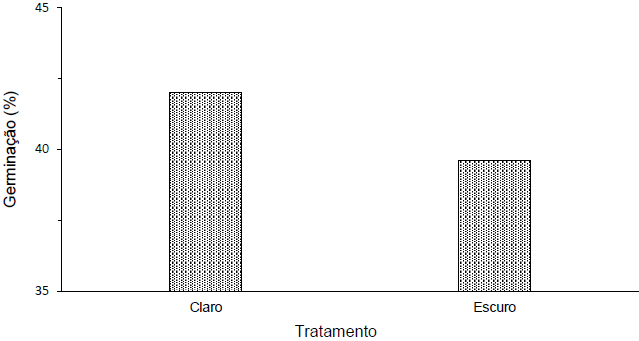
Figura 3. Porcentagem de germinação de D. cf. espiritosantensis em função de claro e escuro com temperatura constante de 30ºC. Barra do Garças-MT, 2015.
Segundo Mercier e Guerreiro Filho (1990), em trabalhos realizados com outras bromélias, a possibilidade de ocorrência de germinação em condições de baixa luminosidade ou na ausência de luz permite a ocupação de vários micro habitats existentes nas matas, ou no próprio solo, que muitas vezes encontram-se recobertos por pedras ou com acúmulo de folhas. O mesmo poderia ser sugerido para D. cf. espiritosantensis cuja capacidade de germinação tanto em claro quanto em escuro pode justificar a ocorrência dessa espécie em áreas sombreadas.
Entretanto, em trabalho realizado por Dutra, Teófilo e Medeiros Filho (2010) com germinação de sementes de macambira (Bromelia laciniosa Mart. ex Schult), os autores verificaram que as sementes não germinaram no escuro em nenhuma das temperaturas testadas, porém, foi observado germinação elevada em todas as temperaturas com presença de luz contínua ou com fotoperíodo de 8 horas, portanto as sementes se comportaram como fotoblásticas positivas.
Em outro trabalho realizado por Pereira et al. (2009) com espécies rupícolas e epífitas de Bromeliaceae, foi visto que as espécies rupícolas Alcantarea imperialis e Pitcairnia flammea, apresentaram germinação nula sob ausência de luz, sendo classificadas como fotoblásticas positivas. Pons (2000) explica que tal comportamento pode ser ecologicamente importante, pois impede que as sementes germinem quando soterradas no solo ou em fendas de rochas com nenhuma luz, esgotando suas reservas antes que suas plântulas alcancem espectros fotossinteticamente ativos de luz nas camadas mais superficiais, situação comum para as duas espécies rupestres. As sementes das duas espécies epífitas foram capazes de germinar no escuro, com valores médios de 18% para Vriesea penduliflora e 52% para V. heterostachys, desta forma sendo consideradas como fotoblásticas neutras. Neste caso, as sementes seriam capazes de germinar após a exposição à luz filtrada pela serapilheira e/ou solo, quando enterradas em pequenas profundidades ou pelas folhas das copas das árvores, quando aderidas aos troncos e galhos após a dispersão, permitindo a sua germinação sob condições sombreadas no interior da floresta, onde a intensidade de luz é menor conforme sugerido por Capers e Chazdon (2004). Estes autores concluem que requerimentos germinativos contrastantes entre espécies estão relacionados a preferência de habitat de cada uma delas.
-
Envelhecimento acelerado
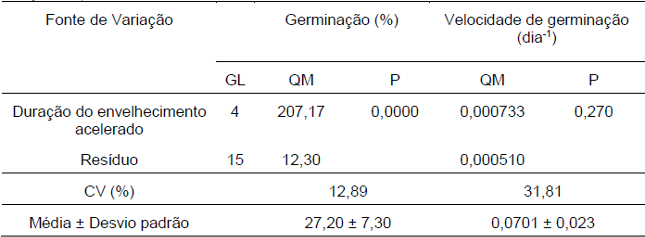
A análise de variância mostrou que os tratamentos de envelhecimento acelerado tiveram efeito na porcentagem de germinação total, porém o efeito não foi significativo sobre a velocidade média de germinação (Tabela 6).
A germinação acumulada foi de 40,0% para o controle não exposto ao ar úmido e variou de 22,75 a 24,75% nos tratamentos onde houve essa exposição, sem relação com o tempo de duração dessa exposição. Por outro lado, as sementes que foram expostas a umidade apresentaram início de germinação mais precoce. Porém essa exposição ao ambiente úmido se refletiu em menor germinação acumulada quando relacionada com o tratamento controle (Figura 4). Portanto as sementes perderam vigor no teste de envelhecimento acelerado.
Tabela 6. Análise de variância de germinação (%) e velocidade de germinação de sementes de D. cf. espiritosantensis após diferentes períodos de envelhecimento acelerado. Barra do Garças-MT, 2015.
Número de observações = 20
Utilizando o teste de Scott-Knott a 5% de probabilidade foi possível verificar que a germinação das sementes de D. cf. espiritosantensis após diferentes tempos de exposição ao ar úmido apresentou diferença significativa apenas no tratamento controle. Apesar do início da germinação do tratamento controle ter sido mais retardado em relação aos demais, não houve diferença significativa para a velocidade de germinação (Tabela 7).
De acordo com Pontes et al. (2006) e Pina-Rodrigues, Figliolia e Peixoto (2004), o teste de envelhecimento acelerado provoca nas sementes alta taxa de respiração, consumo das reservas e aceleração dos processos metabólicos que levam à redução de qualidade deterioração e morte da semente. É possível que os tratamentos realizados tenham induzido o processo de deterioração das sementes de D. cf. espiritosantensis.
Analisando os mesmos dados a partir da germinação diária, verifica-se que o pico de germinação para os tratamentos submetidos respectivamente a 0, 24, 48, 72 e 96 horas de umidade ocorreu entre o 8º e o 10º dia após o início do teste de germinação (Figura 5a).
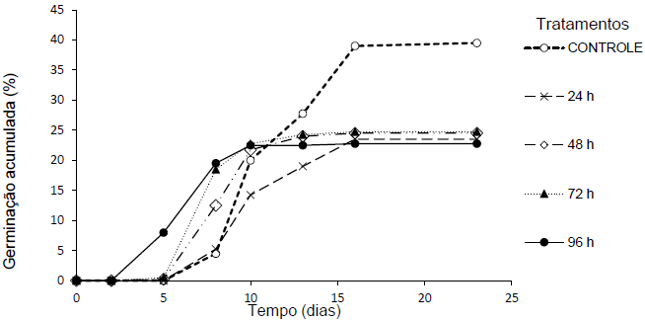
Figura 4. Porcentagem de germinação de sementes de D. cf. espiritosantensis após diferentes períodos de envelhecimento acelerado. Barra do Garças-MT, 2015.
Tabela 7. Médias de germinação (%) e velocidade de germinação de sementes de D. cf. espiritosantensis após diferentes períodos de envelhecimento acelerado Barra do Garças-MT, 2015.
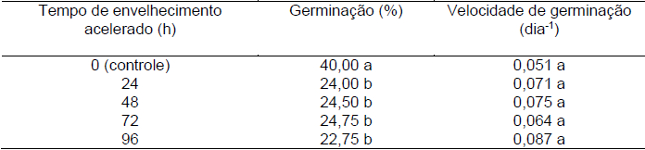
Médias seguidas por uma mesma letra na coluna não diferem entre si pelo teste Scott-Knott a 5% de probabilidade.
O controle apresentou dois picos de germinação, sendo aos 10 e aos 16 dias, indicando falta de sincronização da germinação (Figura 5b). O período de envelhecimento acelerado de 24 horas foi o que apresentou maior dispersão da germinação diária (Figura 5c). O tratamento de 48 horas apresentou o pico de germinação diária aos 8 dias (Figura 5d). O tratamento de 72 horas de exposição foi o que apresentou maior sincronização da germinação, com o pico de 18% aos 8 dias (Figura 5e). O tratamento de 96 horas apresentou o início da germinação mais precoce aos 5 dias, com pico também aos 8 dias (Figura 5f).
Estes resultados indicam que a exposição ao ar úmido pode favorecer a sincronização da germinação, desde que seja realizada a temperatura ambiente, pois na temperatura em que a exposição foi realizada (42 ± 1°C) houve prejuízo para a germinação total conforme discutido por Pontes et al. (2006) e Pina-Rodrigues, Figliolia e Peixoto (2004),
De forma contrastante, no trabalho realizado por Pereira, Carvalho e Biasi (2010), com sementes de Hovenia dulcis (Rhamnaceae), foi visto que o aumento do tempo de exposição ao teste de envelhecimento acelerado foi benéfico para a qualidade fisiológica das sementes. De acordo com os autores, houve aumento da porcentagem de germinação de forma linear de 70 para 91% após 120 horas de tratamento.
Em outro trabalho, Barbosa, Costa e Sá (2011), concluem através do experimento de envelhecimento acelerado de sementes de espécies oleráceas que o processo de envelhecimento acelerado torna-se mais prejudicial às sementes, à medida em que se aumenta o tempo de exposição, fato esse que não visto no experimento realizado com D. cf. espiritosantensis, onde os tratamentos de 24, 48, 72 e 96 horas não apresentaram diferença significativa entre eles. Braccini et al. (1999) em experimento realizado com diferentes variedades de soja também concluíram que o aumento nos períodos de envelhecimento acelerado afeta o desempenho das sementes durante a germinação.
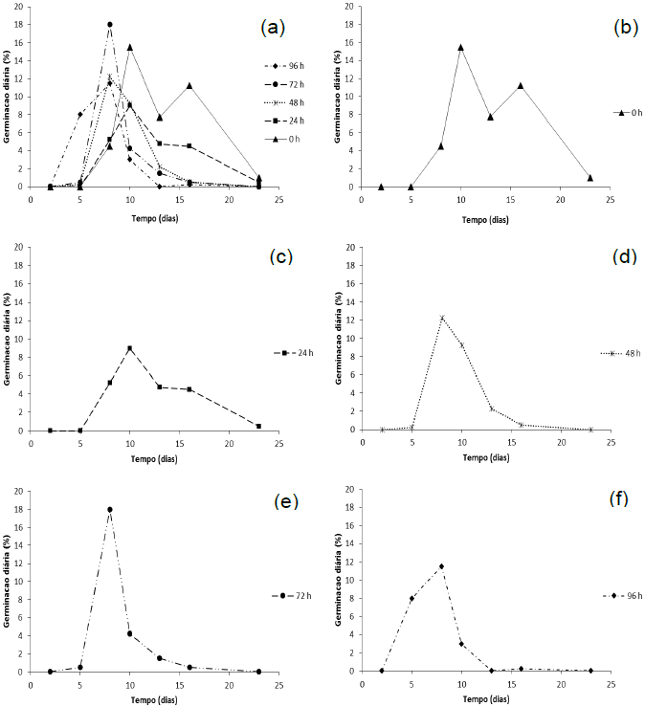
Figura 5. (a) Média de germinação diária de sementes de D. cf. espiritosantensis de todos os tratamentos de envelhecimento acelerado. (b) Média de germinação diária não submetida a envelhecimento acelerado (controle). (c) Média de germinação diária após 24 horas de envelhecimento acelerado. (d) Média de germinação diária após 48 horas de envelhecimento acelerado. (e) Média de germinação diária após 72 horas de envelhecimento acelerado. (f) Média de germinação diária após 96 horas de envelhecimento acelerado. Barra do Garças-MT, 2015.
7. CONCLUSÕES
Nas condições em que foram conduzidos estes experimentos, pode-se inferir que:
-
O teste de germinação de D. cf. espiritosantensis realizado na temperatura constante de 30°C pode ser encerrado no 20o dia após a instalação do experimento, obtendo média de germinação de 38,87%.
-
Não foi possível estabelecer as temperaturas cardeais para esta espécie, porém ressalta-se que a menor porcentagem de germinação foi observada na temperatura constante de 40°C.
-
A maior velocidade de germinação e a maior sincronização da germinação ocorrem nas temperaturas de 30 e a 35°C.
-
As sementes de D. cf. espiritosantensis mostraram-se indiferentes a luz para a germinação.
-
Sementes de D. cf. espiritosantensis que foram expostas aos tratamentos de envelhecimento acelerado apresentaram um início de germinação mais precoce.
-
A exposição a essa condição por 72 horas foi benéfica para a sincronização da germinação.
-
O envelhecimento acelerado afetou negativamente a porcentagem de germinação das sementes, portanto as mesmas perderam vigor quando expostas a este tratamento.
8. REFERÊNCIAS BIBLIOGRÁFICAS
AGUIAR, L.M.S.; MACHADO, B.M.; MARCOS FILHO, J. A Diversidade Biológica do Cerrado. In: AGUIAR, L.M.S.; CAMARGO, A.J.A. (Eds.). Cerrado: ecologia e caracterização. Planaltina, Embrapa Cerrados, 2004. p. 17-40.
ALBRECHT, J. M. F.; ALBURQUERQUE, M.C.L.F.; SILVA, V.S.M. Influência da temperatura e do tipo de substrato na germinação de sementes de cerejeira. Revista Brasileira de Sementes, Brasília, DF, v. 8, n.1, p. 49-55, 1986.
ANDRADE, A.C.S. Efeito da luz e da temperatura na germinação de Leandra breviflora Cong., Tibouchina benthamiana Cong., Tibouchina grandifolia Cong. e Tibouchina moricandia (DC.) Baill. (Melastomataceae). Revista Brasileira de Sementes, Brasília, v. 17, p. 29-35, 1995.
AOSA - ASSOCIATION OF OFFICIAL SEED ANALYSTS. Seed vigor testing handbook. Eastasing, 1983, 88p.
ARAÚJO NETO, J.C.; AGUIAR, I.B.; FERREIRA, V.M. Efeito da temperatura e luz na germinação de sementes de Acacia polyphylla DC. Revista Brasileira de Botânica, São Paulo, v. 26, n. 2, p. 249-256, 2003.
BARBOSA, R.M.; COSTA, D.S.; SÁ, M.E. Envelhecimento acelerado de Sementes de espécies oleráceas. Pesquisa Agropecuária Tropical, Goiânia, v. 41, n. 3, p. 328-335, 2011.
BENNETT, B.C. Ethnobotany of Bromeliaceae. In: BENZING, D. H. (Ed.). Bromeliaceae: Profile of an adaptive radiation. Cambridge: Cambridge University Press, 2000, p. 587-608.
BENZING, D.H. Vulnerabilities of tropical forests to climate change: the significance of resident epiphytes. Climatic Change, v. 39, p. 519-540, 1998.
BENZING, D.H.; BURT, K. M. Foliar permeability among twenty species of Bromeliaceae. Bulletin of the Torrey Botanical Club, New York, v. 97, p. 269-279, 1970.
BEWLEY, J.D. Seed germination and dormancy. The Plant Cell, v. 9, n. 7, p. 1055- 1066, 1997.
BEWLEY, J.D.; BLACK, M. Seeds: physiology of development and germination. 2.ed. New York: Plenum Press, 1994. 445p.
BORGES, E.E.; RENA, A.B. Germinação de sementes. In: AGUIAR, I.B. de; PINA-RODRIGUES, F.C.M.; FIGLIOLIA, M.B. (Coord.). Sementes Florestais Tropicais. Brasília, ABRATES, 1993. p. 137-174.
BORGHETTI, F. Temperaturas extremas e a germinação de sementes. In: NOGUEIRA, R.J.M.C.; ARAÚJO, E.L.; WILLADINO L.G.; CAVALCANTE, U.M.T. (Eds.). Estresses ambientais, danos e benefício em plantas. Recife, MXM Gráfica e Editora, 2005. p. 207-218.
BORGHETTI, F.; FERREIRA, A.G. Interpretação de resultados de germinação. In: FERREIRA, A.G.; BORGHETTI, F. (Orgs.). Germinação: do básico ao aplicado. Porto Alegre, Artmed, 2004. p. 209-222.
BRACCINI, A.L.; REIS, M.R.; SEDIYAMA, C.S.; SCAPIM, C.A.; BRACCINI, M.C.L. Avaliação da qualidade fisiológica de sementes de soja, após o processo de hidratação-desidratação e envelhecimento acelerado. Pesquisa Agropecuária Brasileira, Brasília, v. 34, n. 6, p. 1053-1066, 1999.
BRASIL, Ministério da Agricultura, Pecuária e Abastecimento. Regras para análise de sementes. Brasília, Secretaria de Defesa agropecuária, 2009. 399p.
BRASIL, Ministério do Meio Ambiente. Mapas de Cobertura dos Biomas Brasileiros. Ministério do Meio Ambiente, Brasília, DF, Secretaria de Nacional de Biodiversidade e Florestas, 2007.
CAPERS, R.S.; CHAZDON, R.L. Rapid assessment of understory light availability in a wet tropical forest. Agricultural and Forest Meteorology. v. 123, p. 177-185, 2004.
CARVALHO, N.M.; NAKAGAWA, J. Sementes: ciência, tecnologia e produção. Jaboticabal: FUNEP, 2000. 588p.
COME, D.; TISSAOUI, T. Interrelated effects of imbibition, temperature and oxygen on seed germination. In: HEYDECKER, W (Ed.), Seed ecology, London, Butterworth, Cap.9, 1973. p. 157-168.
COXSON, D.S.; NADKARNI, N.M. Ecological roles of epiphytes in nutrient cycles of forest ecosystems. New York, Academic Press, 1995. p. 495-543.
CROCHEMORE, M. L. Conservação de sementes de tremoço azul (Lupinus angustifolius L.) em diferentes embalagens. Revista Brasileira de Sementes, Brasília, v. 15, n. 2, p. 227-231, 1993.
DELOUCHE, J.C.; POTTS, H.C. Programa de sementes: Planejamento e implantação. 2. ed. Brasília: Agiplan, 1974. 118p.
DUARTE, E.F.; CARNEIRO, I.F.; SILVA, N.F.; GUIMARÃES, N.N.R. Características físicas e germinação de sementes de Dyckia goehringii Gross & Rauh (Bromeliaceae). Pesquisa Agropecuária Tropical, Goiânia, v. 40, n. 4, p. 422-429, 2010.
DUTRA, A.S.; TEÓFILO, E.M.; MEDEIROS FILHO, S. Germinação de sementes de macambira (Bromelia laciniosa Mart. ex Schult). Revista Caatinga, Mossoró, v. 23, n. 2, p. 12-17, 2010.
EGLEY, G.H. Reflections on my career in weed science germination research. Seed Science Research, v. 9, n. 1, p. 3-12, 1999.
ELIAS, C.; FERNANDES, E.A.N; FRANÇA, E.J.; BACCHI, M.A.A. Seleção de epífitas acumuladoras de elementos químicos na Mata Atlântica. Biota neotropica, v. 6, n. 1, p. 1-9, 2006.
ESTEVAN, D.A.; FARIA, R.T.; VIEIRA, A.O.S.; MOTA, T. D.; TAKAHASHI, L. S. A. Germinação de sementes de duas bromélias em diferentes substratos. Cientifica, Jaboticabal, v. 38, p. 7-13, 2010.
FELFILI, J.M; FAGG, C.W. Floristic composition diversity and structure of the “cerrado” sensu stricto on rocky soils in northern Goiás and southern Tocantins, Brazil. Revista Brasileira de Botânica, v. 30, n. 2, p. 375-385, 2007.
FENNER, M.; THOMPSON, K. The ecology of seeds. Cambridge: Cambridge University Press, 2005. 250p.
FERREIRA, A.G.; BORGHETTI, F. Germinação: do básico ao aplicado. Porto Alegre: Artmed, 2004. 323 p.
FERREIRA, A.G.; CASSOL, B.; ROSA, S.G.T.; SILVEIRA, T.S.; STIVAL, A.L.; SILVA, A.A. Germinação de sementes Asteraceae nativas, no Rio Grande do Sul, Brasil. Acta Botanica Brasilica, Porto Alegre, v. 15, p. 231-242, 2001.
FIGLIOLA, M.B.; OLIVEIRA, E.C.; PINA-RODRIGUES, F.C.M. Análise de sementes. In: AGUIAR, I.R.; PINA-RODRIGUES, F.C.M.; FIGLIOLA, M. B. (Coord.). Sementes florestais tropicais, Brasília, DF, 1993. p. 137-174.
FORZZA, R.C.; COSTA, A.; SIQUEIRA FILHO, J.A.; MARTINELLI, G.; MONTEIRO, R.F.; SANTOS-SILVA, F.; SARAIVA, D. P.; PAIXÃO-SOUZA, B.; LOUZADA, R.B.; VERSIEUX, L. Bromeliaceae. In: Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro, 2011. Disponível em:
FORZZA, R.C.; WANDERLEY, M.G.L. Flora da serra do Cipó, Minas Gerais: Bromeliaceae – Pitcairnioideae. Boletim de Botânica da Universidade de São Paulo, v. 17, p. 225-270, 1998.
GIULIETTI, A.M.; HARLEY, R. M.; QUEIROZ, L.P.; WANDERLEY, M. G. L.; PIRANI, J. R. Caracterização e endemismos nos campos rupestres da Cadeia do Espinhaço. In: CAVALCANTI, T.B.; WALTER, B.M.T. (Eds.). Tópicos Atuais em Botânica. Brasília, Embrapa Recursos Genéticos e Biotecnologia - CENARGEN, 2000. p. 311-318.
GIVNISH, T.J.; BARFUSS, M.H.J.; EE, B.V.; RIINA, R.; SCHULTE, K.; HORRES, R.; GONSISKA, F.A.; JABAILY, R.S.; CRAYN, D. M.; SMITH, A.C.; WINTER, K.; BROWN, G.K.; EVANS, T.M.; HOLST, B.K.; LUTHER, H.; TILL, W.; ZIZKA, G.; BERRY, P.E.; SYTSMA, K.J. Phylogeny, adaptive radiation and historical biogeography in Bromeliaceae: Insights from an eight-locus plastid phylogeny. American Journal of Botany, New York, v. 98, p. 872-895, 2011.
HARLEY, R.M. Introdução. In: STANNARD, B.L.; HARVEY, Y.B.; HARLEY, R.M. Flora of the Pico das Almas, Chapada Diamantina, Bahia, Brazil. Kew, Royal Botanic Gardens, 1995. p. 1-78.
KLINK, C.A.; MACHADO, R.B. Conservation of the Brazilian Cerrado. Conservation Biology, v. 19, n. 3, p. 707-713, 2005.
KRANZ, W.M. Dyckia (Bromeliaceae, Pitcairnioideae), um gênero relicto. In: 64º Congresso Nacional de Botânica, Belo Horizonte, 2013. Disponível em:
LEME, E. M.C.; FRAGA, C.N.; KOLLMANN, L.J.C.; BROWN, G.K.; TILL, W.; RIBEIRO, O.B.C; MACHADO, M.C.; MONTEIRO, F.J.S.M; FONTANA, A.P. Miscellaneous new species in the Brazilian Bromeliaceae. Rodriguésia, v. 61, p. 21-67, 2010.
LEME, E.M.C.; RIBEIRO, O.B.C.; MIRANDA, Z.J.G. New species of Dyckia (Bromeliaceae) from Brazil. Phytotaxa, Auckland, v. 67, p. 9-37, 2012.
LIMA, J.J.P. Avaliação de qualidade fisiológica de sementes de crambe (Crambe abyssinica Hochst). Lavras, 75p. Dissertação (Mestrado em Produção Vegetal) Universidade Federal de Lavras. 2012.
LINDER, H.P.; RUDALL, P. Evolutionary History of Poales. Annual Review of Ecology, Evolution, and Systematics, v. 36, p. 107-124, 2005.
LUTHER, H.E. An alfabhetical list of bromeliad binomials. 11 ed. Sarasota. Sarasota Bromeliad Society and Marie Selby Botanical Garden, 2008. 110p.
MACHADO, C.F. Metodologia para a condução do teste de germinação e utilização de raios-x para a avaliação da qualidade de sementes de aroeira-branca (Lithraea molleoides (Vell.) Engl.) 51p. Dissertação (Mestrado) Escola Superior de Agricultura Luiz de Queiroz, Universidade de São Paulo). Piracicaba, 2002.
MARCOS FILHO, J. Fisiologia de sementes de plantas cultivadas. Piracicaba, FEALQ, 2005. 495p.
MARCOS FILHO, J. Teste de envelhecimento acelerado. In: VIEIRA, R. D.; CARVALHO, N. M. de. Testes de vigor em sementes. Jaboticabal: FUNEP, 1994. p. 133-149.
MARCOS FILHO, J.; CICERO, S.M.; SILVA, W.R. Avaliação da qualidade das sementes. Piracicaba: FEALQ,1987. 230p.
MARTINELLI, G. Manejo de populações e comunidades vegetais: um estudo de caso na conservação de Bromeliaceae. In: ROCHA, C. F. G.; BERGALLO, H. G.; VAN SLUYS, M.; ALVES, M. A. S. Biologia da Conservação, Essências. 1 ed. São Carlos: Rima, v. 1, 2006. p. 479-503.
MARTINELLI, G.; VIEIRA, C.M.; GONZALEZ, M.; LEITMAN, P.; PIRATININGA, A.; COSTA, A.F., FORZZA, R. Bromeliaceae da Mata Atlântica Brasileira: lista de espécies, distribuição e conservação. Rodriguésia. v. 59 n. 1, p. 209-258, 2008.
MARTINS, J.R. Aspectos da germinação de sementes e influência da luz no desenvolvimento, anatomia e composição química do óleo essencial em Ocimum gratissimum L. 176p. Dissertação (Mestrado em Fisiologia Vegetal) Universidade Federal de Lavras, Lavras, 2006.
MC WILLIANS, E.L. Evolutionary Ecology. In: Pitcairnioideae (Bromeliaceae) Flora Neotropica. Monograph 14, Part 1. New York: Hafner Press, 1974.
MEDINA, E. Dark CO2 fixation, habitat preference and evolution within the Bromeliaceae. Evolution, Lancaster, v. 28, n. 4, p. 677-686, 1974.
MERCIER, H.; GUERREIRO FILHO, O. Propagação sexuada de algumas bromélias nativas da Mata Atlântica: efeito da luz e da temperatura na germinação. Hoehnea, São Paulo, v. 17, p. 19-26,1990.
MIRANDA, Z.J.G. A informação sobre a flora Bromeliaceae do cerrado: na literatura e nos herbários. 2001. Dissertação (Mestrado em Ciência da Informação – Departamento de Ciências da Informação, Faculdade de Estudos Sociais Aplicados, Universidade de Brasília), Brasília. 264p.
MITTERMEIER, R.A.; GIL, R.P.; HOFFMAN, M.; PILGRIM, J.; BROOKS, T.; MITTERMEIER, C.G.; LAMOREUX, J.; FONSECA, G.A.B. Hotspots Revisited: earth’s biologically richest and most endangered ecoregions. Mexico City: Conservation International, 2005. 392p.
MORAES, J. V. Morfologia e germinação de sementes de Poecilanthe parviflora Bentham (Fabaceae – Faboideae). 2007. Dissertação (Mestrado - Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, Jaboticabal). 78f.
NAKAGAWA, J. Testes de vigor baseados na avaliação das plântulas. In: VIEIRA, R. D.; CARVALHO, N. M. de. Testes de vigor em sementes. Jaboticabal: Funep, 1994. p. 49-86.
NASCIMENTO, W.M.O.; RAMOS, N.P.; CARPI, V.A.F.; SCARPARE FILHO, J.A.; CRUZ, E.D. Temperatura e substrato para germinação de sementes de Parkia platycephala Benth. (Leguminoseae-Mimosoideae). Revista Agricultura Tropical, Cuiabá, v. 7, n. 1, p. 119-129 2003.
NEGRELLE, R.R.B.; MITCHELL, D.; ANACLETO, A. Bromeliad ornamental species: conservation issues and challenges related to commercialization. Acta Scientiarum. Biological Sciences, Maringá, v. 34, n. 1, p. 91-100, Jan.-Mar., 2012.
OLIVEIRA, A.C.C. Biometria e Germinação das sementes de Couratari macrosperma A.C. Smith (Lecythidaceae) e Schizolobium amazonicum Huber ex Ducke (Fabaceae). 94f. Dissertação (Mestrado em Ciências Ambientais) Universidade do Estado de Mato Grosso, Cáceres. 2009.
PAULA, C. C.; SILVA, H. M. P. Cultivo Prático de Bromélias. UFV, Viçosa, 2004. 116p.
PEREIRA, A.R.; ANDRADE, A.C.S.; PEREIRA, T.S.; FORZZA, R.C.; RODRIGUES, A.S. Comportamento germinativo de espécies epífitas e rupícolas de Bromeliaceae do Parque Estadual do Ibitipoca, Minas Gerais, Brasil. Revista Brasileira de Botânica, v. 32, n. 4, p. 827-838, 2009.
PEREIRA, C.; CUQUEL, F.L.; PANOBIANCO, M. Germinação e armazenamento de sementes de Nidularium innocentii (Lem.). Revista Brasileira de Sementes, v. 32, n. 2, p. 36-41, 2010.
PEREIRA, G.P.; CARVALHO, R.I.N.; BIASI, L. A. Qualidade fisiológica de sementes de uva-do-japão após envelhecimento acelerado e armazenamento. Acta Scientiarum, Maringá, v. 32, n. 3, p. 527-532, 2010.
PINA-RODRIGUES, F.C.M.; FIGLIOLIA, M.B.; PEIXOTO, M.C. Teste de qualidade. In: FERREIRA, A. G.; BORGUETTI, F. (Org.). Germinação: do básico ao aplicado. Porto Alegre: Artmed, Cap. 18, 2004. p. 283-297.
PINHEIRO, F.; BORGHETTI, F. Light and temperature requirements for germination of seeds of Aechmea nudicaulis (L.) Griesebach and Streptocalyx floribundus (Martius ex Schultes F.) Mez (Bromeliaceae). Acta Botanica Brasilica, v. 17, p. 27-35, 2003.
PIZZO, M.A. Frugivory and habitat use by fruit-eating birds in a fragmented landscape in southeast Brazil. Ornitologia Neotropical, Quebec, v. 15, p. 117-126, 1994.
POMPELLI, M.F. Germinação de Dyckia encholirioides var encholirioides (Bromeliaceae, Pitcarnioideae). Floresta e Ambiente, v. 13, n. 1, p. 01-09, 2006.
POMPELLI, M.F.; GUERRA, M.P. Micropropagation enables the mass propagation and conservation of Dyckia distachya Hassler. Crop Breeding and Applied Biotechnology, v. 5, p. 117-124, 2005.
PONS, T.L. Seed responses to light. In: FENNER, M. (Ed.). Seeds: the ecology of regeneration in plant communities. Wallingford, CABI Publishing, 2000. p. 237-260.
PONTES, C. A.; CORTE, V. B.; BORGES, E. E. L.; SILVA, A. G.; BORGES, R. C. G. Influência da temperatura de armazenamento na qualidade das sementes de Caesalpinia peltophoroides Benth. (Sibipiruna). Revista Árvore, v. 30, n. 1, p. 43-48, 2006.
POREMBSKI, S.; BARTHLOTT, W. Pitcairnia feliciana: The only indigenous African Bromeliad. Harvard Papers in Botany, v. 4, n. 1, p. 175-184, 1999.
RAPINI, A.; RIBEIRO, P.L.; LAMBERT, S.; PIRANI, J.R. A flora dos campos rupestres da Cadeia do Espinhaço. Megadiversidade, v. 4, p. 16-24, 2008.
REATTO, A.; CORREIA, J.R.; SPERA, S.T. Solos do Bioma Cerrado: aspectos pedológicos. In: SANO, S.M.; ALMEIDA, S.P.; RIBEIRO, J.F. (Eds.). Cerrado: ecologia e flora. Planaltina, Embrapa Cerrados, 2008, p. 108-149.
RIBEIRO, J.F.; WALTER, B.M.T. As principais fitofisionomias do Bioma Cerrado. In: SANO, S.M.; ALMEIDA, S.P.; RIBEIRO, J.F. (Eds.). Cerrado: ecologia e flora. Planaltina, Embrapa Cerrados, 2008, p. 151-212.
ROBERTS, E. H. Predicting the storage life of seeds. Seed Science and Technology, Zurich, v. 1, n. 3, p. 499-514, 1973.
ROCHA, C.F.D.; COGLIATTI-CARVALHO, L.; ALMEIDA, D.R.; FREITAS, A.F.N. Bromélias: ampliadoras da biodiversidade. Revista Bromélia, v. 4, p. 7-10, 1997.
RODRIGUEZ, P.H.V. In vitro establishment of Heliconia rauliniana (Heliconiaceae). Scientia Agricola, Piracicaba, v. 62, n. 1, p. 69-71, 2005.
SALOMÃO, K. Aspectos reprodutivos e micropropagação em Dyckia distachya Hassler, espécie ameaçada de extinção. 81f. Dissertação (Mestrado- Centro de Energia Nuclear na Agricultura, Universidade de São Paulo, Piracicaba). 2013.
SANTANA, D. G.; RANAL, M. A. Análise da germinação: um enfoque estatístico. Brasília, DF: Ed. da UnB, 2004. 248p.
SILVA, A. L. L.; FRANCO, E.T.H.; DORNELLES, E.B.; GESING, J.P.A. Micropropagação de Dyckia maritima Baker – Bromeliaceae. Iheringia, Serie Botânica, Porto Alegre, v. 63, p. 135-138, 2008.
SMITH, L.B.; DOWNS, R.J. Pitcairnoideae. (Bromeliaceae). Flora Neotropica. Monograph, v. 14, part 1, New York, The New York Botanical Garden, 1974.
SMITH, L.B.; DOWNS, R.J. Tillandsioideae. (Bromeliaceae). Flora Neotropica. Monograph, v. 14, part 2, New York, The New York Botanical Garden, 1977.
SMITH, L.B.; DOWNS, R.J. Bromelioideae. (Bromeliaceae). Flora Neotropica. Monograph, v. 14, part 3, New York, The New York Botanical Garden, 1979.
STEHMANN, J.R.; FORZZA, R.C.; SALINO, A.; SOBRAL, M.; COSTA, D.P.; KAMINO, L.Y.K. Plantas da Floresta Atlântica. Rio de Janeiro: Jardim Botânico do Rio de Janeiro. 2009. 516p.
TARRÉ, E.; PIRES, B.B.M.; GUIMARÃES, A.P.M.; CARNEIRO, L.A.; FORZZA, R.C.; MASUR, E. Germinability after desiccation, storage and cryopreservation of seeds from endemic Encholirium Mart. ex Schult. & Schult.f. and Dyckia Schult. & Schult.f. species (Bromeliaceae). Acta Botanica Brasilica, v. 21, n. 4, p. 777-783, 2007.
TEKRONY, D. M. Accelerated aging. In: VAN DE VENTER, H. A. (Ed.). Seed vigor testing seminar. Copenhagen: The International Seed Testing Association, 1995. p. 53- 72.
TOLEDO, F.F.; MARCOS FILHO, J. Manual das sementes: tecnologia da produção. São Paulo, Agronomica Ceres, 1977. 224p.
VIEIRA, D. C. M; SOCOLOWSKI, F; TAKAKI, M. Germinação de sementes de Dyckia tuberosa (Vell.) Beer (Bromeliaceae) sob diferentes temperaturas em luz e escuro. Revista Brasileira de Botânica. v. 30, n. 2, p.183-188, 2007.
VIEIRA, R. D.; CARVALHO, N. M. de; SADER, R. Testes de vigor e suas possibilidades de uso. In: VIEIRA, R. D.; CARVALHO, N. M. de. (Eds.). Testes de vigor em sementes. Jaboticabal: FUNEP, 1994. p. 31-47.
VITTA, F.A. Diversidade e conservação da flora nos campos rupestres da Cadeia do Espinhaço em Minas Gerais. In: ARAÚJO, E.L.; MOURA, A.N.; SAMPAIO, E.S.B., GESTINARI, L.M.S.; CARNEIRO, J.M.T. (eds.). Biodiversidade, conservação e uso sustentável da flora do Brasil. Recife, Imprensa Universitária - UFRPE, 2002. p. 90-94.
WALTER, B.M.T. Fitofisionomias do bioma Cerrado: síntese terminológica e relações florísticas. 389f. Tese (Doutorado em Ecologia), Universidade de Brasília, Brasília. 2006.
WINKLER, M.; HULBER, K.; HIETZ, P. Effect of canopy position and seedling survival of epiphytic bromeliads in a Mexican Humid Montane Forest. Annals of Botany, Oxford, v. 95, p. 1039-1047, 2005.
YANOVIAK, S.P.; NADKARNI, N.M.; GERING, J.C. Arthropods in epithytes: a diversity component that is not effectively sampled by canopy fogging. Biodiversity and Conservation, London, v. 12, p. 731-741, 2003.
Publicado por: Ricardo Costa
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.