Efeito da Luminosidade em Dendrobium
Resumo
No grego “Dendrobium” se define em: “Dendron”, árvore; “bios”, vida, plantas que vivem em árvores ou plantas epífitas. As flores variam em média de 5 a 8 cm, florescem no final do inverno e início da primavera podendo durar em torno de 30 dias. O gênero Dendrobium compreende mais de 300 espécies de orquídeas, sendo um gênero aclimatado no Brasil apresentando somente fins ornamentais. Com objetivo de fornecer dado aos apreciadores que cultivam estas plantas, foi realizado um estudo de campo onde duas espécies deste gênero foram implantadas em quatro grupos com taxas de luminosidade distintas, variando desde a sombra até luz solar direta na mata do Centro Universitário Geraldo Di Biase, Barra do Piraí, a fim de constatar em qual luminosidade apresentariam melhor desenvolvimento. No decorrer do projeto as plantas foram fotografadas a cada mês durante 180 dias, considerando o maior enraizamento e o maior brotamento ambos originados após a implantação. As espécies aclimatadas foram Dendrobium nobile lindley e Dendrobium fimbriatum, ambas originárias da Ásia e no final de 6 meses as plantas apresentaram diferentes resultados. Avaliando estatisticamente observou-se que a espécie Dendrobium nobile lindley do grupo I que residiu em total sombreamento e o grupo IV com luz solar direta somente no período matinal, apresentaram crescimento médio de brotos (3,37 cm ± 1,65 e 4,08 cm ± 1, 13, respectivamente), já o enraizamento das Dendrobium nobile lindley do grupo I apresentou crescimento médio de raiz de 2,10 cm (± 0,58), valor significativamente superior ao das plantas do grupo III e do grupo IV, sendo o grupo III residente ao sol no período da tarde e o grupo IV em sombreamento intenso. Somente as Dendrobium nobile lindley apresentaram dados positivos sendo necessário a continuidade do projeto para que se possa avaliar a aclimatação das Dendrobium fimbriatum. A taxa de luminosidade que se mostrou mais adequada às Dendrobium nobile lindley foi o sombreamento com luz indireta constatado pelo grupo IV e o sol no período da manhã como se verificou no grupo I.
Palavras chave: Aclimatação, estresse, sinapomorfias, sistema radicular, brotamento.
Abstract
In the Greek "Dendrobium " is defined in: “Dendron” , tree; “bios “, life, plants that live in trees or epiphyte plant. The flowers vary on average from 5 to 8 cm, they bloom in the end of the winter and beginning of the spring could last around 30 days. The gender Dendrobium understands more than 300 species of orchids, being a gender acclimatized in Brazil presenting only ornamental ends. With objective of supplying given to the fanciers that cultivate these plants, a field study was accomplished where two species of this gender were implanted in four groups with rates of different brightness, varying from the shade to direct sunlight in the forest of the Academical Center Geraldo Di Biase (UGB), Barra do Piraí, in order to verify in which brightness would present better development. In elapsing of the project the plants were photographed every month for 180 days, considering the largest rooting and the largest budding both originated after the implantation. The acclimatized species were Dendrobium nobile lindley and Dendrobium fimbriatum, both original of Asia and in the end of 6 months the plants presented different results. Evaluating statistically was observed that the species Dendrobium nobile lindley of the group 1 that resided in total shading and the group 4 with direct sunlight only in the morning period, they presented medium growth of sprouts (3.37 cm ± 1.65 and 4.08 cm ± 1.13, respectively), the rooting of Dendrobium nobile lindley of the group 1 already presented medium growth of root of 2.10 cm (± 0.58), value significantly upper to the of the plants of the group 3 and of the group 4, being the group 3 resident in the sun in the period of the afternoon and the group 4 in intense shading. Only the Dendrobium nobile lindey presented positive data being necessary the continuity of the project so that it can evaluate the acclimatization of the Dendrobium fimbriatum. The rate of brightness that was shown more appropriate to Dendrobium nobile lindley it was the shading with indirect sunlight verified by the group 4 and the sun in the period of the morning as it was verified in the group 1.
Words key: Acclimatization, stress, sinapomorfias, system of roots, sprouts.
Lista de ilustrações
| Figura 01 - Dendrobium fimbriatum | 13 |
| Figura 02 - Dendrobium nobile lindley | 13 |
| Figura 03 - Localização dos grupos | 15 |
| Figura 04 - Corte transversal da raiz de uma orquídea epífita | 21 |
| Figura 05 - Orquídea nativa | 23 |
| Figura 06 - Bromélias nativas | 23 |
| Figura 07 - Orquídea em meio rupestre | 24 |
| Figura 08 - Artrópode na planta 03 | 29 |
| Figura 09 - Artrópode na planta 03, aproximado | 29 |
| Figura 10 - Planta 01 com 91 dias | 30 |
| Figura 11 - Planta 01 com 133 dias, roída | 30 |
| Figura 12 - Planta 16 com 91 dias | 31 |
| Figura 13 - Planta 16 com 133 dias, roída | 31 |
| Figura 14 - Passo a passo raiz planta 01 | 32 |
| Figura 15 - Passo a passo raiz planta 12 | 33 |
| Figura 16 - Gráfico de linha para comprimento médio de raízes | 33 |
| Figura 17 - Gráfico de coluna para comprimento médio de raízes | 34 |
| Figura 18 - Broto fotografado aos 180 dias (Grupo II) | 35 |
| Figura 19 - Passo a passo brotamento planta 04 | 35 |
| Figura 20 - Passo a passo brotamento planta 15 | 36 |
| Figura 21 - Gráfico de coluna para comprimento médio de brotamentos | 36 |
| Figura 22 - Gráfico de linha para comprimento médio de brotamentos | 37 |
| Figura 23 - Rebento na planta 11 (grupo III) | 37 |
SUMÁRIO
| 1. INTRODUÇÃO | 10 |
| 1.1 Justificativa | 11 |
| 1.2 Objetivo | 11 |
| 2. METODOLOGIA | 12 |
| 2.1 Método proposto | 12 |
| 2.2 Pesquisa Bibliográfica | 12 |
| 2.3 Trabalho de campo | 12 |
| 2.4 Caracterização da Área | 12 |
| 2.5 Descrição do projeto | 13 |
| 2.6 Formação dos grupos | 14 |
| 3. REVISÃO BIBLIOGRÁFICA | 16 |
| 3.1 Mata atlântica | 16 |
| 3.2 Botânica e a importância da fotossíntese | 18 |
| 3.3 Angiosperma Monocotiledôneas | 18 |
| 3.4 Meristemas | 20 |
| 3.5 Estômatos | 20 |
| 3.6 Sistema radicular das Orquidaceae epífitas | 21 |
| 3.7 Plantas nativas do local | 23 |
| 3.8 Descrição e características das orquídeas | 24 |
| 3.9 Aclimatação | 26 |
| 3.10 Propagação in vitro | 27 |
| 4. RESULTADOS | 29 |
| 4.1 Herbivoria | 29 |
| 4.2 Sistema radicular | 32 |
| 4.3 Brotamentos | 34 |
| 4.4 Rebentos (brotos já existentes) | 37 |
| 5. DISCUSSÃO | 38 |
| 6. CONCLUSÃO | 40 |
| REFERÊNCIAS BIBLIOGRÁFICAS | 42 |
| ANEXOS | 46 |
1. INTRODUÇÃO
A família Orquidaceae dentro da botânica é sem dúvida nenhuma a mais bem sucedida apresentando em torno de 850 gêneros e 20.000 espécies (Souza e Lorenzi, 2005) outros autores relatam diferentes estimativas como, 1.000 gêneros e 30.000 a 35.000 espécies (Dunsterville e Garay, 1959), e 30.000 espécies (Garay, 1960). Dentro da classe Monocotiledônea se encontram na ordem Asparagales, constituindo uma das maiores famílias de plantas floríferas e representam o grupo mais evoluído da super ordem Liliiflorae (Dressler, 1986).
A diversidade de tamanhos, formas e de cores das flores atraem cada vez mais o interesse de colecionadores e comerciantes do mundo inteiro, sendo a Orquidaceae uma das famílias do reino Plantae que mais sofre com a ação antrópica devido ao extrativismo, compreendendo entre 8% e 10% de todas as plantas com flores (Buzatto et al. 2007), Pijl (1966) cita 7% de todas as plantas ornamentais.
A grande maioria das orquídeas adapta-se ao ambiente aéreo sendo assim conhecidas como plantas epífitas, com estimativas de que cerca de 73% das espécies vivem do epifitismo (Atwood, 1986), podendo ainda ser encontradas em meio terrestre ou rupestre quando residentes em rochas (Giulietti et al. 2009). Existem espécies de orquídeas nos quatro cantos do planeta exceto nas áreas polares e nos desertos mais áridos.
Com a evolução dessa família do reino vegetal, surgiram estruturas que permitiram a essas plantas retirarem do ambiente aéreo todos os nutrientes e água necessários para o seu perfeito desenvolvimento, podendo essa coleta ocorrer pelo velame encontrado no sistema radicular ou através de estômatos residentes na parte aérea do vegetal (Raven et. al. 2007b).
Por diversos anos as orquídeas foram julgadas como plantas parasitas, um mito que hoje está muito bem esclarecido quando os estudos mostram que elas retiram seus nutrientes da água das chuvas que escorrem pelas árvores ou do próprio ar, utilizando as árvores somente como suporte para obterem a luz necessária dentro das florestas.
O objetivo desse trabalho foi verificar a limatização de orquídeas do gênero Dendrobium, avaliando a influência de diferentes taxas de luz indireta e direta no desenvolvimento radicular e de brotamentos, servindo como embasamento bibliográfico para adoradores que utilizam dessas plantas para o enriquecimento do paisagismo ou cultivo para o comércio.
1.1 Justificativa.
Justifica-se o seguinte projeto pela intenção de fornecer material de estudo aos interessados no cultivo de orquídeas do gênero Dendrobium, avaliando o efeito da luminosidade na aclimatação de plantas domésticas em um meio natural, demonstrando que as orquídeas epífitas possuem estruturas altamente especializada em retirar do ambiente aéreo todos os ingredientes necessários para o seu perfeito desenvolvimento, não dependendo da ação antrópica, fato esse que demonstra a resistência destes vegetais, quando muitos as julgam plantas frágeis. Além disso, este estudo visa também atrair novos projetos científicos voltados para a Botânica e Zoologia no UGB Campus Barra.
1.2 Objetivo.
O referido projeto foi elaborado com o propósito de avaliar o efeito da luminosidade na aclimatação das orquídeas do gênero Dendrobium, e fornecer dado a cultivadores que utilizam as Dendrobium no enriquecimento do paisagismo, muitas vezes não obtendo êxito no cultivo dessas plantas floríferas. A intensidade de luminosidade tem efeitos positivos ou negativos nas plantas, dependendo da sua intensidade. O autor visa levar aos futuros universitários o interesse em realizar trabalhos científicos voltados para a Botânica e Zoologia no local, estudos que ainda se encontram muito precários no UGB Campus Barra do Piraí.
2. METODOLOGIA
2.1 Método proposto.
Para este trabalho foram utilizados métodos de pesquisa bibliográfica e trabalho de campo, visando obter melhor conhecimento para o desenvolvimento e conclusão do projeto.
SegundoMarconi e Lakatos (2002), as pesquisas podem ser básica pura ou fundamental, e pesquisa aplicada. Alguns autores mencionam outros tipos de pesquisa ressaltando as pesquisas exploratória, explicativa, descritiva, de ação e o estudo de caso. Diferentes métodos de pesquisa podem ser utilizados, variando de acordo com o objetivo a ser alcançado.
2.2 Pesquisa Bibliográfica.
A Pesquisa bibliográfica pode ser feita de duas formas ou etapas:
- Pesquisa Documental: antes de iniciar qualquer pesquisa de campo, o primeiro passo é a análise minuciosa de todas as fontes documentais que sirvam de suporte à investigação projetada.
- Pesquisa Bibliográfica: é um apanhado geral sobre os principais trabalhos já realizados, sendo de suma importância por fornecerem dados atuais e relevantes relacionados com o tema.
2.3 Trabalho de campo.
Este tipo de trabalho tem por objetivo a observação ou coleta de materiais para estudo, em uma determinada área, este tipo de pesquisa é muito utilizado nas áreas biológicas. Este tipo de estudo, exige do pesquisador grande equilíbrio intelectual e capacidade de observação, também chamado de olho clínico.
2.4 Caracterização da Área.
A área definida para realização do projeto foi a mata de em torno ao Centro Universitário Geraldo Di Biase (UGB), localizado na Rodovia Benjamin Ielpo, Barra do Piraí, nas proximidades do km 11 da estrada Barra do Piraí-Valença.
O UGB apresenta um espaço conceituado tanto em extensão como em área construída, possui grande estrutura que abrange diversas disciplinas que envolvem desde a área educacional até a área médica e comercial. Em torno das acomodações do UGB, existem fragmentos de Mata Atlântica secundária que circundam em média 65 % do Centro de ensino favorecendo estudos científicos locais sobre flora, fauna e outros.
2.5 Descrição do projeto.
Para realização do projeto, 16 plantas do gênero Dendrobium, Dendrobium nobile lindley e Dendrobium fimbriatum, de um jardim doméstico foram obtidas por meio de doação e implantadas em diferentes taxas de luminosidade um meio natural, para adquirirem por meios próprios os nutrientes e umidade adequada, fatores esses essenciais para o desenvolvimento dos vegetais, logo abaixo podem ser visualizadas nas figuras 01 e 02 as duas espécies utilizadas para o desenvolvimento do projeto.
Figura 01: Dendrobium fimbriatum.

Fonte: Macedo, A. M., 2010.
Figura 02: Dendrobium nobile lindley.

Fonte: Macedo, A. M., 2010
Para o delineamento experimental foram formados quatro grupos composto por quatro indivíduos de Dendobrium cada um. Estes grupos foram colocados em ambientes com diferentes taxas de luminosidade, que variam desde a sombra até maior incidência de luz solar. O material utilizado para fixação das plantas foram barbante e arame que serão retirados no final do projeto. Lacres com numeração de 01 a 16 foram implantados para melhor controle entre as plantas e também serão retirados no término do projeto.
Após 21, 49, 91, 133 e 180 dias da implantação do experimento foram realizadas medidas de desenvolvimento radicular, baseando-se no comprimento da maior raiz originada após a implantação, e de tamanho do maior brotamento, sendo avaliado o crescimento médio por grupo de cada uma das duas variáveis de acordo com o tempo de amostragem.
Durante o acompanhamento do projeto, que teve início no dia 17 de abril de 2010, uma câmera fotográfica será de uso indispensável para que haja registro fotográfico do desenvolvimento radicular e brotamentos durante os 180 dias de experimento, sendo concluído em 16 de outubro do mesmo ano.
Os resultados foram discutidos a partir de bibliografias especializadas como enciclopédias, livros e artigos científicos de revistas conceituadas, a fim de mostrar que tais plantas apresentam grande capacidade de limatização, sendo muito bem sucedidos em um ecossistema natural, mesmo sofrendo mudanças bruscas de ambiente.
2.6 Formação dos grupos.
Alguns locais da mata de em torno do UGB foram visitados na intenção de encontrar diferentes condições de luminosidade. Durante o processo de escolha alguns fatores foram levados em consideração, tais como o acesso. Sendo plantas epífitas, foi selecionado um local onde a vegetação proporcionasse uma maior praticidade, tanto na implantação como na observação do desenvolvimento uma vez que as plantas foram acompanhadas e fotografadas durante seis meses.
Quatro grupos cada um contendo quatro exemplares foram criados (Figura 03):
GRUPO I - Na sombra, porém com alguns raios solares na parte da manhã, trata-se de um local com claridade intensa e persistente durante todo o dia.
GRUPO II – Em uma clareira, embora o local seja cortado por um riacho o ar não se mostra muito úmido durante o dia, devido à incidência de luz solar direta durante todo o dia.
GRUPO III – Na sombra, este local também é cortado pelo riacho, porém, com raios solares durante algumas horas no período da tarde, trata se de um local com mais sombra no período da manhã devido à vegetação de grande porte e o deslocamento do sol.
GRUPO IV – Neste local a incidência de luz solar direta é descartada, garantindo ao ambiente umidade considerável durante todo o dia.
Figura 03: Localização dos grupos.

Fonte: Google earth, 09-2010.
3. REVISÃO BIBLIOGRÁFICA
3.1 AMata Atlântica.
Ainda no século XIX, o jovem naturalista Carl Friederich Philipp Von Martius fez inventários durante cerca de três anos no Brasil (1817-1820) e publicou, em 1824, junto com o herpetólogo J.B. Spix, “Viagens ao Brasil”. Em seguida, Martius publicou, em 1837, o primeiro mapa fitogeográfico do Brasil, “Tabulae Physiognomicae”. Nesta publicação, identifica no subcontinente províncias botânicas às quais atribui nomes de ninfas gregas. A província denominada Dríades (ninfa dos bosques), ocupando um estreito cinturão ao longo da costa Atlântica, corresponde ao que atualmente se define como Mata Atlântica.
A partir dos trabalhos de Martius foi também possível situar os limites originais desta floresta ao norte. Vale lembrar que também foi neste bioma que o jovem Charles Darwin teve sua primeira experiência com a fauna e flora tropical, em 1836, visitou a Bahia e ficou fascinando com o esplendor da floresta (POR, 1992).
A expressão Mata Atlântica, adotada por vários autores, indica simplesmente a proximidade da floresta com o Oceano Atlântico. Esta formação deve sua exuberância à grande umidade do ar, trazida pelos ventos marinhos. Segundo a classificação técnica de Köeppen, o clima ao longo da Mata Atlântica varia entre os tipos tropical, tropical de altitude e subtropical, com temperaturas médias entre 14-21ºC, chegando à máxima absoluta a 35ºC, se tornando um excelente bioma que acomoda diversas espécies vegetais e animais, podendo até aclimatar espécies indenes a estes ecossistemas, como por exemplo, orquídeas de diversas regiões que possuem grande poder de aclimatação, e a dispersão de sementes ocorrem pelo vento podendo ser levadas a longas distâncias.
Das orquidáceas nativas do Brasil, em seu maior número se encontram em florestas de Mata Atlântica sendo que o estado do Espírito Santo possui cerca de 60% dos gêneros e 25,53% das espécies de orquídeas citadas para o Brasil (Ruschi, 1996), com proporção estimada em 75% sendo epífitas dependentes da heterogeneidade ambiental proporcionada pela diversidade do estrato arbóreo e com alta especificidade de polinização (Huston, 1994).
A Mata Atlântica brasileira representa um dos biomas terrestres mais biodiversos do planeta e, ao mesmo tempo, um dos mais ameaçados pela ação antrópica, restando cerca de 8% de sua cobertura original, o lucro da floresta não está só na madeira, destaca a economista doméstica Adriana Maria Nolasco, professora da Esalq, co-coordenadora do projeto temático e responsável pelo tema “Aproveitamento dos Recursos Florestais”, quando fizeram a caracterização dos diversos tipos de caixetais, os pesquisadores descobriram que as árvores abrigam, no alto, grande número de epífitas, como bromélias e orquídeas. Na derrubada tradicional da floresta, as orquídeas ficam abandonadas no chão, para morrer.
Assim, um dos trabalhos dos pesquisadores vem sendo o de identificar e quantificar essas epífitas e determinar seu potencial econômico. Já existe uma classificação das plantas por espécie e tamanho, segundo Adriana. No entanto, para que essa nova fonte de renda se transforme em realidade, será necessário introduzir uma legislação específica, pois a legislação atual limita a colheita de bromélias e orquídeas nativas.
As florestas tropicais úmidas ocupam 7% da superfície da terra e são considerados os ambientes mais ricos em biodiversidade, abrigando mais de 50% do total das espécies nas terras emersas do planeta (MYERS et al., 2000). A Mata Atlântica é uma das maiores áreas de floresta tropical, ocupando o segundo lugar em extensão nas Américas, logo após a Floresta Amazônica (POR, 1992).
Neste cenário de desmatamento, os esforços de síntese de informações técnicas para definir estratégias de preservação, subsidiar a criação de novas unidades de conservação, elaborar e programar planos de manejo ainda que bem sucedidos, serão insuficientes para refrear a perda de biodiversidade na Mata Atlântica. A expectativa é de que a extinção inercial possa levar à perda de cerca de 50% das espécies aí existentes, tendo como paradigma clássico a teoria de biogeografia de ilhas, caso não seja possível restabelecer a conexão funcional ou física entre os fragmentos remanescentes e difusos na matriz extensiva de ambientes modificados ou dominados pelas atividades humanas.
Se não houver uma rede significativa de unidades de conservação bem estabelecidas e com planos de manejo implantados, não haverá solução possível. Hoje em dia diversos pesquisadores utilizam um método bastante eficaz, o cultivo in vitro, que se caracteriza pela enorme propagação de mudas em estufas, até o período de aclimatação dessas mudas de volta ao seu habitat ou em áreas de reflorestamento, podendo ainda ser comercializadas com o propósito de evitar o extrativismo desordenado.
3.2 Botânica e a importância da fotossíntese.
As plantas são basicamente um grupo terrestre, um de diversas linhagens evolutivas constituído basicamente de organismos multicelulares. As plantas que evoluíram das algas verdes adquiriram uma série de características especializadas que as favorecem na vida na terra. As plantas vasculares são bem mais desenvolvidas por apresentarem cutícula cerosa, onde podemos encontrar aberturas especializadas, os estômatos que garantem as trocas gasosas, e um eficiente meio de condução, o xilema, onde a água e minerais absorvidos passam das raízes para os caules e folhas, e o floema, que transporta os produtos da fotossíntese para todas as partes da planta (Raven et al., 1996a).
O processo fotossintético é primordial para a vida nesse planeta. Quando uma partícula de luz excita uma molécula de clorofila, um de seus elétrons absorve esta energia e é lançado para um nível energético mais elevado, onde converte esta energia em energia química, sendo este processo conhecido como fotossíntese. Com algumas poucas exceções, todo ser vivo no planeta é dependente desta energia momentaneamente ganha por tais elétrons. Uma vez que a luz é convertida na forma química, se torna disponível como fonte de energia a todos os seres, sendo nós humanos totalmente dependentes da fotossíntese (Raven et al., 1996a).
Com o aparecimento das plantas surgiram os biomas, grandes associações de plantas e animais, e a interação entre os sistemas interativos, biomas e os ambientes circundantes não-vivos são chamados de ecossistemas.
As plantas se utilizam de uma estratégia alternativa. As raízes fixam as plantas ao substrato e absorvem a água necessária para a manutenção do corpo vegetal e para a fotossíntese, enquanto o caule garante o suporte dos principais órgãos fotossintetizantes, as folhas.
3.3 Angiospermae Monocotiledôneas.
O nome angiosperma é derivado do grego angeion, que significa vaso, recipiente, e sperma, que significa semente. Por mais de 100 milhões de anos as Angiospermas tem dominado o planeta, constituem-se na divisão Anthophyta e representam o grupo de maior diversidade entre as plantas terrestres, que inclui cerca de 235 mil espécies, sendo a maior divisão de organismos fotossintetizantes (Raven et al., 1996 a), esse sucesso se deve a adaptações vegetativas e reprodutivas. São caracterizadas principalmente por possuírem óvulo e sementes encerrados em um ovário. A flor é, portanto, seu órgão reprodutivo e os eixos florais geralmente portam cálice e corola que juntos constituem o perianto.
As características vegetativas das Angiospermas são muito diversas. O tamanho varia desde 100 metros de altura e 20 metros de circunferência, (por exemplo, Eucalyptus sp.), até algumas monocotiledôneas flutuantes e simples, que medem até um milímetro de comprimento (Raven et al., 1996a).
Dentro da divisão Anthophyta encontramos as monocotiledôneas que isoladamente formam um grupo monofilético de aproximadamente 65.000 espécies (Raven et al., 1996a), suportado por sinapomorfias como folhas com nervuras paralelas, embrião com um único cotilédone, raízes adventícias e caule com sistema vascular disperso no córtex.
A maioria das monocotiledôneas que formam tecido protetor apresenta método peculiar de desenvolvimento. Células de parênquima em posições sucessivamente mais profundas dividem-se várias vezes em sentindo periclinal e os produtos de tais divisões se suberizam, a primeira raiz vive apenas por um período curto de tempo e o sistema radicular da planta é formado por raízes adventícias que se originam no caule, frequentemente em conecção com gemas axilares (Esau, 1974).
As folhas das monocotiledôneas são, em regras gerais, simples, inteiras, não estipuladas e com nervuras paralelas. Suas flores são, na maioria, nuas e com as peças florais, tipicamente, em múltiplos de três. Incluem, por exemplo, as orquídeas, as tulipas, os lírios, antúrios, íris, as gramíneas e as palmeiras.
As raízes adventícias também se ramificam formando um sistema radicular relativamente homogêneo, denominado sistema fasciculado e está relacionada com os processos de fixação, absorção, armazenamento e condução de seiva. A fixação pode assumir um aspecto sob forma de raízes contráteis, estas se encontram amplamente distribuídas entre as monocotiledôneas e dicotiledôneas herbáceas perenes, ocorre a contração das raízes adventícias, onde o promeristema caulinar é aproximado do substrato, em algumas plantas bulbosas certas raízes são especializadas como contráteis (Esau, 1974; Raven et al., 1996 a).
A mais completa relação publicada de Orchidaceae para o Distrito Federal é encontrada em Pabst e Dungs (1975; 1977), onde são apresentados 52 gêneros e 159 espécies. Uma segunda lista, fornecida por Filgueiras e Pereira (1994), apresenta algumas adições (52 gêneros e 162 espécies), diversos outros projetos foram desenvolvidos com o objetivo não só de atualizar as listas de Pabst e Dungs (1975; 1977), mas também registrar resultados de 21 anos de um levantamento sistemático das Orchidaceae no DF (Batista e Bianchetti, 2003).
3.4 Meristemas
Certas células dos meristemas se dividem de tal modo que uma das resultantes se torna numa nova célula do corpo e a outra permanece no meristema, as células meristemáticas tem um duplo papel, perpetuar-se e formar novas células do corpo. Certas células do meristema atuam como iniciais, porque ocupam posições adequadas para desempenhar tal atividade. Os meristemas apicais de raízes e caules das plantas vasculares superiores contém grupos de células iniciais. No processo de atividade meristemática, a divisão celular combina-se com aumento de volume de produtos resultantes da divisão. O aumento do volume celular ocorre a partir do tecido meristemático mais jovem para o mais velho.
Ao comparar células que completaram sua diferenciação, percebe-se que algumas se diferenciaram mais que as outras, o mais alto grau de mudança está associado à especialização mais acentuada em relação ao papel que as células desempenham no corpo vegetal (Esau, 1974). A aquisição de uma forma particular ou configuração é conhecida como morfogênese, do grego morphe, que significa forma, e da palavra latina generare, que significa criar.
3.5 Estômatos
Os estômatos são aberturas na epiderme, limitados por duas células epidérmicas especializadas, as células-guardas, que mediante mudança de formato ocasionam a abertura e o fechamento da fenda, os estômatos podem ser circundados por células que não diferem das demais ou por células que diferem em formato e as vezes em conteúdo, das células epidérmicas comuns. Estas células diferentes são denominadas subsidiárias do estômato e podem ou não estar relacionadas ontogeneticamente as células-guardas (Esau, 1974).
Os estômatos ocorrem em todas as partes aéreas das plantas, com exceção das raízes, sendo mais abundantes nas folhas. A freqüência dos estômatos varia em diferentes partes da mesma folha e em diferentes folhas da mesma planta, sendo influenciada pelas condições ambientais. Podem ocorrer em ambas as faces da folha ou em uma só, neste caso se encontram na face inferior (face abaxial).
A fenda entre as células-guardas das monocotiledôneas, é estreita na região mediana e alargada em ambas as extremidades. A parte central estreita tem parede muito espessa, enquanto as extremidades bulbosas as têm mais delgadas. A abertura e fechamento resultam de mudanças do tamanho das extremidades bulbosas. Quando elas intumescem o estômato se abre (Esaú, 1974).
3.6 Sistema radicular das Orquidaceae epífitas
Raízes aéreas são raízes adventícias que precisam de oxigênio para a respiração, razão pela qual grande parte das plantas não pode viver em substratos sem drenagem adequada, consequentemente sem aeração. Ela possui especialidades em fixação, absorção, reserva e condução (Esau, 1974; Raven et al., 1996a) sendo composta de três camadas distintas que circundam o xilema primário, mais externamente encontra-se o velame ou epiderme múltipla, logo abaixo uma camada mediana denominada córtex e mais internamente o cilindro vascular (Raven et al. 2007b).
A epiderme das raízes aéreas de Orquidaceae desenvolve-se em tecido multisseriado (velame), que é formado de células mortas dispostas compactamente, que freqüentes vezes apresentam paredes com espessamentos secundários (figura 04). O tecido em questão é interpretado de ordinário, como sendo um tecido de absorção. Certas pesquisas de natureza fisiológica, feitas com velame de orquídeas, indicaram que a função principal do tecido é desenvolver proteção mecânica e redução da perda de água do córtex (Esau, 1974).
Figura 04: Corte transversal da raiz de uma orquídea epífita.
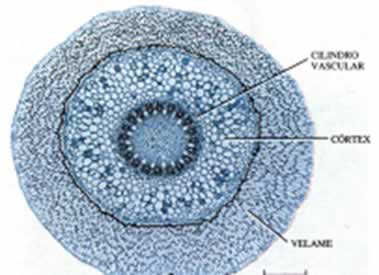
Fonte: Raven, 1996.
As raízes novas em crescimento possuem maior poder de nutrição ao vegetal, tal função desempenhada pela interação do velame auxiliado de fungos micorrizas (Raven et al., 2007b).
Nas monocotiledôneas a raiz primária comumente tem vida curta e o sistema radicular se origina do caule. Essas raízes adventícias e suas raízes laterais dão origem a um sistema radicular fasciculado, no qual nenhuma raiz é mais importante do que as outras. A superficialidade dos sistemas radiculares fasciculados e a grande coesão com que se fixam as partículas do substrato fazem com que sejam muito bem sucedidas ao ambiente aéreo.
A distância com que se espalham as raízes lateralmente e longitudinalmente depende de vários fatores, incluindo umidade, temperatura e composição do substrato, quanto mais expandido maior capacidade de fixação ao suporte e maior absorção de matéria inorgânica, não apresentam crescimento secundário, por isso consistem completamente em tecidos primários, permanecendo com uma composição predominantemente primária (Raven et al., 2007b).
O córtex ocupa a maior área do corpo primário da maioria das raízes, as células do córtex armazenam amido e outras substâncias, mas comumente não possuem cloroplastos. O tecido cortical contém numerosos espaços intercelulares contendo ar, essenciais para a aeração da raiz. A camada mais interna do córtex possui um arranjo compacto e carece de espaços de ar, essa camada denomina-se endoderme que contém protoplastos, estes possuem conecção denominadas plasmodesmas com o córtex e com o cilindro vascular.
O cilindro vascular consiste em tecidos vasculares e em uma ou mais camadas de células, o periciclo, que circunda completamente os tecidos vasculares, o periciclo é constituído de células parenquimáticas com paredes primárias, o centro do cilindro vascular é ocupado por um núcleo sólido de xilema primário de onde partem projeções que se estendem em direção ao periciclo (Raven et al., 2007b).
Através do xilema água e íons orgânicos são absorvido pelas raízes e levados a parte aérea das plantas, são levados juntamente com esta seiva bruta hormônios sintetizados na região meristemática do sistema radicular e na região apical estimulam o crescimento e o desenvolvimento do vegetal (Raven et al., 1996a).
3.7 Plantas nativas do local
No local onde foi implantado o GRUPO III algumas plantas epífitas foram encontradas e fotografadas comprovando que o local se mostra propício ao epifitismo. Dentre as plantas nativas se destacaram exemplares da família Bromeliaceae e da família Orquidaceae (Figuras 05 e 06).
Figura 05: Orquídea nativa.

Fonte: Macedo, A. M., 2010
Figura 06: Bromélias nativas.

Fonte: Macedo, A. M., 2010
A planta nativa que mais chamou a atenção no local do GRUPO III foi uma espécie de orquídea em meio rupestre, que pode ter levado anos para se adaptar em tal ambiente (figura 07).
Figura 07: Orquídea em meio rupestre.

Fonte: Macedo, A. M., 2010
3.8 Descrição e características das orquídeas.
As orquídeas são plantas herbáceas da classe monocotiledônea, em geral os caules e raízes dos representantes desta, não apresentam crescimento secundário em espessura, mas existem raríssimas exceções. A grande maioria dos representantes possui nervuras paralelas e em geral apresentam uma larga bainha, a flor apresenta-se organizada seguindo um plano trímero (Vidal e Vidal, 2000), o sistema radicular é do tipo fasciculado e constitui um grupo tão antigo quanto as dicotiledôneas, baseado na história dos fósseis conhecidos (Joly, 1991).
As orquídeas são adaptadas à polinização por vespas, mariposas, borboletas, moscas e alguns beija-flores, porém, cerca de 60% das espécies de orquídeas são polinizadas por abelhas (Ingrouille, 1995).
Possuem sinapomorfias destacando-se flores fortemente zigomorfas, uma pétala mediana diferenciada das pétalas laterais denominada labelo, o gineceu e o androceu se apresentam em uma junção formando um órgão chamado coluna ou ginostêmio, outra de suas sinapomorfias são sementes desprovidas de endosperma e com embrião diminuto (Souza e Lorenzi, 2005, p. 106).
As orquídeas vivem por muitos anos sendo denominadas perenes, habitam diferentes meios podendo ser terrestre, saprófitas quando desprovidas de clorofila, rupestres ou epífitas. São rizomatosas ou caulescentes, com crescimento simpodial ou monopodial (Souza e Lorenzi, 2005).
As folhas em geral são mais ou menos suculentas, a floração pode ocorrer isolada, em cachos, racemos ou raramente em espiga, com perianto petalóide contendo peças livres, composto de seis elementos, sendo três externos denominados sépalas, muito semelhante a duas das pétalas laterais, a terceira pétala é mediana, apresenta forma e geralmente a cor bastante diferenciada chamada de labelo, onde está a coluna contendo em sua extremidade a antera que abriga de dois a oito políneas contendo os grãos de pólen que variam em número de gênero para gênero.
Apresentam ovário ínfero contendo muitos óvulos e o fruto é do tipo capsular. As sementes com ausência de endosperma e embriões não diferenciados são facilmente dispersas pelo vento devido a sua leveza.
No grego “Dendrobium” se define em: “Dendron”, árvore; “bios”, vida. Plantas que vivem em árvores ou plantas epífitas. Formam grandes touceiras, apresentam pseudobulbos sulcados, cilíndricos e eretos podendo variar de 45 cm até 1,5 m de altura e tornam-se pêndulos com a idade, com nós e entrenós bem marcados na cor verde.
As folhas são curtas, flexíveis e finas e estão inseridas nestes nós, ao longo dos pseudobulbos de onde também surgem as flores, que variam em média de 5 a 8 cm, florescem no final do inverno e início da primavera podendo durar em torno de 30 dias, dependendo da região e da temperatura. Possuem folhas duplas distribuídas lateralmente e que caem no período de floração ou aclimatação.
As Dendrobium apresentam crescimento monopodial, ao longo da haste floral, numa época de estado vegetativo da planta costumam surgir brotos que podem ser utilizados para propagação vegetativa, podendo ser multiplicada pela divisão de touceira e por dispersão de sementes que compreende um processo natural com auxilio de polinizadores e do vento.
Segundo Silva (1986), o gênero Dendrobium compreende mais de 300 espécies de orquídeas, outros autores relatam de 1000 a 1400 espécies de Dendrobium, com plantas epífitas nativas de Birmânia, Índia, Tailândia e China, sendo um gênero aclimatado no Brasil (Souza e Lorenzi, 2005; Joly, 1991).
As Dendrobium necessitam de luminosidade indireta ou difusa intensa, para que desenvolvam pseudobulbos saudáveis, toleram taxas variáveis de luz solar direta, podendo este queimar suas folhas, dentre os gêneros introduzidos no Brasil, o Dendrobium se destaca somente para fins ornamentais (Joly, 1991; Souza e Lorenzi, 2005).
Na natureza, as orquídeas epífitas crescem sobre as árvores, tendo como substratos materiais orgânicos fibrosos depositados no tronco (Demattê e Demattê, 1996). A umidade necessária vem das precipitações pluviométricas, do orvalho noturno e da umidade relativa do ar. Quando o substrato se encontra em condições ideais de textura e drenagem, a água é adsorvida por uma estrutura esponjosa que recobre as raízes denominadas de velame, formada por camadas sobrepostas de células mortas (Batchelor, 1981; Demattê e Demattê, 1996).
3.9 Aclimatação.
Segundo Alves et al. (2008), aclimatação é um processo no qual as plantas ou outros organismos se tomam ajustados a um novo clima ou situação, como resultado de um processo essencialmente natural. Em trabalhos de enriquecimento de áreas degradas uma desvantagem da implantação de espécies é a necessidade de um período de aclimatização. A limatização é definida como a adaptação climática de um organismo, especialmente uma planta, que é transferida para um novo ambiente, sendo todo esse processo antrópico (Tombolato e Costa, 1998).
Durante a fase de aclimatação é bastante comum o vegetal passar por estresse. A umidade relativa, a fotossíntese e a absorção de nutrientes são fatores essenciais para que as plantas apresentem boas condições de desenvolvimento. As orquídeas sobrevivem a estiagem prolongada, mas podem morrer se não houver drenagem apropriada.
Nas orquídeas ocorrem inúmeras adaptações morfológicas e funcionais relacionadas ao epifitismo (Oliveira e Sajo, 1999). A epiderme da raiz de orquídea tem várias camadas de espessura e, em algumas espécies é o único órgão fotossintético da planta, esta epiderme múltipla, denominada velame, é capaz de absorver água e sais minerais, reduzir a transpiração e oferecer proteção mecânica ao córtex, mas sem parasitar a planta onde residem (Raven et al., 1996a).
Outra adaptação é a ocorrência de pseudobulbos que armazenam água e auxiliam na manutenção do balanço hídrico da planta, em situações onde há pouca disponibilidade desse elemento, em muitas espécies epífitas que carecem de pseudobulbos, o mesófilo possui células com espessamento espiralado, que armazenam água e evitam o colapso do tecido durante os períodos de dessecação (Oliveira e Sajo, 1999).
Adaptações fisiológicas também são observadas na família Orquidaceae, sendo comum a ocorrência de metabolismo CAM, que representa um eficiente mecanismo de economia hídrica, mantendo seus estômatos fechados durante o dia e abrindo no período noturno (Braga, 1987).
A auxina é a classe de reguladores de crescimento vegetal responsável pelo aumento consistente da formação de primórdios radiciais em tecidos que naturalmente apresentam certa predisposição ao enraizamento (Raven et al., 2007b). O ácido naftalenoacético (ANA) faz parte do grupo de auxinas sintéticas que apresentam grande importância agrícola.
3.10 Propagação in vitro
A produção in vitro é uma prática que tem alcançado uma evidência cada vez maior, tendo em vista seus benefícios comerciais e ecológicos (Araújo et al., 2006). Sob o ponto de vista ambiental as plantas produzidas desta forma são altamente interessantes para programas de reintrodução de espécies nativas em áreas de preservação ambiental. Por outro lado, as vantagens proporcionadas pela sua produção in vitro incluem maiores percentuais de germinação em comparação com a germinação em condições naturais, uma vez que esta é dependente da infecção por fungos micorrízicos simbiontes, muitas vezes altamente específicos no caso das orquídeas (Araújo et al., 2006).
A micropropagação, multiplicação in vitro ou multiplicação em meio de cultura, consiste na separação de algumas células de tecido vegetal, ápices caulinares, e cultivo das mesmas em ambiente controlado, fazendo com que ela se reproduza e forme uma nova planta.
Muller (2007) realça em seu projeto científico que espécies de orquídeas estão desaparecendo de seus habitats naturais, devido ao extrativismo e à destruição do ecossistema onde estão inseridas, causando também a evasão dos polinizadores, dificultando a propagação e reprodução das mesmas.
Estudo testando variadas taxas de sacarose em diferentes meios de cultura, obteve resultados satisfatórios em meios de cultura MS e Knudson, proporcionando melhor sobrevivência e desenvolvimento das plântulas de Dendrobium nobile (Sorace et al., 2007). Um outro meio de cultura nutritivo formulado com adubo comercial, sacarose, banana e ágar, mostrou-se bastante eficiente para o crescimento e enraizamento da orquídea Dendrobium nobile (Sorace et al., 2007).
O enraizamento é uma etapa que define o resultado final da micropropagação. É a etapa onde ocorre a formação de raízes adventícias nas partes aéreas. O sistema radicular é responsável por sustentar a planta e fornecer toda a água e nutrientes ao corpo do vegetal.
Pode ser dividido em indução, iniciação e alongamento das raízes (Torres, 1998). Pode ser realizada tanto in vitro como no ambiente externo, porém resultados mais satisfatórios para a maioria das espécies tem sido obtidos no enraizamento ex vitro.
As técnicas de cultivo in vitro por meristema ou semeaduras garantem às orquídeas o cultivo em grande escala pela ação antrópica sem que ocorra o extrativismo desordenado, podendo ainda ser aclimatadas em locais endêmicos ou indenes às espécies. Graças a produção de mudas em grande escala que o extrativismo vem deixando de crescer e diversas espécies de plantas ainda não foram extintas.
Diversos projetos estão sendo desenvolvidos com o propósito de formular meios de cultura caseiros ou industrializados, para obtenção de melhores resultados na propagação de mudas de diversos vegetais, uma forma de produzir maiores quantidades de mudas em um espaço de tempo menor que o processo natural.
Alguns autores apresentam excelentes resultados na propagação de orquídeas, bromélias e outros vegetais através do cultivo in vitro por semeadura ou meristemas (Moraes et al., 2002; Junior et al., 2010; Alves et al., 2008; Souto et al., 2010; Martini, 2000).
4. RESULTADOS
Os grupos I, III e IV apresentaram diferentes resultados quando analisados estatisticamente, tanto para o desenvolvimento do sistema radicular como para brotamentos, porém em algumas análises ocorrendo compatibilidade nos resultados relativos ao crescimento médio de cada grupo aclimatado.
4.1 Herbivoria
Dos 91 aos 133 dias ocorreu regressão no tamanho das raízes e brotamentos devido a herbivoria causada por artrópodes (figuras 08 e 09), fenômeno exemplificado com aplanta 01do grupo I onde apresentava 8 cm de raiz com 91 dias e aos 133 dias 1,4 cm (figuras 10 e 11) e o brotamento da planta 16 do grupo IV que com 91 dias apresentava 2,8 cm de desenvolvimento e aos 133 dias se encontrava com 2 cm (figura 12 e 13).
Figura 08: Artrópode na planta 03.

Fonte: Macedo, A. M., 2010
Figura 09: Artrópode na planta 03, aproximado.

Fonte: Macedo, A. M., 2010
Figura 10: Planta 01 com 91 dias.

Fonte: Macedo, A. M., 2010
Figura 11: Planta 01 com 133 dias, roída.

Fonte: Macedo, A. M., 2010
Figura 12: Planta 16 com 91 dias.

Fonte: Macedo, A. M., 2010
Figura 13: Planta 16 com 133 dias, roída.

Fonte: Macedo, A. M., 2010.
4.2 Sistema radicular
Quanto ao crescimento de raiz, as plantas do grupo I apresentaram crescimento médio de raiz de 2,10 cm (± 0,58), valor significativamente superior ao das plantas do grupo III (0,32 cm ± 0,22) e do grupo IV (0,85 cm ± 0,25) (ANOVA; F=14; P=0,0026) (figuras 14 e 15). O crescimento de raiz das plantas dos grupos III e IV não diferiram estatisticamente (figuras 16 e 17).
Considerando o tempo de amostragem foram observadas diferenças estatísticas entre as amostragens realizadas ao longo dos seis meses após a implantação do experimento (ANOVA; F=4; P=0,0398). Apenas as plantas do grupo IV apresentaram o crescimento de raiz relacionado diretamente com o tempo de amostragem (regressão linear; R2=0,98; P=0,0003).
Figura 14: Passo a passo raiz planta 01.

Fonte: Macedo, A. M., 2010
Figura 15: Passo a passo raiz planta 12.

Fonte: Macedo, A. M., 2010
Figura 16: Gráfico de linha para comprimento médio de raízes.
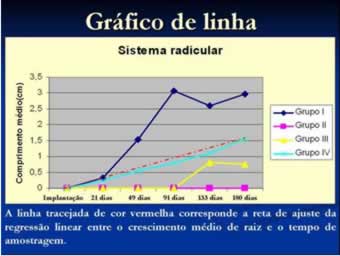
Fonte: Macedo, A. M., 2010.
Figura 17: Gráfico de coluna para comprimento médio de raízes.
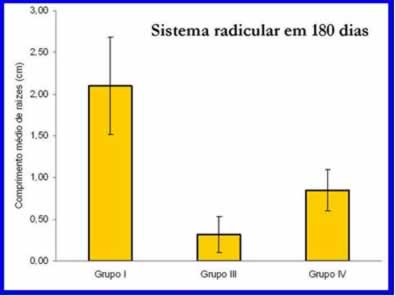
Fonte: Macedo, A. M., 2010.
4.3 Brotamentos
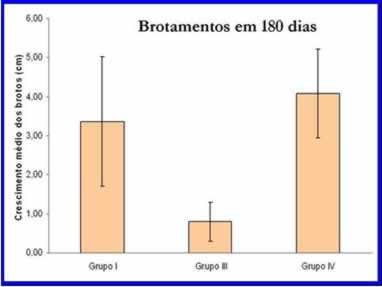
Quanto ao crescimento de brotos, as plantas do grupo II só apresentaram crescimento nos últimos 15 dias e por isso não foram analisadas estatisticamente. As plantas do grupo I e do grupo IV (figuras 19 e 20) apresentaram crescimento médio de brotos (3,37 cm ± 1,65 e 4,08 cm ± 1, 13, respectivamente) significativamente maior que as plantas do grupo III (0,80 cm ± 0,50) (ANOVA; F=7,8; P=0,0147). No entanto, o crescimento médio de brotos das plantas do grupo IV não apresentou diferenças estatísticas com as plantas do grupo I (figuras 21 e 22).
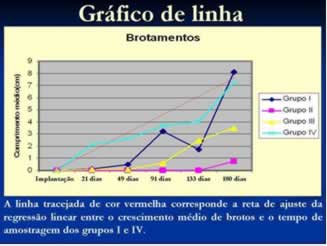
Na finalização do projeto, um brotamento na planta 08 do grupo II com 3 cm,D. nobile lindley, foi observado, mas não entrou nas análisesestatísticas (figura 18), porém foi relatado no “gráfico de linhas para brotamento (figura 22)” somente para constar.
Figura 18: Broto fotografado aos 180 dias (Grupo II).

Fonte: Macedo, A. M. 2010.
Considerando o tempo de amostragem foram observadas diferenças estatísticas entre as amostragens realizadas aos 21 e 180 dias e aos 49 e 180 dias após a implantação do experimento (ANOVA; F=4; P=0,0303). Apresentaram crescimento de brotos relacionados com o tempo de amostragem as plantas do grupo I (regressão linear; R2=0,97; P=0,0011) e as plantas do grupo IV (regressão linear; R2=0,81; P=0,0222) (figura 22).
Figura 19: Passo a passo brotamento da planta 04.

Fonte: Macedo, A. M., 2010.
Figura 20: Passo a passo brotamento da planta 15.

Fonte: Macedo, A. M., 2010.
Figura 21: Gráfico de coluna para comprimento médio de brotamentos.
Fonte: Macedo, A. M., 2010.
Figura 22: Gráfico de linha para comprimento médio de brotamentos.
Fonte: Macedo, A. M., 2010.
4.4 Rebentos (brotos já existentes)
Os rebentos (brotos) no pseudobulbo de algumasD. fimbriatum (figura 23), apresentaram desenvolvimento considerável, porém não foram utilizados como dados estatísticos por já existirem em algumas plantas no momento da implantação, sendo considerado somente os brotamentos que se originaram após a aclimatação das plantas.
Figura 23: Rebento na planta 11 (grupo III).

Fonte: Macedo, A. M., 2010
5. DISCUSSÃO
No final de 180 dias, os quatro grupos formados apresentaram algum tipo de resultado considerado positivo, desenvolvimento de novos componentes do sistema radicular ou novos brotamentos, algumas plantas apresentando desenvolvimento nas duas variáveis a considerar.
Comparando o resultado do trabalho ao projeto de Sorace et al., 2007, que testou variadas taxas de sacarose em diferentes meios de cultura e obteve resultados satisfatórios na sobrevivência e desenvolvimento das plântulas de Dendrobium nobile lindley, podemos perceber que em meio natural as Dendrobium também são capazes de obter os nutrientes essenciais à sua fase vegetativa.
As Dendrobium necessitam de luminosidade difusa intensa indireta ou luminosidade indireta, para que desenvolvam pseudobulbos saudáveis, são plantas altamente resistentes podendo tolerar variáveis taxas de luz solar direta, informação esta comprovada pelo grupo II, que foi o menos sucedido em meio natural, porém as plantas não morreram perante luz solar intensa.
Moraes et al. (2002) desenvolveu um estudo em laboratório para o comprimento de raiz de Dendrobium nobile, onde relatou diferença significativa entre os tratamentos, sendo o substrato xaxim desfibrado superior aos demais substratos. Afirmou que tais plantas desenvolvem-se melhor em substratos de textura relativamente grossa e de drenagem livre, em meu projeto não foi levada em conta a espessura da casca das árvores (substrato) onde as plantas foram instaladas, mas a drenagem livre proporcionando melhor aeração das raízes foi um fator primordial nos resultados positivos do projeto, sendo esta aeração fundamental para raízes de plantas epífitas segundo Raven et al. (1996).
Estudo realizado por Saito et al. (2006), avaliou a aclimatação de orquídeas em diferentes meios de cultura, onde as plântulas foram submetidas por 130 dias, apresentando diferentes resultados quando analisou se o número de folhas e número de raízes, para a variável número de raízes, o meio alternativo com polpa de tomate, ágar e sacarose mostrou-se mais eficiente, neste as plântulas apresentaram em média 3,34 raízes, resultados bastantes satisfatórios comparados ao “EFEITO DA LUMINOSIDADE EM DENDROBIUM” em meio natural.
Para se comparar o desenvolvimento de duas espécies de orquídeas Laelia purpurata e Cattleya bicolor de aproximadamente 5 cm de comprimento por plântula, foi usado diferentes meios de cultivo, onde foi adotado como critério a formação de brotos e número de raízes novas. Bevilaqua e Ducca (2006) observaram um maior desempenho em brotos da espécie Cattleya bicolor nos meios MS controle e Knudson controle, com relação aos outros tratamentos. Já para Laelia purpurata o melhor desempenho em brotos foi notado no meio de cultivo MS com incremento de inositol.
Em relação ao número de raízes novas formadas, o meio que se mostrou mais eficaz para as plântulas de Catlleya bicolor foi o Knudson controle enquanto que para as plântulas de Laelia o melhor foi Knudson com incremento de inositol, as Dendrobium em meio natural se mostraram bastantes eficientes em obter brotamentos e raízes com recursos próprios, deixando claro que as orquídeas possuem grande capacitação para a readaptação em meio natural.
Silva (1986), relatou em sua obra que as orquídeas se adaptam bem à chamada meia-sombra que pode ser obtida embaixo de árvores, sob ripados de madeira ou mesmo em varandas em que não incida sol direto, com exceção dos primeiros raios matinais. Na natureza e no jardim doméstico quase todas as orquídeas se desenvolvem em locais onde são protegidas da luz solar direta, com raras exceções. Segundo Silva (1986), o Dendrobium gosta de luminosidade em 60% ou sol fraco nas primeiras horas da manhã, sendo estas afirmações comprovadas em meu projeto onde o grupo I residente à sombra com sol direto pela manhã, e o grupo IV isento de sol direto residindo à meia sombra, apresentaram valores vantajosos quando comparados aos grupos implantados ao sol direto durante todo o dia e no período da tarde.
As Dendrobium são plantas tolerantes a temperaturas variadas, porém em ambientes sombreado, algumas espécies dependem de boa luminosidade ou sombreamento médio como informam Cyrillo e Sáfadi (vol. 1), sendo estas informações constatadas pelos resultados dos grupos I e IV, que foram os mais positivos por estarem em maior condição de sombreamento.
6. CONCLUSÃO
Analisando o desenvolvimento das orquídeas nas diferentes taxas de luminosidade que varia a cada grupo, fica claro que somente as Dendrobium nobile lindley apresentaram dados positivos de aclimatação no período de 6 meses. Torna-se necessário a continuidade do projeto para que se possa avaliar a aclimatação das Dendrobium fimbriatum, que dispersaram grande quantidade das folhas, um recurso utilizado por diversas espécies de plantas que evita a transpiração excessiva do vegetal, e mantiveram os pseudobulbos aparentemente saudáveis, apresentando desenvolvimento considerável nos rebentos existentes.
Um dos fatores essenciais ao crescimento das orquídeas é a umidade relativa do ar, que por meio de estruturas especializadas das plantas desta família conseguem absorver tal umidade. Durante o período do inverno, ocorreu uma seca prolongada tornando a taxa de umidade relativa do ar mais baixa fator que com certeza desfavoreceu a adaptação com menores valores estatísticos neste período.
As plantas do grupo I foram instaladas em um ambiente onde receberam luz solar direta somente no período da manhã, e foi o grupo que apresentou maior sucesso depois de avaliado estatisticamente para crescimento radicular, e desenvolvimento de brotos bastante significativo não diferindo do grupo IV.
As plantas do grupo II não apresentaram nenhuma característica que pudesse ser levada em consideração para confirmar alguma taxa de aclimatação, podendo constatar-se que expostas ao Sol no período da manhã e da tarde, as plantas sofreram estresse devido a luminosidade excessiva, gastando toda energia adquirida, um recurso de sobrevivência até adaptarem à luminosidade extrema.
No grupo III, que residiu em um local com luz solar direta no período da tarde, apresentou tanto desenvolvimento de brotos como de raízes, porém ambos inferiores aos valores do grupo I e grupo IV. As plantas deste grupo III tiveram desenvolvimento tardio e mais lento quando comparado aos grupos citados acima (I e IV), deixando claro que o Sol da tarde por ser mais intenso não se torna o mais apropriado ao cultivo das Dendrobium.
Uma vez que não expostas a nenhuma taxa de luz solar direta, as plantas do grupo IV apresentaram desenvolvimento de brotamentos bem superior às do grupo III, porém não diferindo do grupo I. Apresentaram também crescimento significativo no sistema radicular que não diferiu estatisticamente do grupo III, porém sendo inferior ao grupo I.
De acordo com todas as informações adquiridas por meio de pesquisa bibliográfica, com todos os dados obtidos em trabalho de campo e transformados em dados estatísticos, conclui-se que a melhor taxa de luminosidade à aclimatação das Orquidaceae Dendrobium nobile lindley foi o Sol do período da manhã, por ser menos intenso a estes vegetais, podendo ainda afirmar que a espécie pode ser cultivada muito bem a luminosidade indireta como se constatou nas plantas do grupo IV. Para a espécie Dendrobium fimbriatum o tempo decorrido de 180 dias não foi o suficiente para avaliar o efeito da luminosidade na aclimatação das plantas.
REFERÊNCIAS BIBLIOGRÁFICAS
AGAREZ, F. V. et al.Botânica Angiospermae. 2 ed.-Rio de Janeiro: Âmbito cultural,1994
ALVES, C. et al. A Cultura de Tecidos na Agricultura. I Jornada Científica e VI FIPA do Centro Federal de Educação Tecnológica de Bambuí – CEFET-Bambuí, 2008
ALTAFIN, V.L. et al. Semeadura in vitro de orquídeas para propagação massal. Espírito Santo do Pinhal: Unipinhal, 14p. 2003
AMORA, S. Minidicionário da língua portuguesa. Editora Saraiva. 3ª edição- 1998.
ARAUJO, A.G. et al. Crescimento in vitro de Laelia tenebrosa (Orquidaceae) em diferentes concentrações de sais de Knudson C e carvão ativado. Plant Cell Culture & Micropropagation, v.2, n.2, p.53-106, 2006.
ATWOOD, J. T. The size of the orquidaceae and the systematic distribution of epiphytic orquids. Selbyana 9:171-186, 1986
BATCHELOR, S.R. Orchid culture - 6 - watering. Am. Orchid Soc. Bul . West Palm Beach, v. 50, n. 8, p. 945-952, 1981.
BATISTA, J. A. N. e BIANCHETTI, L. de B. Lista atualizada das Orchidaceae do Distrito Federal. Embrapa Recursos Genéticos e Biotecnologia.Brasília-DF, Acta Bot. Bras. vol.17 no. 2, São Paulo. 2003
BEVILAQUA, M. R. R. e DUCCA, F. COMPARAÇÃO DO DESENVOLVIMENTO IN VITRO DE Laelia purpurata e Cattleya bicolor (ORCHIDACEAE). CESUMAR – Centro Universitário de Maringá, Maringá – Paraná. 2006
BRAGA, P. I. S. Orquídeas: Biologia floral. Ciência Hoje, 1987
BUZATO, et al. Levantamento da família orquidaceae ocorrentes na Fazenda São Maximiliano. Município de Guaíba, Rio G. do Sul. Rev. Bras. Biociências. 5 (2/3):19-25. 2007
CALDAS, L.S. et al. Meios nutritivos. Brasília: EMBRAPA/CNPH, p.87-132. 1998
CAMPOS, F. A. D. B. Considerações sobre a Família Orquidacea: taxonomia, antropismo, valor econômico e tecnologia. UNICAMP, 2008. E-mail: deannabuono@yahoo.com.br
CENTRO UNIVERSITÁRIO DAS FACULDADES ASSOCIADAS DE ENSINO – FAE.Projeto Pedagógico Institucional. São João da Boa Vista. 2006
CENTRO UNIVERSITÁRIO DAS FACULDADES ASSOCIADAS DE ENSINO – FAE. Manual de orientação para produção de texto científico no UNIFAE. São João da Boa Vista-SP. 2007
CYRILLO, L. F. e SÁFADI, R. S. Guia de orquídeas espécies. Ed. Casa Dois. Vol. 1. São Paulo.
DEMATTÊ, J.B. e DEMATTÊ, M.E.S.P. Estudos hídricos com substratos vegetais para o cultivo de orquídeas epífitas. Pesq. Agropecu. Bras., Brasília, v. 31, n. 11, p. 803-808, 1996.
DRESSLER, R. L. Features of pollinaria and orchid classification. Lindleyana. 1 (2):125-30, 1986
DUNSTERVILLE, G. C. K. e GARAY, L. A.Venezuelan orchids illustrated I. London: André Deustch. 448p. 1959
ESAU, K. Anatomia das plantas com sementes. Editora Edigard Blucher Ltda-São Paulo, 1974
GARAY, L. A. On the origin of the orquidaceae. Botanical Museum Leaflets of Harvard University, 19:57-96. 1960
GIULIETTI, A. M. et al.Plantas raras do Brasil. Editora Conservação internacional, 2009
HUSTON, M. A. Biological Diversity. New York: Cambridge University Press. 1994
INGROUILLE, M.Diversities and evolution of land plants. 3 ed. London: Chapman e Hall. 1995
JOLY, B. A.Botânica: Introdução à taxonomia vegetal. São Paulo: Ed. Nacional. 1991
JUNIOR, C. J. dos S.Micropropagação de orquídeas através de cultivo de ápices caulinares. Instituto Federal de Educação, Ciência e tecnologia. Catarinense, Campus Araquari. 2009
MARCONI, M. A. e LAKATOS, E. M. Técnicas de pesquisa. São Paulo: Atlas, 1999
MARTINI, P. C. et al. Propagação de orquídea Gongora quinquenervis por semeadura in vitro. Pesq. agropec. bras., Brasília, v. 36, n. 10, p. 1319-1324, 2001
MYERS, N. et al.Biodiversity hotspots for conservation priorities. Nature. Vol. 403, 2000
MORAES, L. M. et al. Substratos para aclimatização de plântulas de Dendrobium nobile Lindl. (Orchidaceae) propagadas in vitro. Departamento de Agronomia, Universidade Estadual de Londrina, Londrina, Paraná, Brasil. 2002
MULLER, T. S. et al.Crescimento in vitro e aclimatação de plântulas de Miltonia flavescens. Revista Brasileira de Biociências, Porto Alegre, v. 5, supl. 2, p. 252-254, jul. 2007
OLIVEIRA, V. D. C. e SAJO, M. das G. Anatomia foliar de espécies epífitas de Orchidaceae. Rev. bras. Bot. vol. 22 n.3 São Paulo Dec. 1999
PASQUAL, M.Introdução: fundamentos básicos. In: Curso de especialização à distância cultura de tecidos vegetais (CTV). Lavras: UFLA/FAEPE. p. 97, 2001
POR, F. D. The Atlantic Rain Forest of Brazil. Sooretama. SPB Academic Publishing, The Hague, 1992
RAVEN, P. H. et al.Biologia Vegetal. Quinta edição.Editora Guanabara Koogan, 1996a.
RAVEN, P. H. et al.Biologia Vegetal. Sétima edição.Editora Guanabara Koogan, 2007b.
RUSCHI, A. Orquídeas do Espírito Santo. 2 ed. Rio de Janeiro: EXPED. 1986
SAITO, B. C. et al. CULTIVO IN VITRO DE PLÂNTULAS DE ORQUÍDEAS EM MEIO DE CULTURA SUPLEMENTADO COM POLPA DE TOMATE. CESUMAR – Centro Universitário de Maringá, Maringá – Paraná. 2006
SILVA, W. Cultivo de orquídeas no Brasil. São Paulo: Nobel, 1986
SOARES, J. D. R. et al.Concentrações de sais do meio Knudson C e de ácido giberélico no crescimento in vitro de plântulas de orquídea. Departamento de Biologia, Universidade Federal de Lavras (UFLA), Lavras, MG, Brasil. E-mail: mpasqual@ufla.br
SORACE, M. et al.Crescimento in vitro de Oncidium baueri (Orchidaceae) em diferentes concentrações de macronutrientes e sacarose. Semina: Ciências Agrárias, Londrina, v. 29, n. 4, p. 775-782, 2007.
SOUTO, J de S. et al. Efeitos do ácido naftalenoacético no desenvolvimento in vitro de Cattleya bicolor Lindl. (Orchidaceae). Revista brasileira de Biociências. Porto Alegre. v. 8, n. 2, p. 179-185, 2010
SOUZA, V. C. e LORENZI, H. Botânica Sistemática. Nova Odesa, SP: Instituto Plantarum, 2005
TOMBOLATO, A. F. C. e COSTA, A. M. M. Micropropagação de plantas ornamentais. Campinas: Instituto agronômico (Boletim técnico 174), 1998
TORRES, A. C. et al. Cultura de tecidos e transformação genética de plantas. V. 1 e 2. Brasília, Embrapa, 864 p. 1998
PIJL, L. V. D. e DODSON, C. H. Orquid Flowers: Their pollination and evolution. Coral gables, University of Miami Press. 214 p. 1966
VIDAL, W. N. e VIDAL, M. R. R.Botânica organografia – Quarta edição. Editora UFV, 2000
ANEXOS
Comprimento médio de raiz (cm)
ANOVA 2 critérios
FONTES DE VARIAÇÃO GL SQ QM
Tratamentos 2 8.392 4.196
Blocos 4 4.884 1.221
Erro 8 2.315 0.289
--- --- ---
F (tratamentos) = 14.4964 --- ---
p (tratamentos) = 0.0026 --- ---
F (blocos) = 4.2185 --- ---
p (blocos) = 0.0398 --- ---
--- --- ---
Médias (tratamentos):
Média (Coluna 1) = 2.1000 --- ---
Média (Coluna 2) = 0.3150 --- ---
Média (Coluna 3) = 0.8500 --- ---
--- --- ---
Newman-Keuls Q (p) ---
Médias ( 1 a 2) = 7.4190 < 0.01 ---
Médias ( 1 a 3) = 5.1954 < 0.05
Médias ( 2 a 3) = 2.2236 > 0.05 ---
--- --- ---
Médias (blocos): --- --- ---
Média (Linha 1) = 0.1917 --- ---
Média (Linha 2) = 0.6917 --- ---
Média (Linha 3) = 1.2917 --- ---
Média (Linha 4) = 1.5083 --- ---
Média (Linha 5) = 1.7583 --- ---
--- --- ---
Newman-Keuls Q (p) ---
Médias ( 1 a 2) = 1.6097 > 0.05 ---
Médias ( 1 a 3) = 3.5414 > 0.05 ---
Médias ( 1 a 4) = 4.2390 > 0.05 ---
Médias ( 1 a 5) = 5.0438 < 0.05 ---
Médias ( 2 a 3) = 1.9317 > 0.05 ---
Médias ( 2 a 4) = 2.6292 > 0.05 ---
Médias ( 2 a 5) = 3.4341 > 0.05 ---
Médias ( 3 a 4) = 0.6975 > 0.05 ---
Médias ( 3 a 5) = 1.5024 > 0.05 ---
Médias ( 4 a 5) = 0.8049 > 0.05 ---
Comprimento médio de raiz (cm)
Regressão Linear Simples
Apenas grupo IV
Fontes de variação GL SQ QM
Regressão 1 0.9972 0.9972
Erro 3 0.0078 0.0026
Total 4 1.0050 ---
--- --- ---
F (regressão) = 382.1280 (p) = 0.0003 ---
Variável dependente = Coluna 3 --- ---
Variável independente = Coluna 5 --- ---
Média (X) = 94.8000 --- ---
Média (Y) = 0.8500 --- ---
Coef. de Determinação (R2) = 99.22% --- ---
R2 (ajustado) = 98.96% --- ---
Intercepto (a) = 0.1080 t = 2.4376 (p) = 0.0926
Coef. de Regressão (b) = 0.0078 t = 19.5481 (p) = 0.0000
Equação = Y' = a + bX --- ---
IC 95% (a) -0.033 a 0.249 --- ---
IC 95% (b) 0.007 a 0.009 --- ---
Comprimento médio de brotos (cm)
ANOVA 2 critérios
FONTES DE VARIAÇÃO GL SQ QM
Tratamentos 2 29.682 14.841
Blocos 4 47.906 11.976
Erro 8 20.371 2.546
--- --- ---
F (tratamentos) = 5.8281 --- ---
p (tratamentos) = 0.0272 --- ---
F (blocos) = 4.7032 --- ---
p (blocos) = 0.0303 --- ---
--- --- ---
Médias (tratamentos):
Média (Coluna 1) = 3.3650 --- ---
Média (Coluna 2) = 0.8000 --- ---
Média (Coluna 3) = 4.0750 --- ---
--- --- ---
Newman-Keuls Q (p) ---
Médias ( 1 a 2) = 3.5942 < 0.05 ---
Médias ( 1 a 3) = 0.9949 > 0.05
Médias ( 2 a 3) = 4.5891 < 0.05 ---
--- --- ---
Médias (blocos): --- --- ---
Média (Linha 1) = 0.7750 --- ---
Média (Linha 2) = 1.0583 --- ---
Média (Linha 3) = 2.5083 --- ---
Média (Linha 4) = 3.8083 --- ---
Média (Linha 5) = 5.5833 --- ---
--- --- ---
Newman-Keuls Q (p) ---
Médias ( 1 a 2) = 0.3075 > 0.05 ---
Médias ( 1 a 3) = 1.8814 > 0.05 ---
Médias ( 1 a 4) = 3.2924 > 0.05 ---
Médias ( 1 a 5) = 5.2190 < 0.05 ---
Médias ( 2 a 3) = 1.5739 > 0.05 ---
Médias ( 2 a 4) = 2.9849 > 0.05 ---
Médias ( 2 a 5) = 4.9115 < 0.05 ---
Médias ( 3 a 4) = 1.4110 > 0.05 ---
Médias ( 3 a 5) = 3.3377 > 0.05 ---
Médias ( 4 a 5) = 1.9266 > 0.05 ---
Regressão linear
Comprimento médio de brotos (cm) – apenas grupo I
Fontes de variação GL SQ QM
Regressão 1 42.8601 42.8601
Erro 3 0.9469 0.3156
Total 4 43.8070 ---
--- --- ---
F (regressão) = 135.7960 (p) = 0.0011 ---
Variável dependente = Coluna 1 --- ---
Variável independente = Coluna 5 --- ---
Média (X) = 94.8000 --- ---
Média (Y) = 3.3650 --- ---
Coef. de Determinação (R2) = 97.84% --- ---
R2 (ajustado) = 97.12% --- ---
Intercepto (a) = -1.4996 t = -3.0779 (p) = 0.0542
Coef. de Regressão (b) = 0.0513 t = 11.6532 (p) = 0.0014
Equação = Y' = a + bX --- ---
IC 95% (a) -3.050 a 0.051 --- ---
IC 95% (b) 0.037 a 0.065 --- ---
Regressão linear
Comprimento médio de brotos (cm) – apenas grupo IV
Fontes de variação GL SQ QM
Regressão 1 17.5553 17.5553
Erro 3 2.9310 0.9770
Total 4 20.4863 ---
--- --- ---
F (regressão) = 17.9687 (p) = 0.0222 ---
Variável dependente = Coluna 3 --- ---
Variável independente = Coluna 5 --- ---
Média (X) = 94.8000 --- ---
Média (Y) = 4.0750 --- ---
Coef. de Determinação (R2) = 85.69% --- ---
R2 (ajustado) = 80.92% --- ---
Intercepto (a) = 0.9617 t = 1.1218 (p) = 0.3436
Coef. de Regressão (b) = 0.0328 t = 4.2390 (p) = 0.0240
Equação = Y' = a + bX --- ---
IC 95% (a) -1.766 a 3.689 --- ---
IC 95% (b) 0.008 a 0.057 --- ---
Publicado por: Alberto Motta Macedo
O texto publicado foi encaminhado por um usuário do site por meio do canal colaborativo Monografias. Brasil Escola não se responsabiliza pelo conteúdo do artigo publicado, que é de total responsabilidade do autor . Para acessar os textos produzidos pelo site, acesse: https://www.brasilescola.com.